左卡尼汀对睾丸生精功能损伤模型小鼠保护作用的研究
纪智勇 姚晨成 赵晶鹏 许俊伟 李 铮
肿瘤性疾病的治疗手段主要包括,放射治疗、化学治疗(简称化疗)、手术治疗或联合治疗。随着医疗水平的提高和上述治疗方案的改进,肿瘤患者的生存时间得以延长,生存率显著提高。但这些治疗手段可导致患者并发卵巢早衰或男性生殖细胞大量丢失。烷化剂白消安作为一种常见的抗肿瘤药物,可导致睾丸生精功能的损伤。治疗期间,患者出现少精甚至无精等药物不良反应。白消安损伤睾丸生精功能的机制尚未完全明确,且无特效缓解或逆转的方法[1]。左卡尼汀(L-carnitine,LC),又名左旋肉碱,是哺乳动物机体能量代谢必需的天然物质,其主要功能是促进脂肪酸的β-氧化作用,同时具有抗氧化、清除自由基等功能,为临床治疗男性不育的常用药物[2-5]。本研究拟应用白消安建立无精子症小鼠模型,并采用LC灌胃行干预治疗,以评估LC恢复模型小鼠生精功能的有效性及其药物安全性,为临床治疗化疗相关的睾丸功能损伤提供理论依据。
1 材料与方法
1.1 实验试剂与仪器 白消安购自德国Sigma-Aldrich公司(批号为B2635);LC口服液(10 mL∶1 g)购自意大利Alfasigma S.p.A公司(注册证号为H20130455,产品批号为170469);小鼠睾酮(testosterone,T)、小鼠黄体生成素(luteinizing hormone,LH)、小鼠卵泡刺激素(follicle-stimulating hormone,FSH)ELISA试剂盒均购自南京森贝伽生物科技有限公司(货号分别为SBJ-MO439、SBJ-MO408、SBJ-MO479,批号均为202006)。光学显微镜购自德国Leica公司(型号为RMLB)。石蜡切片机购自美国AO公司(型号为820)。
1.2 实验动物分组、模型建立与标本采集 40只4周龄雄性C57BL/6小鼠及其饲养场地,均由上海南方模式生物科技股份有限公司提供[许可证号为SYXK (沪)2018-0002]。实验小鼠自由摄食、饮水,饲养环境温度控制于20~25 ℃,相对湿度维持于40%~60%,工作照度为200 Lx,动物照度为15 Lx,昼夜明暗交替间隔时间为12 h。将实验小鼠随机分为5组,分别为正常对照组、白消安造模后0.9%氯化钠溶液灌胃组(白消安组),以及白消安造模后低剂量LC灌胃组(低LC组)、中剂量LC灌胃组(中LC组)和高剂量LC灌胃组(高LC组),每组8只。经过1周的喂养与环境适应,除正常对照组外,其余4组均予白消安35 mg/kg腹腔内注射以杀伤进入分化阶段的精原干细胞,建立无精子症小鼠模型。LC的给药剂量按照人-小鼠体表面积换算确立:建模4周后,正常对照组予正常饮食,白消安组予0.9%氯化钠溶液100 μL/(10 g·d)灌胃4周。低、中、高LC组分别予LC 200、400、800 mg/(kg·d)连续灌胃4周。最后一次灌胃24 h后,称重各组小鼠,以5%水合氯醛100 μL/10 g行腹腔内注射麻醉小鼠,后摘眼球取血并检测性激素(T、LH、FSH)水平。采血完成后,采用颈椎脱臼法处死小鼠,经腹部正中切口游离出双侧睾丸并称重,双侧睾丸总质量与小鼠原体重的比值为该小鼠的睾丸器官指数。将睾丸予以固定并制作切片。实验过程中对动物的处置符合《实验动物护理和使用指南》,伦理号为2018-0005。
1.3 石蜡包埋、切片与H-E染色 将新鲜组织置于固定液中>24 h。在通风橱内取出组织,用手术刀将目的部位组织修剪平整,并置于对应的脱水盒内。随后浸泡于浓度梯度依次升高的乙醇溶液行脱水。之后依次浸泡于醇苯溶液5~10 min、二甲苯溶液 Ⅰ 5~10 min、二甲苯溶液 Ⅱ 5~10 min、65 ℃融化石蜡Ⅰ 1 h、65 ℃融化石蜡Ⅱ 1 h、65 ℃融化石蜡Ⅲ 1 h。浸蜡完成后,于包埋机内包埋组织。将包埋好的组织切片,依次放入二甲苯溶液 Ⅰ 20 min、二甲苯溶液 Ⅱ 20 min、无水乙醇溶液 Ⅰ 5 min、无水乙醇溶液 Ⅱ 5 min、75%乙醇溶液5 min后,自来水清洗;苏木精染液染色3~5 min,自来水清洗;分化液分化,自来水清洗;返蓝液返蓝,流水冲洗。将组织切片依次放入85%、95%乙醇溶液中脱水各5 min。伊红染液染色5 min后脱水封片。H-E染色完成后,于光学显微镜下观察各切片。
1.4 小鼠生精功能检测 按照相应的ELISA试剂盒说明书对各组小鼠性激素(T、LH、FSH)水平进行检测。根据Johnsen评分标准,对H-E染色的小鼠睾丸组织石蜡切片进行评分,每个睾丸切片计数50个生精小管管腔。

2 结 果
2.1 5组小鼠一般情况与睾丸器官指数比较5组小鼠均存活,一般情况好,体重均呈正常增长,未见进食量减少、活动量减少、体毛黯淡等。正常对照组、白消安组、低LC组、中LC组、高LC组小鼠的睾丸器官指数分别为(7.0±2.9)、(3.0±0.7)、(3.1±0.8)、(2.4±0.2)、(2.6±0.3)。白消安组、低LC组、中LC组、高LC组小鼠睾丸器官指数均显著低于正常对照组(P值均<0.001)。而白消安组与低LC组、中LC组和高LC组睾丸器官指数的差异无统计学意义(P值均>0.05)。小鼠睾丸的病理学检查结果显示,白消安组小鼠管腔内均未见精子形成,多数生精小管明显萎缩,但仍可维持管状结构,管腔内生精细胞层次明显减少;少量生精小管管腔较为完整,可见不同时期生精细胞。提示小鼠睾丸生精功能受损。见图1。
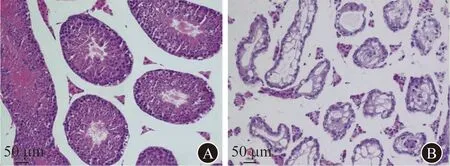
A 正常对照组小鼠睾丸组织切片,生精小管管腔结构完整,可见各级生精细胞 B 白消安组小鼠睾丸组织切片,小鼠生精小管管腔塌陷,仅存少量支持细胞和精原细胞图1 正常对照组与白消安组小鼠睾丸病理学检查(H-E染色,×200)
2.2 LC对白消安造模后小鼠睾丸组织生精功能的影响 正常对照组、白消安组、低LC组、中LC组和高LC组小鼠性激素(T、LH、FSH)水平的差异均无统计学意义(P值均>0.05)。见表1。小鼠睾丸的病理学检查结果显示,与白消安组相比,低、中、高LC组生精小管排布更为规则,生精细胞排列紧密和层次分明的圆形或卵圆形管腔更多;与低LC组相比,中、高LC组形态较好的生精小管更多;中、高LC组间镜下表现相似。见图2。正常对照组、白消安组、低LC组、中LC组、高LC组小鼠睾丸Johnsen评分分别为(9.9±0.1)、(4.3±0.3)、(4.8±0.3)、(5.4±0.4)、(5.6±0.5)分;4组造模组小鼠的睾丸Johnsen评分均显著低于正常对照组(P值均<0.001);低、中、高LC组的睾丸Johnsen评分均显著高于白消安组(P值分别为0.018,<0.001,<0.001);中、高LC组的睾丸Johnsen评分均显著高于低LC组(P值分别为0.022,<0.001),高LC组与中LC组间的差异无统计学意义(P值=0.524)。
表1 5组小鼠性激素水平比较
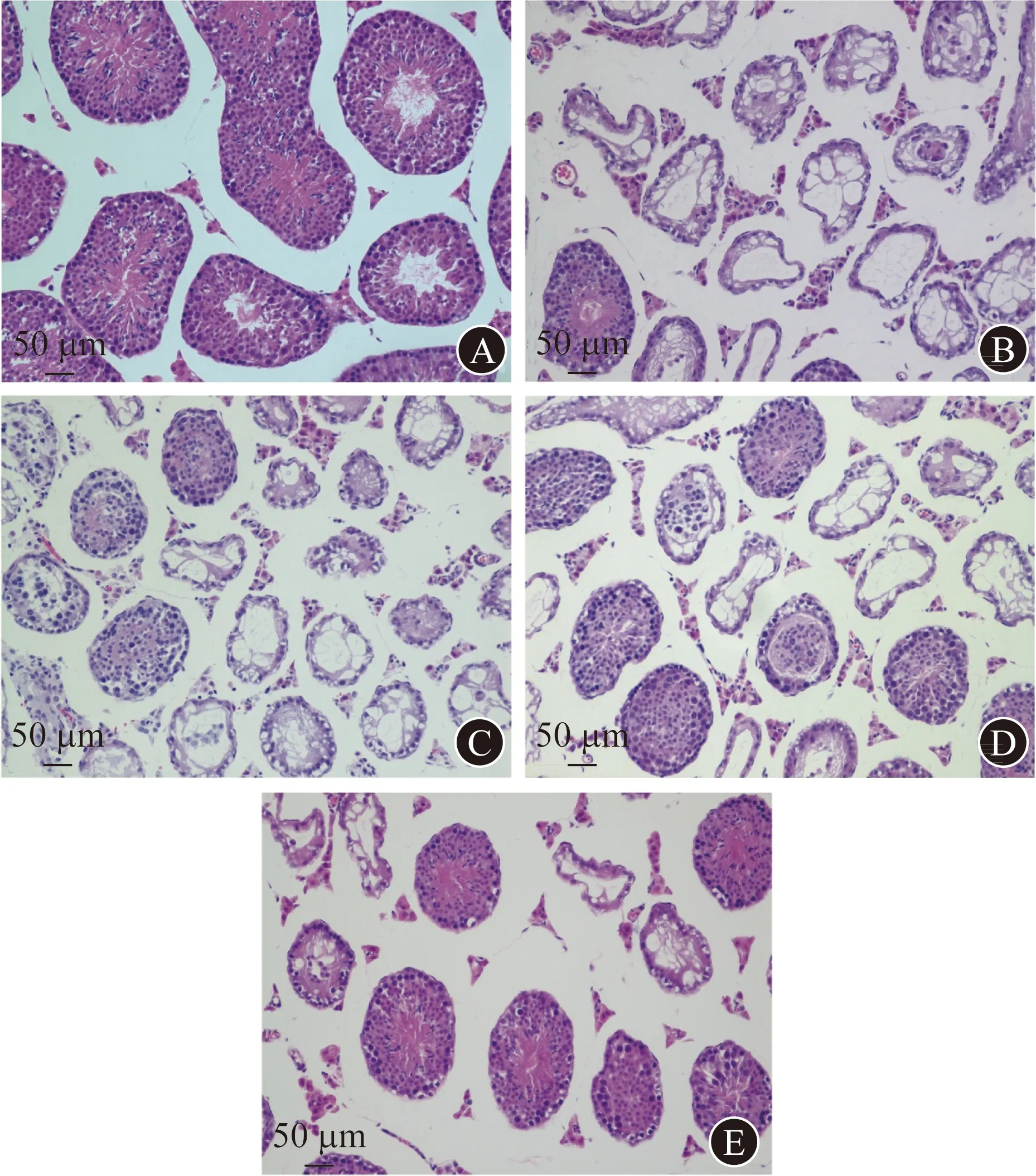
A 正常对照组 B 白消安组 C 低LC组 D 中LC组 E 高LC组图2 5组小鼠睾丸病理学检查(H-E染色,×200)
3 讨 论
LC为具有生物学活性的类维生素样物质,是哺乳动物体内能量代谢过程中必需的天然物质,其主要功能之一是促进脂类代谢。LC可促使脂肪酸进入线粒体,并经β-氧化反应途径,进入三羧酸循环。LC可以输出线粒体内所产生的短链脂酰基,也可将细胞内长链脂肪酸带进线粒体基质,并促进其氧化分解,为细胞提供能量[6]。
LC亦具有抗氧化应激的作用,当自由基损伤线粒体膜时,能及时起到修复和抗氧化作用,保护多种器官,这是LC广泛应用于临床的主要原因。但该类维生素样物质对肿瘤患者化疗引起的生殖功能障碍的作用研究鲜见。同时,临床亦缺乏LC用药有效性和安全性的相关证据[7]。
目前,使用白消安作为肿瘤用药已在临床较为普遍,随着用药方案或联合治疗用药配伍的改进,患者生存率和(或)治疗成功率均显著升高。但是,生育能力降低是白消安难以避免的药物不良反应,且尚无有效的临床治疗策略。有研究[8]结果表明,白消安可导致内质网应激,诱导活性氧的产生,引发生殖细胞凋亡和睾丸损伤。因此,白消安造成的生精功能损害,可否被LC缓解甚至逆转,以及其药物安全性是本研究探讨的问题。
小鼠腹腔内注射白消安是较为成熟的建立不育症动物模型的方法,能够形成一种类似继发于唯支持细胞综合征的不育症动物模型,该类模型动物生精小管的病理学、生物化学代谢改变和临床特征均类似于无精子症患者[9-10]。白消安腹腔内注射4周,小鼠睾丸内活跃的生殖细胞在药物作用下会发生变性、坏死。在本研究中,造模后的小鼠睾丸生精小管明显萎缩,管壁生精细胞层次显著减少、排列紊乱且间质细胞减少,与正常对照组相比,4组造模组小鼠的睾丸组织Johnsen评分显著降低,提示无精子症小鼠模型建造成功。此时,开始给予LC灌胃,以探究LC对白消安造模小鼠的生精功能恢复的促进作用及其药物安全性。
本研究发现,在LC治疗结束后,即造模后的8周时间,白消安模型小鼠睾丸器官指数较正常组均显著降低。性激素水平检测未发现造模后各治疗组间的统计学差异;进一步进行睾丸组织生精功能评分,与白消安组相比,低、中、高LC组生精小管排布更为规则,生精细胞排列紧密和层次分明的圆形或卵圆形管腔更多;中、高LC组与低LC组相比,形态较好的生精小管更多;中、高LC组镜下表现则相似。4组造模组小鼠的睾丸组织Johnsen评分较正常对照组均显著降低;低、中、高LC组的睾丸组织Johnsen评分均显著高于白消安组;中、高LC组的睾丸组织Johnsen评分较低LC组显著升高,而高LC组与中LC组间的差异未见统计学意义。文献[11-12]报道显示,LC可拮抗环磷酰胺或射线所致的模型小鼠睾丸组织损伤,进一步说明LC在化疗后生精功能低下或精子发生障碍的模型动物中具有脏器保护作用。在本研究中,低、中、高LC组小鼠中,均未发现有异常行为、皮毛脱落或死亡。白消安组与低LC组、中LC组和高LC组小鼠睾丸器官指数、性激素水平的差异亦无统计学意义,提示LC的药物安全性佳,与既往研究[13]结论相符。
睾丸中精子LC的含量低,进入附睾的精子不断从附睾液中获取LC,随着精子在附睾中的运行,其细胞内的LC含量逐渐增加,获取的LC主要集中在精子线粒体部位,作为脂肪酸和磷脂转运至线粒体内膜的载体,为精子运动提供能量,参与精子的能量代谢[5]。因此,LC在精子形成的后期亦能起到有效的保护作用,为附睾运输阶段提供支持。本研究的观察周期较短,未能进行成熟精子阶段的评估,后续研究可考虑将药物治疗周期延长以对后期精子活力或质量进行评估和研究。
综上所述, LC作为一种水溶性类维生素样物质,在小鼠生精功能损伤模型中的治疗窗口宽,未发现明显的不良反应,安全性高;同时,对模型小鼠的生精功能具有一定的保护作用。本研究结论提示,可进一步探究LC保护小鼠生精功能的相关作用机制,以及保护作用发生的具体阶段,为临床预防性或治疗性使用LC治疗肿瘤化疗患者生精功能损伤提供实验基础和理论依据。

