348例无精子症睾丸穿刺活检的病理学分析
李佩佩 王永霞 徐珊珊 周冰燚 李铭臻
广东省生殖科学研究所//广东省生殖医院//国家卫生健康委员会男性生殖与遗传重点实验室 广东广州 510600
不孕不育已经成为一个世界性生殖健康问题,据不完全统计,约有20%~25%的育龄期的夫妇受此困扰, 其中男性因素约占其中的50%,而无精子症是导致男性不育最常见的病因[1]。如何准确地评价无精子症患者睾丸的生精功能是治疗的前提。睾丸活检可对无精子症患者睾丸的生精功能状态和生精障碍程度进行直接评价分析,对于男性不育症的病因、分类、诊断、治疗和预后评估都具有很重要的意义,也是研究男性不育症的重要方法。但是现阶段评价睾丸生精功能的标准不一,对临床指导性不足。本研究通过对348例无精子症患者睾丸活检的病理资料进行回顾性分析,观察其睾丸组织病理学改变及生精功能状态,对其生精功能进行详尽的病理分型,并分析其临床意义及其对男性不育症诊断治疗的指导价值。
1 对象和方法
1.1 研究对象
选取2017年1月—2019年12月在广东省生殖医院就诊的无精子症患者,纳入标准:①无精子症,至少进行3次常规精液化验并离心沉淀后显微镜下检查均未找到精子;②内分泌检查未见异常;③双侧睾丸大小、质地未见明确异常;④无肿瘤、隐睾病史;⑤患者行睾丸穿刺活检病理检查。本组共348例,年龄23~49岁,平均年龄32.4岁。
1.2 方法
睾丸穿刺组织取出后,立即放入Bouin氏液固定,组织脱水、浸蜡,包埋, 制成蜡块后,切成3 μm的石蜡切片,苏木素-伊红(HE)染色。镜下观察:①曲细精管的数量、形状、管径的大小、基底膜厚度,曲细精管与间质的比例;②各级生精细胞数量、形态、排列分布及各级生精细胞之间的比例,成熟精子的数量;③支持细胞的数量、形态、分布;④间质和间质细胞的数量、分布、形态。
2 结果
无精子症睾丸病理活检组织,取材满意为镜下曲细精管横断面数量≥30 个,入组病例全部取材满意。根据其主要组织病理学特征及有无成熟精子,无精子症睾丸活检可分为2种类型:梗阻性无精子症(obstructed azoospermia,OA)和非梗阻性无精子症(non-obstructed azoospermia,NOA)。
2.1 梗阻性无精子症(OA)
梗阻性无精子症166例,占47.70%,病理形态学特点主要是曲细精管内生精细胞形态及各级生精细胞的比例基本正常,曲细精管内可见成熟精子,基底膜厚度、间质细胞数量及分布基本正常。根据曲细精管内生精细胞和成熟精子的数量不同,可进一步分为生精功能基本正常,平均每个曲细精管横断面成熟精子数量≥20 个;轻度生精功能低下,平均每个曲细精管横断面成熟精子数量≥10 个且<20 个;中度生精功能低下,平均每个曲细精管横断面成熟精子数量≥5个且<10 个;重度生精功能低下,平均每个曲细精管横断面成熟精子数量<5个,见表1、图1。

表1 166例梗阻性无精子症(OA)病理分级

注:A,生精功能大致正常:曲细精管管腔大小正常,生精细胞数量、形态、比例基本正常,成熟精子数量平均≥20个/管;B,轻度生精功能低下:曲细精管管腔大小基本正常,生精细胞形态、比例基本正常,数量略减少,成熟精子数量平均≥10个/管,但是<20个/管;C,中度生精功能低下:生精细胞数量继续减少,精子细胞和成熟精子数量也明显减少,成熟精子数量5≥个/管,但是<10个/管;D,重度生精功能低下:生精细胞数量重度减少,成熟精子数量<5个/管
2.2 非梗阻性无精子症(NOA)
非梗阻性无精子症182例,占52.30%,根据生精细胞的数量和形态特征,可以进一步分为精子成熟阻滞、唯支持细胞综合征(sertoli cell only syndrome,SCOS)、生精小管透明变性,见表2、图2。
2.2.1 精子成熟阻滞 有92例,病理特征为曲细精管管腔大小及其分布大致正常,但曲细精管内生精上皮层次减少,生精细胞数量减少或者正常,生精细胞发育停滞在精子发育的某一阶段,没有发育完全成熟的精子。根据其精子发育过程中细胞停滞在不同的阶段,可以分为精原细胞阶段5例(5.43%)、精母细胞阶段38例(41.30%)和精子细胞阶段49例(53.26%)。
2.2.2 唯支持细胞综合症 有77例,其病理学改变是曲细精管萎缩、纤维化,管径不同程度减小,部分管腔闭塞。管腔内未见生精细胞,只余支持细胞,大部分病例曲细精管基底膜弥漫增厚、玻璃样变性。支持细胞不同程度的增生。少部分病例可见间质和间质细胞增生。
2.2.3 生精小管透明变性 有13例,其组织病理学特点是曲细精管萎缩、纤维化,管径缩小闭塞,基底膜增厚玻璃样变性,管腔内未见残留细胞,部分病例间质和间质细胞增生。

表2 182例非梗阻性无精子症(NOA)病理分型
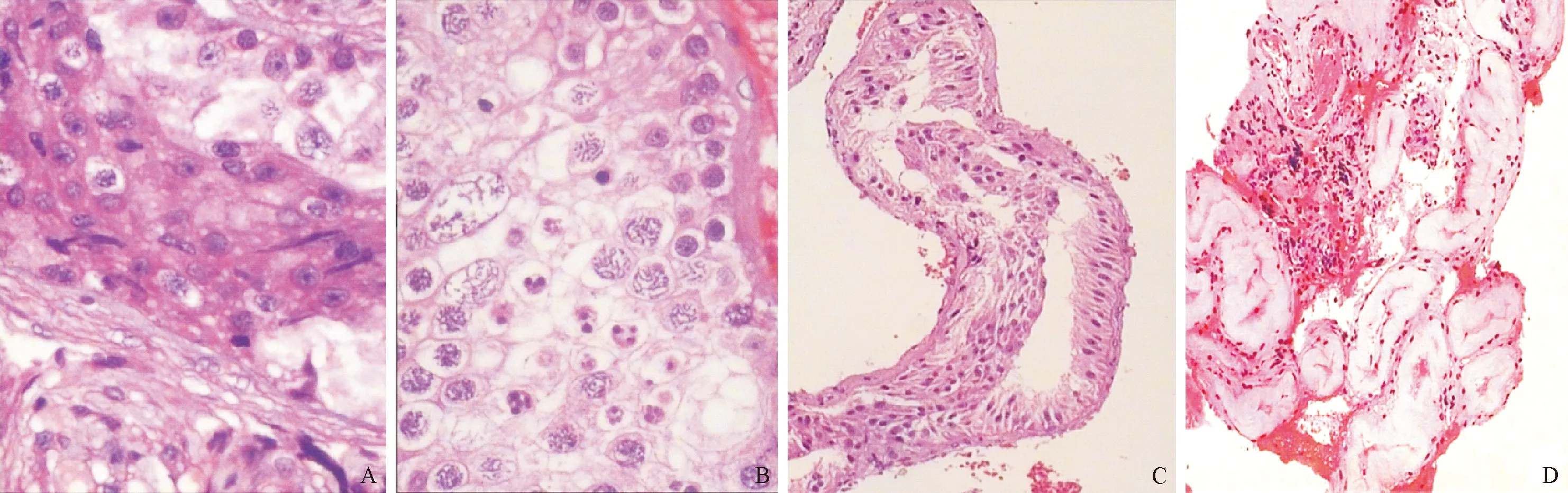
注:A,精子成熟阻滞(精母细胞阶段):曲细精管管腔大小和形态基本正常,生精上皮层次减少,生精细胞数量明显减少,生精细胞发育阻滞在精母细胞阶段,未见精子细胞及成熟精子;B,精子成熟阻滞(精子细胞阶段):生精细胞数量减少,生精细胞发育阻滞在精子细胞阶段,可见较多精子细胞,但是未见明确成熟精子;C,唯支持细胞综合症:曲细精管管腔缩小或正常,管腔内未见生精细胞残留,仅余支持细胞;D,生精小管透明变性:曲细精管萎缩、纤维化,管径缩小闭塞,基底膜增厚玻璃样变性,管腔内未见残留细胞,间质和间质细胞增生
3 讨论
睾丸穿刺病理活检可以直接评价无精子症患者睾丸的生精功能,明确生精功能障碍的类型及病变程度,是无精子症患者的重要检查手段之一,为无精子症患者诊疗措施的选择和预后判断提供直接的依据[2]。随着辅助生育技术的发展,卵细胞胞质内单精子注射技术(intracytoplasmic sperm injection,ICSI)的诞生及推广应用,对无精子症患者睾丸生精功能的病理学评价分析就越发重要。
本研究分析的348例无精子症病例中OA有166例,占无精子症病例的47.70%。OA根据其睾丸生精功能以及曲细精管内生精细胞和成熟精子的数量,可进一步分为生精功能大致正常、轻度生精功能低下、中度生精功能低下和重度生精功能低下。其中生精功能大致正常的病例并不多见,多数是由于后段输精管道阻塞引起的,此种患者睾丸体积大致正常,通过睾丸取精术或附睾取精术可以达到生育下一代的目的。经直肠超声可以确定OA的梗阻部位,能够显著增加取精的成功率[3],具有重要的临床价值。不同程度的生精功能低下,与睾丸取精的成功率密切相关,所以区分出睾丸生精功能的不同程度,对临床具有指导性意义。有文献将生精功能低下与输精管道梗阻分别列为不同类型无精子症[4],其实严格意义来讲,生精功能低下的无精子症也是存在输精管道梗阻,才导致精子输出障碍,本文将其统一列为OA。OA必须观察到成熟精子的存在,部分病例即使见大量精子细胞,而没有“梭形头”的成熟精子,也应该归入精子不完全性成熟阻滞或者精子成熟阻滞于精子细胞阶段。OA曾是难以攻克的男性不育症难题,随着睾丸取精术(testicular sperm extraction,TESE)外科获取精子技术和ICSI的诞生与临床应用,其治疗也取得重大进展[5-6]。ICSI应用于梗阻性无精子症患者睾丸取精术或附睾取精术后,取得了较好的效果[7]。目前梗阻性无精子症的诊疗取得了很多重大的突破性进展,大多数OA患者能够拥有自己的后代。有学者研究发现,对于行辅助生殖技术(assisted reproductive technology,ART)治疗的OA患者,梗阻的病因、精子获取的方法对于ICSI结局并没有明显相关性[8-9]。TESE的成功率与生精功能低下的程度密切相关。睾丸中成熟精子的数量越多,生精功能越好,睾丸取精的成功率越高。轻-中度的生精功能低下,取精成功率较高,而重度生精功能低下,取精成功率较低。因此,睾丸生精功能的评价就显得十分重要,但是生精功能低下与精液细胞学、精子形态、活力相关性不明。
本研究纳入的NOA有182例,占52.30%。根据生精细胞的数量和形态特征,可以进一步分为精子成熟阻滞、SCOS和生精小管透明变性。其中根据生精细胞发育过程阻滞的不同阶段,可以细分为精原细胞阶段、精母细胞阶段和精子细胞阶段。本研究统计的结果中精子成熟阻滞于精子细胞阶段病例较多,多伴有不成熟的精子或精子细胞,又称之为不完全性成熟阻滞,在病理形态学层面上,不完全性的成熟阻滞与重度精子发生低下需要仔细鉴别,鉴别要点是否可见成熟精子。1995年,Fishel等[10]与Tesarik等[11]分别用精子成熟阻滞的患者长形及圆形精子细胞行卵细胞胞质内显微注射,都获得成功,说明不成熟的生精细胞也可以使卵子受精并发育成胚胎,从而实现生育的目的,使得对精子成熟阻滞在精子细胞阶段的无精子症的治疗出现了突破性的进展[12]。精准的对无精子症患者的睾丸生精功能状况进行病理学评价分析,为临床医生提供准确的信息,对治疗无精子症至关重要。部分精子成熟阻滞在精子细胞阶段的病例被划分在生精功能低下中,其实成熟精子的存在才是区别二者的主要标准,对临床的诊断和疗效有着关键的作用。
SCOS是临床无精子症常见的一种病理类型,本研究统计有77例,病理形态学上其曲细精管基底膜增厚玻璃样变,管腔内仅见支持细胞增生,未见生精细胞,临床常伴有激素水平的变化[13]。在正常情况下,曲细精管管壁肌样细胞收缩,使管腔内维持一定的压力,促使精子向附睾方向输送,所以,即使在少数曲细精管管腔中查见极少数精子,因为基底膜玻璃样变伴肌样细胞肿胀变性,精液检查仍表现为无精子症,提示组织学上基底膜透明变性会引起基底膜增厚并导致曲细精管内外部物质交换障碍,而支持细胞功能发生改变及肌样细胞的变性引起的基底膜病变都有可能是导致生精障碍的发病机制[14-15]。SCOS的基底膜病变是如何发生目前尚无定论,有学者研究提出由垂体功能不足引起的SCOS,可以通过向体外培养系统中加入促性腺激素,可能有助于精子发育成熟[16],但在体外培养系统去除了基底膜病变所造成的物质转运障碍,因此极少数SCOS患者从理论上有通过ICSI生育后代的可能。但大多学者认为,以体外培养和使用激素来恢复生育是不可取的,所以SCOS的治疗目前尚有较大争议[17]。
生精小管透明变性病例少见,本研究统计有13例,病理形态学可见曲细精管萎缩闭塞、纤维化,基底膜增厚玻璃样变性,生精细胞、支持细胞完全消失,可见残留少量间质细胞。部分伴明显间质细胞增生,临床大多存在染色体异常。不伴有间质细胞增生,多为毒物、射线、药物或精索静脉曲张。目前条件下此种类型的无精子症患者不能获得自己的遗传学后代[18],只能通过供精达到生育的目的。但是,生精小管透明变性多与其他类型的生精障碍并存,因此临床采取多点穿刺取材非常必要,根据送检的全部曲细精管的生精状态综合进行判断,并结合临床其他检查结果,给出病理诊断。具体情况还应结合临床其他检查结果分析。
综上所述,睾丸组织中生精细胞、支持细胞、间质细胞、基底膜在结构和功能上是密切相关的一个整体,它们相互影响,互为因果,因此,无精子症患者睾丸的病理改变非常复杂[19],在同一病例中不同病理病变类型常混合存在。本研究所采用的分类方法是根据其主要的、特征性的病理特点进行分型。总之,睾丸活检组织病理学评价作为不育症男性的重要检査之一,也是临床生精功能评价的“金标准”,客观准确地评价曲细精管内生精细胞的数量、发育状态、精子形态、精子发生的阶段,进而对患者的生殖能力进行精确评估,指导临床选取最优的治疗方法。但是不同的病理医师对睾丸活检组织中精子发生发育状态的描述及诊断报告有差异性,导致了27%的无精子症患者在选择治疗方法上会有不同[20]。因此,建立一个准确、统一的睾丸活检组织学评价系统,明确各病变亚型的定义,获得量化参数,是睾丸活检病理学评价必须解决的难题,尚需进一步的探讨。

