丁酸氢化可的松乳膏原辅料相容性研究
付志媛,丁志军
江西省皮肤病专科医院,江西 南昌 330001
丁酸氢化可的松(hydrocortisone butyrate,HB),是一种类固醇皮质激素,外用具有抗炎、抗过敏、改善微循环等作用。临床上主要用于治疗湿疹、接触性皮炎、神经性皮炎、尿布疹等角化性皮肤病[1-3]。实验发现,HB 在不同的乳膏基质中稳定性不尽相同。因此,参考相关文献[4-5],对HB 在不同基质中的稳定性进行了分析及试验研究。
1 仪器与材料
1.1 仪器
Sartorius RT125D 电子天平(赛多利斯科学仪器);Agilent 1260 液相色谱仪(美国安捷伦公司);PASJ-3F 型实验室pH 计(上海精密科学仪器有限公司);HKS-250 药品试验箱(上海鸿都电子科技有限公司)。
1.2 材料
HB(浙江仙琚制药股份有限公司,批号:170703);HB 对照品(中国食品药品检定研究院,批号:100303-201902);枸橼酸钠(湖南尔康制药股份有限公司,批号:001220170506);枸橼酸(湖南尔康制药股份有限公司,批号:100820180201);樟脑(福建青松股份有限公司,批号:20170418);二甲基亚砜(湖南九典制药股份有限公司,批号:F25180502);月桂氮酮(湖北科捷制药有限公司,批号:171002);平平加O(江苏海安石油化工厂,批号:171201);平平加A-20(邢台盛达助剂有限公司,批号:170212);吐温80(湖南尔康制药有限公司,批号:101720180503);丙二醇(南昌白云药业有限公司,批号:20180107);甘油(南昌白云药业有限公司,批号:20180511);单硬脂酸甘油酯(湖南尔康制药有限公司,批号:105620180704);十六醇(湖南尔康制药有限公司,批号:105620181001);白凡士林(南昌白云药业有限公司,批号:20180701);轻质液状石蜡(南昌白云药业有限公司,批号:20180107);羟苯乙酯(湖南尔康制药有限公司,批号:103620180307);纯化水(自制)。
2 方法
2.1 有关物质及含量检测方法
2.1.1 色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以水-乙腈-磷酸(50∶50∶0.2)为流动相;检测波长为240 nm。理论板数按HB 峰计算不低于1 500。
2.1.2 测定法取样品适量(相当于HB 约26 mg)置100 mL 量瓶中,加流动相适量振摇使溶解,用流动相稀释至刻度,摇匀,过滤,精密量取5 mL,置50 mL 量瓶中,用流动相稀释至刻度,摇匀,作为供试品溶液。照上述色谱条件,精密量取供试品溶液20 μL,注入液相色谱仪,记录色谱图至主成分峰保留时间的2 倍;另取HB 对照品,同法测定不同浓度下的峰面积,绘制标准曲线,按外标法以峰面积进行计算样品中HB 含量,即得。
2.2 基于参比制剂说明书,对所选原辅料进行相容性试验
2.2.1 原料HB 与促透剂进行原辅料相容性试验试验样品按表1 比例配制,配制好的样品分别放置光照4 500 lx±500 lx、温度40 ℃±2 ℃、相对湿度65%±5%条件下,于0 d、15 d 取样检测HB 有关物质及含量。

表1 原料HB与不同促透剂配制比例表
2.2.2 原料HB 与乳化剂进行原辅料相容性试验试验样品按表2 比例配制,配制好的样品分别放置光照4 500 lx±500 lx、温度40 ℃±2 ℃、相对湿度65%±5%条件下,于15 d取样检测有关物质及含量。

表2 原料HB与不同乳化剂配制比例表
2.2.3 原料HB 与缓冲溶液进行原辅料相容性试验原料HB 和不同pH 值枸橼酸-枸橼酸钠缓冲溶液按下表配制。样品分别放置光照4 500 lx±500 lx、温度40 ℃±2 ℃、相对湿度65%±5%条件下,于15 d 取样检测有关物质及含量。
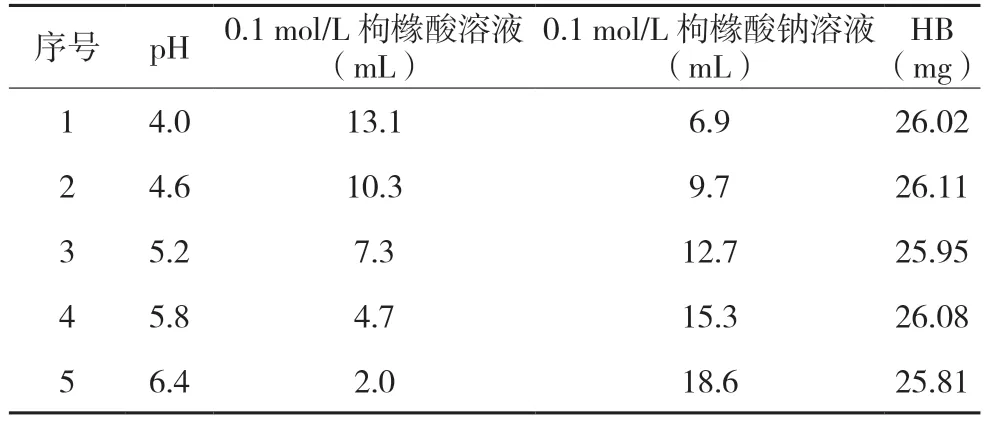
表3 原料HB和不同pH值缓冲溶液配制表
2.3 制剂稳定性试验
成品制备:取单硬脂酸甘油酯、十六醇、白凡士林、轻质液状石蜡、羟苯乙酯加热至约80 ℃,作为油相;另取甘油、丙二醇、平平加A-20、枸橼酸、枸橼酸钠、纯化水加热至约80 ℃,作为水相;将油相缓缓加入水相,边加边搅,待温度降至约50 ℃时,加入溶有HB 的二甲基亚砜和另外的主药,继续搅拌,至冷凝,即得。
2.3.1 加速试验取按上述试验方法制备的成品3批,按市售包装,在温度30 ℃±2 ℃、相对湿度65%±5%的条件下放置3个月。在试验期间第1个月、2 个月、3 个月末分别取样检测有关物质及含量[6]。
2.3.2 长期试验取按上述试验方法制备的成品3批,按市售包装,在温度25 ℃±2 ℃、相对湿度60%±10%的条件下放置12 个月。在试验期间第0个月、3 个月、6 个月、12 个月末分别取样检测有关物质及含量[6]。
3 结果
3.1 原料HB 与促透剂进行原辅料相容性试验结果
原料HB 对照试验结果:与0 d 比较,15 d 后原料HB 有关物质及含量无明显变化。与二甲基亚砜配制试验结果:与0 d 比较,15 d 后原料HB 有关物质及含量无明显变化。与月桂氮酮配制试验结果:与0 d 比较,15 d 后原料HB 有关物质及含量变化较明显。

表4 原料HB与促透剂相容性试验结果(%)
3.2 原料HB 与乳化剂进行原辅料相容性试验结果
在光照4 500 lx±500 lx、温度40 ℃±2 ℃、相对湿度65%±5%条件下,15 d 后:原料HB+促透剂+水相(丙二醇+甘油+纯化水)+平平加O,有关物质量大幅增多,含量下降十分明显;原料HB+促透剂+水相(丙二醇+甘油+纯化水)+平平加A-20,有关物质量有所增多,含量有所下降;原料HB+促透剂+水相(丙二醇+甘油+纯化水)+吐温-80,有关物质量有所增多,含量有所下降;原料HB+促透剂+水相(丙二醇+甘油+纯化水),有关物质量有较大幅增多,含量下降明显。

表5 原料HB与乳化剂相容性试验结果(%)
3.2 原料HB 与缓冲溶液进行原辅料相容性试验结果
原料HB+不同pH 值枸橼酸-枸橼酸钠缓冲溶液在光照4 500 lx±500 lx、温度40 ℃±2 ℃、相对湿度65%±5%条件下,15 d 后,pH5.2、pH6.0 时,HB 含量略有下降,有关物质量略有增多。

表6 原料HB和缓冲溶液相容性试验结果(%)
3.3 制剂稳定性试验结果
3 个月加速试验和12 个月长期试验,杂质Ⅰ含量无明显变化;杂质Ⅱ含量略有增加;HB 含量略有下降。
4 讨论
促透剂相容性试验表明,月桂氮酮不宜与原料HB 配伍。文献报道,月桂氮酮的促透作用会被凡士林降低甚至抵消,而二甲基亚砜作为万能溶媒[8-10],可以充分溶解主药HB,因此,可选用二甲基亚砜为本制剂促透剂、主药HB 溶媒。
乳化剂相容性试验表明,原料HB 容易水解,与文献报道[11]一致;平平加O 可能导致原料HB含量显著降低;另由于抑菌剂羟苯乙酯与吐温类之间会发生络合作用,降低其抑菌效力[7],因此,可选用平平加A-20 为该制剂乳化剂,同时在处方中需加入适量pH 调节剂。
通过制剂3 个月加速试验及12 个月长期试验考察,表明二甲基亚砜、平平加A-20、枸橼酸-枸橼酸钠可分别作为含HB 的乳膏制剂促透剂(主药溶媒)、乳化剂、pH 调节剂(稳定剂)。

