三文鱼中晚期糖基化终末产物含量测定及产地特征因子分析
徐正华,吴家丽,朱克卫,梁玉燊,杨雪娇,赵 勇,凌 菁,郑思珩,周衡刚,张 昆,朱玉珍,曾茂茂,*
(1.黄埔海关技术中心,广东 广州 510770;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;3.广州海关技术中心,广东 广州 510000)
晚期糖基化终末产物(advanced glycation end products,AGEs)是由还原糖和蛋白质、脂质、多肽、氨基酸的末端游离氨基等通过美拉德反应生成的一系列共价加成物总称[1-2]。研究表明,AGEs可以通过食物摄入,其在人体内的积累与糖尿病及其肝病、肾病、心脏病等并发症以及动脉粥样硬化、阿尔茨海默症、骨性关节炎、视网膜病变、白内障、尿毒症等有着密切关系[3-5]。因此,AGEs在医学和生物学上引起了广泛的关注,但国内外对食品中AGEs的研究相对较少,相关检测标准与规范尚处于空白状态,不同食品中的安全限量也尚未明确。目前有20多种AGEs被鉴定[6],包括羧甲基赖氨酸(N-carboxymethyllysine,CML)、羧乙基赖氨酸(N-carboxyethyllysine,CEL)、戊糖苷素、吡咯素、丙酮醛-赖氨酸二聚体与乙二醛-赖氨酸二聚体等,其中,CML和CEL是最具代表性的AGEs,可以作为食品体系中美拉德反应程度的指标[7]。因此,食品领域相关研究主要围绕这2 种AGEs开展[8-9]。
三文鱼被誉为“鱼中至尊”,含有丰富的蛋白质、8 种人类必需氨基酸、ω-3高不饱和脂肪酸、矿物质及微量元素,具有极高的营养价值[10-11]。目前查到与三文鱼中AGEs有关的文献有4 篇,但这些研究都只集中在CML,并且得出的结果缺乏一致性。Charissou等[12]报道在三文鱼中未检出CML;Chao Peichun等[13]在鲜三文鱼中检出CML,含量为100 ng/g;Uribarri等[14]使用酶联免疫法检测到冷冻三文鱼中CML含量为517 kU/100 g,新鲜三文鱼中CML含量为527 kU/100 g,但是酶联免疫法得出的是样品中CML相对值,不是绝对值,与仪器法得出的绝对含量无法进行比较;Chen Gengjun等[15]检测鲜三文鱼中CML含量为1 920 ng/g样品,烤三文鱼中CML高达10 780 ng/g样品,与之前报道的含量有显著性差异,在其他食品中CML含量与变化规律方面与Chao Peichun等[13]研究也存在一定出入。
本实验以源自3 个国家的21 条三文鱼为实验样品,经过脱脂、还原、蛋白质水解、固相萃取净化等步骤后,采用同位素内标稀释超高效液相色谱-串联三重四极杆质谱(ultra-high performance liquid chromatographytandem mass spectrometry,UPLC-MS/MS)法测定其CML和CEL含量。对所获数据进行统计分析,以期更加全面地反映三文鱼中AGEs整体含量,为不同研究小组报道的三文鱼中CML含量存在显著性差异的原因提供可能的解释。本实验测定三文鱼中CEL含量,并提出CEL有望成为鉴别挪威三文鱼与智利、法罗群岛三文鱼的产地特征因子,研究成果为三文鱼的产地溯源及真伪鉴别提供新思路,为后续更深入的研究打下基础。
1 材料与方法
1.1 材料与试剂
21 份冰鲜三文鱼(品种均为大西洋鲑)样品分别来自3 个主要进口国挪威(n=7)、智利(n=7)和丹麦法罗群岛(n=7),均在广州白云机场口岸空运进境,由原出入境检验检疫局监管科抽样送入实验室检验,冰鲜三文鱼去皮后将鱼身肉(包含鱼头肉)取下混匀待测。
CML标准品、CEL标准品、D4-CML同位素内标、D4-CEL同位素内标(纯度均大于98%) 美国Santa Cruz Biotechnology公司;甲醇、乙腈和正己烷(均为色谱级) 美国Fisher Scientific公司;硼酸、硼氢化钠、浓盐酸、浓硫酸、氢氧化钠、正辛醇(均为分析纯)上海国药集团化学试剂有限公司。
1.2 仪器与设备
Oasis MCX固相萃取柱(60 mg,3 mL,60 μm)、ACQUITY UPLC TQD UPLC-MS/MS联用仪 美国Waters公司;AX205型十万分之一电子天平 瑞士梅特勒-托利多公司;QGC-12T型氮气吹干仪 上海泉岛科贸公司;Fotector-04HT型固相萃取仪 美国睿科公司。
1.3 方法
1.3.1 样品前处理
脱脂:称取约2 g三文鱼样品,加入3 mL正己烷,剧烈振荡混匀后10 000 r/min离心15 min,移去上清液,重复该步骤3 次以彻底脱脂。将脱脂后的样品放置于通风橱中自然挥干正己烷残留[16]。
样品还原:向挥干后的样品中加入0.2 mol/L硼酸盐缓冲液(pH 9.2)1.5 mL,硼氢化钠(1 mol/L,溶于0.01 mol/L氢氧化钠溶液)溶液[17]1 mL,加入3 滴左右的正辛醇消泡[18],于4 ℃过夜充分还原。
酸水解:向还原后的样品液加入浓盐酸2.5 mL,真空密封后置于烘箱中110 ℃水解24 h[19]。水解完过滤,并定容至10 mL。准确吸取水解液600 μL,于60 ℃氮气吹干,再加入150 μL内标溶液[20](1.0 μg/mL的D4-CML与D4-CEL混标)。
净化:将吹干后的样品用2 mL超纯水复溶后过固相萃取柱净化[21]。将该柱先使用3 mL甲醇、3 mL 0.1 mol/L的HCl溶液进行活化平衡,再将所有复溶后的样液上样,而后使用3 mL 0.1 mol/L的HCl溶液和3 mL甲醇依次进行淋洗,再用6 mL甲醇氨混合溶液(甲醇-氨水,95∶5,V/V)洗脱,活化和淋洗流速小于2 mL/min,上样和洗脱流速小于0.5 mL/min。最后洗脱液用氮气吹干,并使用200 μL水复溶、0.22 μm针式过滤器过滤后得到CML和CEL待测液,取5 μL进样分析。
1.3.2 仪器条件
UPLC条件:色谱柱为ACQUITY UPLC HSS T3柱(2.1 mm×150 mm,1.8 μm);柱温45 ℃;流动相A为100%乙腈,B为0.1%甲酸[22];梯度洗脱程序:0~0.1 min,1% A,99% B;0.1~5 min,1%~8% A,99%~92% B;5~5.5 min,8%~100% A,92%~0% B;5.5~6.5 min,100% A,0% B;6.5~7 min,100%~1% A,0%~99% B;流速0.2 mL/min。
MS条件:电喷雾离子源正离子采集方式;离子源温度110 ℃;脱溶剂气温度400 ℃,流速600 L/h,毛细管电压3.55 kV,氩气碰撞器流量0.15 mL/min,氦气锥孔气流量50 L/h,锥孔电压20 V。
目标物CML母离子m/z205,子离子m/z84和m/z130,锥孔电压20 V,碰撞能量14 eV,驻留时间20 ms。目标物CEL母离子m/z219,子离子m/z88和m/z130,锥孔电压20 V,碰撞能量16 eV,驻留时间20 ms;内标D4-CML母离子为m/z209,子离子为m/z88和m/z134,锥孔电压20 V,碰撞能量15 eV,驻留时间20 ms;内标D4-CEL母离子为m/z223,子离子为m/z88和m/z134,锥孔电压20 V,碰撞能量13 eV,驻留时间为20 ms。
1.4 数据处理
采用Microsoft Office Excel 2007软件进行样品中CML含量和CEL含量统计及差异比较分析,采用IBM SPSS Statistics 19.0分析软件对样品中CML含量和CEL含量进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 三文鱼样品中CML和CEL的UPLC-MS/MS分析
m/z205/84和m/z209/88离子对分别用于CML和D4-CML定量,m/z219/84和m/z223/84离子对分别用于CEL和D4-CEL的定性[23],标准品及同位素内标在多反应监测模式下都能得到良好的鉴定,见图1。
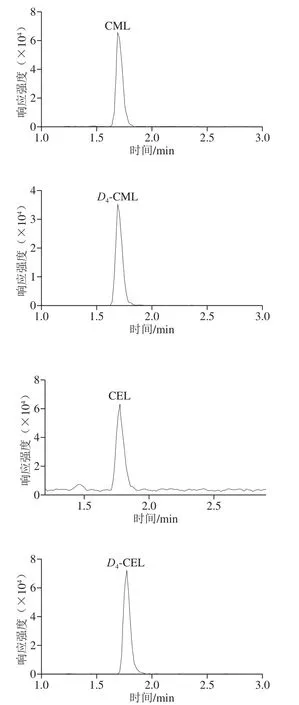
图1 CML、D4-CML、CEL和D4-CEL的多反应监测模式色谱图Fig. 1 Chromatograms of CML, D4-CML, CEL and D4-CEL in MRM mode
2.2 方法学考察结果
2.2.1 线性范围、检出限及定量限结果
将CML、D4-CML、CEL及D4-CEL分别配成20 mg/mL储备液,再稀释配制成标准工作液。以目标物的质量浓度为横坐标(x),以目标物峰面积与对应内标物的峰面积的比值为纵坐标(y),绘制标准曲线。不断稀释CML与CEL的质量浓度,当目标峰信噪比为3时得到目标物检出限,当目标峰信噪比为10时得到目标物定量限。如表1所示,该法完全能满足三文鱼中CML和CEL的定量分析需求。

表1 UPLC-MS/MS方法的标准曲线、线性范围、相关系数、检出限和定量限Table 1 Standard curves, linear ranges, correlation coefficients (r2),LOQs and LODs of the UPLC-MS/MS method
2.2.2 回收率及精密度结果
根据不加标三文鱼样品中CML和CEL含量分布,CML选取200、400、1 500 ng/g,CEL选取50、200、1 200 ng/g作为加标量进行加标回收实验,每个添加水平重复测定6 次,见表2。结果显示,3 个添加水平下的三文鱼中CML和CEL平均回收率在90%~95%之间,相对标准偏差小于5%,说明本法检测三文鱼中CML和CEL的准确度和精密度良好。
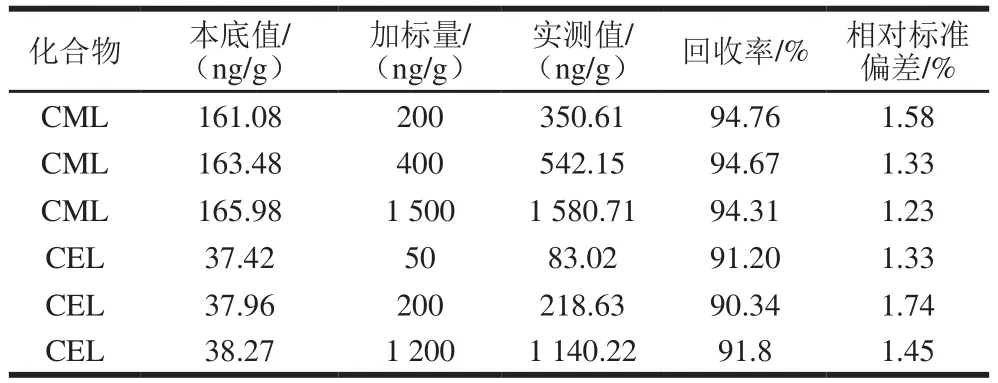
表2 三文鱼中回收率和相对标准偏差Table 2 Recoveries and RSDs of CML and CEL in spiked salmon
2.2.3 三文鱼样品含量测定结果
从表3得知,在产自3 个不同国家的21 份三文鱼样品中均检出CML和CEL,只是在含量上有所差异。这与Charissou等[12]在三文鱼中未检出CML的报道矛盾,这可能与其使用的衍生前处理步骤及气相色谱-质谱联用仪器有关。而与Chao Peichun等[13]检出CML含量为100 ng/g,Chen Gengjun等[15]检出CML含量为1 920 ng/g,在检出含量上有比较大的差异,这可能与研究重点、样本数量、三文鱼产地及品种等有关。本实验样品数量大,产地及品种明确,样品处理过程可控,可真实反映三文鱼中CML含量分布。同时,本实验测定三文鱼中CEL含量高达1 002.02 ng/g,低至37.92 ng/g,含量相差显著,这说明对CEL进行定量很有必要,一是可以更加全面了解AGEs整体在三文鱼中的含量,二是可以为后续更深入的研究提供理论依据。
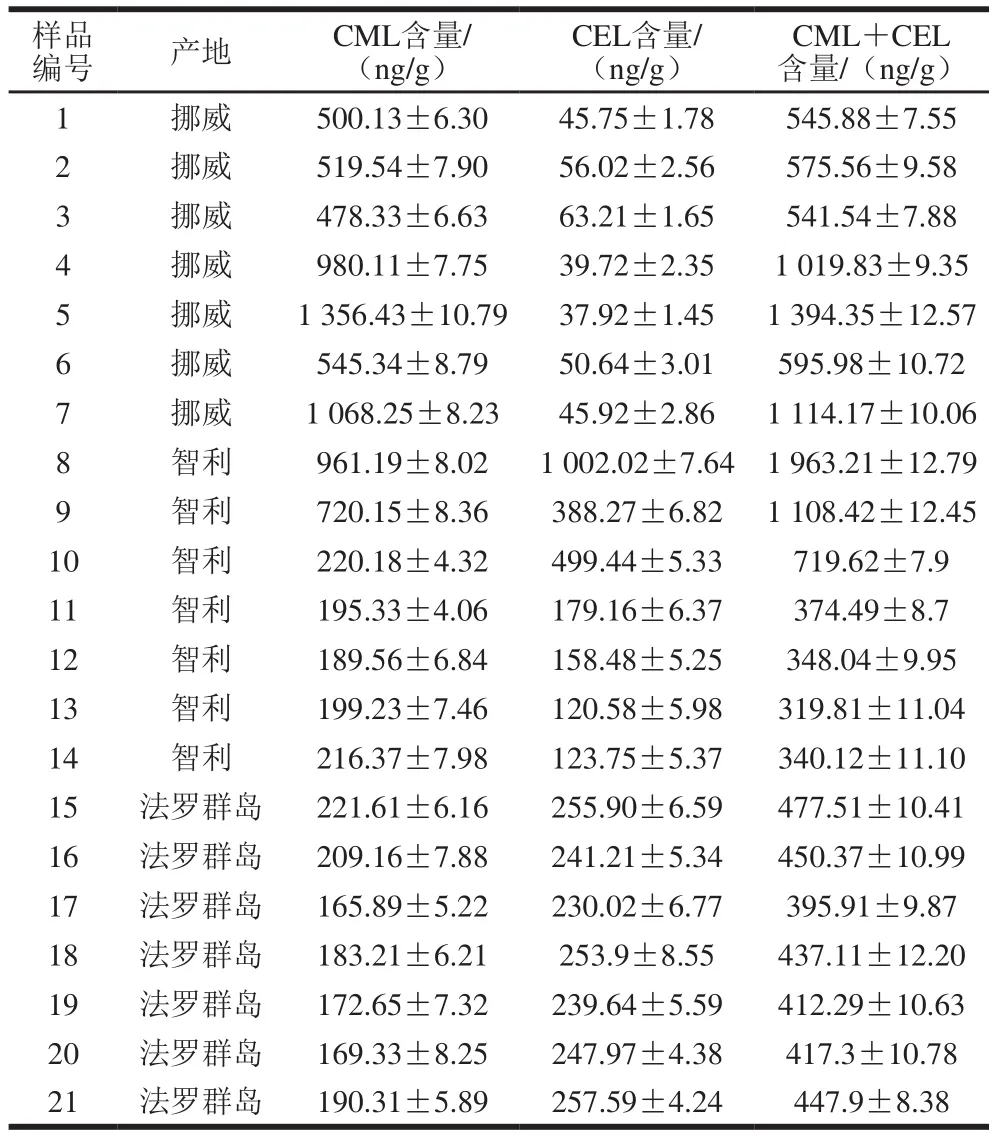
表3 不同产地三文鱼中CML和CEL含量(n=3)Table 3 Contents of CML and CEL in salmon samples from different geographical origin (n= 3)
2.2.4 数据分析
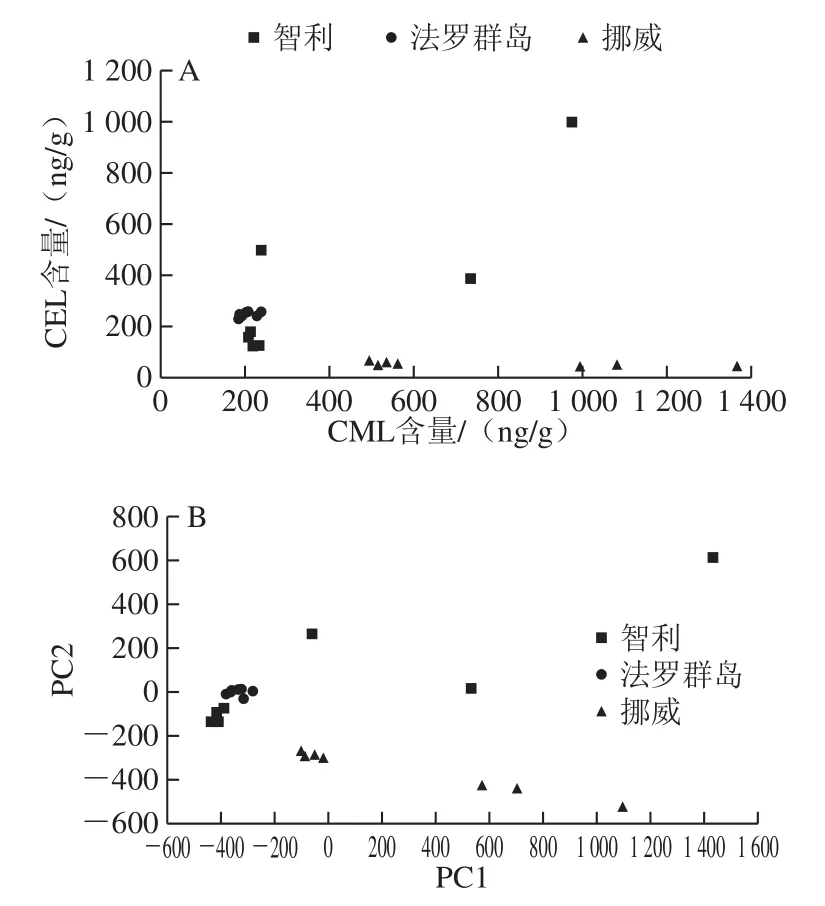
图2 21 份三文鱼样品CML与CEL含量分布(A)和PCA(B)图Fig. 2 Distribution of CML and CEL contents (A) and PCA (B) plot for 21 salmon samples
为更直观分析不同国家三文鱼中AGEs含量特点及规律,分别以CML含量和CEL含量为x轴和y轴绘制坐标图,同时利用SPSS软件对来自3 个国家的21 份样品进行PCA[24-25],如图2所示。以CML含量为PC1(66.6%),CEL含量为PC2(33.4%),无论是坐标图还是PCA法得分投影图,趋势大体一致。
全球三文鱼以挪威产量大,知名度高[26-27],因此国内市场上常出现以其他三文鱼冒充挪威三文鱼的现象[28-30]。本实验表明,挪威三文鱼CEL含量最低,且其在PC2(CEL)上能与其他2 个国家明显分开,这说明PC2(CEL)可以显示挪威三文鱼的区域特征,有望作为产地特征因子用于鉴别挪威三文鱼和智利、法罗群岛三文鱼。而智利和法罗群岛三文鱼样本在PC1和PC2上都有不同程度的重叠,分类效果不理想,但是法罗群岛的三文鱼在PC1和PC2的得分分布成簇聚集,表明该国三文鱼样品间存在较好的相似性,即稳定性较好。而智利三文鱼在PC1和PC2的得分分布较分散,表明智利三文鱼个体间存在较大的相异性,即差异显著。
3 结 论
本实验建立稳定可靠的UPLC-MS/MS同时检测三文鱼中CML和CEL方法,并利用该法对源自3 个不同国家的21 份三文鱼样品进行CML和CEL含量测定。通过对所获数据进行分析后,指出即使是相同品种的三文鱼在不同国家和不同个体之间CML和CEL含量存在很大的生物差异性,为不同研究小组对三文鱼中CML含量报道的结果不一致性提供了最大可能的解释。与大多数研究食源性AGEs的报道都集中于CML不同的是,本实验测定挪威、智利和法罗群岛3 个国家三文鱼(大西洋鲑)中CEL含量,并提出CEL有望作为产地特征因子用于挪威三文鱼区别其他2 个国家三文鱼的产地鉴别,肯定CEL的重要性,为后续研究提供理论依据。后期本研究团队也会考虑进一步丰富样品批次和产地数量加以确证和扩展该实验成果。

