基于牛乳非蛋白生物标志物定量检测山羊乳中掺加的牛乳
孙金芝,付路静,岳田利,李婧妍,郭春锋
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
乳是人类所需蛋白质和脂肪的重要来源之一,由于其营养特性,乳及乳制品在食品工业中扮演着重要角色[1]。由于山羊乳富含蛋白质、矿物质、维生素和小脂肪分子,与牛乳相比具有易消化性和低致敏性等优势,因此山羊乳可以作为牛乳蛋白质过敏者的更佳选择[2-5]。此外,山羊乳特有的上皮细胞生长因子和丰富的超氧化物歧化酶还可以提高人体免疫力,延缓机体衰老[6-7]。目前山羊乳的收购价格几乎是牛乳的2 倍,受经济利益驱使,山羊乳掺假制假现象较为严重[8],如为了提高山羊乳原乳中脂肪和蛋白质的含量向其中添加植脂末、铵盐、水解蛋白粉和尿素等。随着检测仪器的更新和检测技术的进步,这些掺假现象已能被有效识别,但最新的掺假手段是向山羊乳中掺加牛乳[9],由于牛乳在外观和化学组成上与山羊乳非常相似,这使鉴别该掺假现象具有一定难度[10]。
目前文献中已报道了多种技术手段用于鉴别山羊乳中掺加的牛乳。以蛋白质为靶标的鉴别手段有高效液相色谱法[11]、质谱法[12-13]、电泳法[14-15]和酶联免疫法[16-18]等,其中酶联免疫法应用最广泛,该方法的典型特征是特异性强、操作简单,德国拜发公司的试剂盒便是基于该技术开发,但该试剂盒仅能检测山羊乳中掺加的未经热处理过的牛乳,无法检测经过热处理的牛乳掺加物[19]。以脂肪酸为靶标的鉴别手段有气相色谱法[20-21]和质谱法[22-23]等。尽管山羊乳和牛乳在脂肪酸组成,特别是短链脂肪酸组成上存在一定差异,但山羊乳和牛乳的脂肪酸组成和含量会受季节和饲料等因素的影响,这限制了该方法的可推广性。另外,以牛体细胞为靶标的鉴别手段也有报道。该方法通常是利用聚合酶链式反应扩增牛线粒体DNA的保守序列以确定样品中是否含有牛乳成分[2,23-28],但牛乳中体细胞的数量并非恒定,它会随着奶牛的健康状况以及环境因素等发生较大变化,这使该方法只能进行定性检测,难以用于定量分析。
尽管上述方法在某些情况下是有效的,但都存在一定的局限性。本研究前期选择丹酰化衍生和糖腈乙酸酯化衍生结合色谱技术对牛乳和山羊乳的非蛋白成分进行分析,但均未发现牛乳中区别于山羊乳的标志物。随后选择了硅烷化衍生的方法,原因在于硅烷化试剂中的三甲基硅烷基会取代化合物中羟基、羧基、巯基、氨基及亚氨基的活泼氢,从而降低化合物极性,提高其挥发性,将不易挥发的物质转化为易挥发的衍生物,从而扩大了气相色谱与质谱联用的测定范围。通过硅烷化衍生结合气相色谱-质谱联用法成功挖掘到了牛乳区别于山羊乳的非蛋白生物标志物,然后以此为靶标采用高效液相色谱技术对山羊乳中掺加的牛乳进行定性和定量检测。本研究开发的方法可提升羊乳企业和质检机构检测和监测山羊乳原乳质量的能力,进而促进山羊乳产业健康、持续和快速发展。
1 材料与方法
1.1 材料与试剂
本研究所用的牛乳(荷斯坦奶牛)和山羊乳(萨能奶山羊)均采集自西北农林科技大学畜牧教学试验基地,采集后迅速贮存于-86 ℃冰箱,备用。
N-乙酰氨基葡萄糖、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-menthy-5-pyrazolone,PMP)、磷酸氢二钾(均为分析纯) 上海阿拉丁生化科技股份有限公司;磷酸、硅烷化衍生试剂Sylon HTP(均为色谱纯) 美国Sigma-Aldrich公司;氢氧化钠、盐酸(均为分析纯)国药集团化学试剂有限公司;丙酮、乙腈、吡啶、正己烷、三氯甲烷(均为色谱纯) 美国Tedia有限公司。
1.2 仪器与设备
Prominence-i LC-2030型高效液相色谱仪、GCMSQP2010 Ultra型气相色谱-质谱联用仪 日本岛津公司;64R型高速冷冻离心机 美国贝克曼库尔特公司;DK-98IIA型电热恒温水浴锅 上海沪粤明科学仪器有限公司;VORTEX-GENIE2型可调速旋涡混合器 美国Scientific Industries公司;MD200-1型氮吹仪 杭州奥盛仪器有限公司。
1.3 方法
1.3.1 牛乳非蛋白生物标志物挖掘
1.3.1.1 标准品及样品前处理
标准品:吸取1 mL质量浓度为250 mg/L的N-乙酰氨基葡萄糖标准溶液,与等体积的冷丙酮(置于-20 ℃冰箱过夜)混合,旋涡混匀,用于衍生。
样品:吸取1 mL牛乳或山羊乳,加入10 mL离心管中,再加入等体积冷丙酮,旋涡混匀,于4 ℃冰箱内静置10 min,然后于8 000×g离心10 min,以沉淀蛋白,吸取上清液,用0.22 μm尼龙滤膜过滤,用于衍生。
1.3.1.2 硅烷化衍生
参照Jordan等[29]方法进行硅烷化衍生。吸取50 μL上述标准品或样品溶液,加入玻璃具塞试管中,于室温下氮气吹干,加入100 μL衍生试剂Sylon HTP,旋涡混匀,密封后于70 ℃反应60 min,冷却至室温后,加入1 mL正己烷和1 mL吡啶,旋涡混匀,以溶解残渣,然后吸取1 mL溶液,进行气相色谱-质谱分析。
1.3.1.3 气相色谱-质谱测定
色谱条件:DB-1非极性毛细管柱(60 m×0.25 mm,0.25 μm);升温程序:初始温度100 ℃,维持1 min,以4 ℃/min上升至260 ℃,维持34 min,总运行时间75 min;载气为高纯氦气,流量1.8 mL/min;不分流进样,进样体积1.0 μL;进样口温度260 ℃。
质谱条件:电子电离源;离子源温度200 ℃;电离能量70 eV;溶剂延迟时间10 min;全扫描模式;质量扫描范围m/z50~800。
1.3.2 山羊乳中掺加牛乳的检测
1.3.2.1 目标物的衍生
采用PMP对目标物进行衍生[28-30]。按照1.3.1.1节方法对样品进行前处理后,吸取100 μL滤液,加入至具塞玻璃试管中,加入100 μL 0.6 mol/L氢氧化钠溶液,旋涡混匀,再加入200 μL 0.5 mol/L PMP-甲醇溶液,再次旋涡混匀,于70 ℃反应60 min,冷却至室温后,加入100 μL 0.6 mol/L盐酸,旋涡混匀,氮气吹干,加入2 mL水和2 mL三氯甲烷,旋涡混匀,静置5 min,移除氯仿层,再重复萃取2 次,以除去多余的衍生试剂,吸取1 mL上层水相,经0.45 μm滤膜过滤后,进行高效液相色谱分析。
1.3.2.2 高效液相色谱分析条件
TC-C18反相色谱柱(250 mm×4.6 mm,5 μm);柱温35 ℃;柱流速0.75 mL/min;紫外检测器,检测波长245 nm;进样体积20 μL;流动相A:0.05 mol/L磷酸钾缓冲液(pH 6.8);流动相B:含20%乙腈的0.05 mol/L磷酸钾缓冲液(pH 6.8);梯度洗脱条件:0~10 min,80%~60% A,20%~40% B;10~30 min,60% A,40% B;30.1 min,80% A,20% B,维持15 min。
1.3.2.3 衍生时间的确定
以N-乙酰氨基葡萄糖标准溶液(100 mg/L)为研究对象,衍生温度70 ℃,衍生时间分别设定为15、30、45、60、75 min和90 min,然后进行高效液相色谱分析,记录N-乙酰氨基葡萄糖衍生物的峰面积。
1.3.2.4 衍生物稳定性分析
采用1.3.2.1节方法分别对N-乙酰氨基葡萄糖标准溶液(100 mg/L)和牛乳样品进行衍生,衍生后将样品于室温下分别静置0、3、6、9、12 h和24 h,然后采用1.3.2.2节方法对其中的N-乙酰氨基葡萄糖衍生物进行分析。
1.3.2.5 牛乳中N-乙酰氨基葡萄糖含量测定
取8 份牛乳样品,按照确定的衍生条件和色谱程序对其中的N-乙酰氨基葡萄糖含量进行分析。
1.3.2.6 热处理对牛乳中N-乙酰氨基葡萄糖含量的影响
将牛乳样品于沸水浴中分别加热0、20、40 min和60 min,然后按照上述衍生条件和色谱程序对其N-乙酰氨基葡萄糖含量进行分析。
1.3.3 方法学评价
1.3.3.1 检出限、定量限和线性范围
向山羊乳中添加2%的牛乳,利用已经建立的衍生条件和色谱程序进行分析,重复测定10 次,计算标准差S0,检出限和定量限分别用进行计算[31-32]。另外,向山羊乳中分别添加1%、5%、10%、20%、40%、60%、80%和100%的牛乳,按照上述衍生条件和色谱程序进行分析,每个样品重复测定3 次,通过线性回归分析,计算回归方程和相关系数。本实验选择荷斯坦奶牛所产牛乳进行研究的原因在于该品种奶牛在我国养殖量最大,占总饲养量的95%以上[33],因此该研究对象更具代表性。
1.3.3.2 准确度和精密度
基于回收率评估方法的准确度,向山羊乳样品中分别掺加10、50 mg/L和100 mg/L的N-乙酰氨基葡萄糖,用已建立的方法进行分析,每个添加质量浓度重复测定3 次,计算回收率。根据加标样品的相对标准偏差(relative standard deviation,RSD)评估方法的精密度,包括日内精密度和日间精密度。前者在同一天内不同时间分别对加标样品测定3 次,然后计算RSD,后者是在3 d内同一时间分别对加标样品进行测定,然后计算RSD[34]。
1.4 数据处理
2 结果与分析
2.1 牛乳关键非蛋白生物标志物检测

图1 山羊乳和牛乳硅烷化衍生产物的气相色谱-质谱全扫描色谱图Fig. 1 Full-scan chromatograms of silylated derivatives of goat and cow milks

图2 N-乙酰氨基葡萄糖和N-乙酰氨基半乳糖质谱图Fig. 2 Mass spectra of cow milk, N-acetylglucosamine and N-acetylglactosamine
对山羊乳和牛乳的三甲基硅烷化衍生物进行质谱分析,结果如图1所示。牛乳(图1b)中36.99 min的峰1和37.08 min峰2未在山羊乳(图1a)中出现,通过在NIST谱库进行检索,发现这2 个峰与N-乙酰氨基葡萄糖和N-乙酰氨基半乳糖的相似度最高,均为91%。通过与上述两种化合物的标准物质的质谱图进行比对,峰1和峰2均被鉴定为N-乙酰氨基葡萄糖(图1c),牛乳样品色谱图峰1和峰2中N-乙酰氨基葡萄糖标准品和N-乙酰氨基半乳糖标准品的质谱图分别显示在图2A、B、C中。因此,牛乳区别于山羊乳的关键非蛋白生物标志物可准确判定为N-乙酰氨基葡萄糖。由于糖的硅烷化衍生物稳定性差,且存在双峰,因此导致难以准确定量。有文献报道N-乙酰氨基葡萄糖PMP柱前衍生结合高效液相色谱进行定量分析,衍生物稳定,且呈现单峰[35-38]。
2.2 山羊乳中掺加的牛乳测定
2.2.1 衍生物的色谱分离
如图3所示,在所建立的色谱条件下,目标物实现了基线分离,峰形尖锐对称,无明显前沿和拖尾现象。将山羊乳和牛乳PMP衍生物色谱图与N-乙酰氨基葡萄糖标准品PMP衍生物色谱图(图3c)进行对比,发现N-乙酰氨基葡萄糖仅存在于牛乳(图3b)中,保留时间为23.90 min,而在山羊乳(图3a)中未发现该色谱峰,因此再次证实N-乙酰氨基葡萄糖为牛乳区别于山羊乳的关键非蛋白生物标志物。据此,按照建立的色谱条件进行后续分析。

图3 不同样品PMP衍生产物的高效液相色谱图Fig. 3 High performance liquid chromatograms of PMP derivatives of goat milk, cow milk and N-acetylglucosamine
2.2.2 衍生时间的确定

图4 最佳衍生时间的确定Fig. 4 Determination of optimal derivatization duration
如图4所示,当衍生时间达到60 min后,N-乙酰氨基葡萄糖衍生物的响应值达到最高水平,进一步延长衍生时间未发现响应值有显著提高(P<0.05),表明衍生反应在60 min内已经进行得很充分,因此60 min应为最佳衍生时间。
2.2.3 衍生物的稳定性
与初始浓度相比,N-乙酰氨基葡萄糖标准品的PMP衍生物在24 h内一直稳定(图5A),在不同时间点检测到的浓度无显著差异(P>0.05)。与此不同,在牛乳基质中,N-乙酰氨基葡萄糖衍生物在衍生后的12 h内稳定,响应值无显著衰减(P>0.05)(图5B),但在24 h后其相对浓度显著降低(P<0.05),为初始浓度的94%。这是由于牛乳基质成分复杂,所含其他成分可能影响了目标物的稳定性。

图5 标准溶液和牛乳样品中N-乙酰氨基葡萄糖的PMP衍生物在室温下的稳定性Fig. 5 Stability of PMP derivatives of N-acetylglucosamine in standard solution and in cow milk at room temperature
2.2.4 牛乳中N-乙酰氨基葡萄糖含量测定
使用确定的PMP衍生条件和高效液相色谱程序对牛乳样品中N-乙酰氨基葡萄糖含量进行分析,结果显示其质量浓度为(148.2±4.8)mg/L。
2.2.5 热处理对牛乳中N-乙酰氨基葡萄糖含量的影响

图6 加热时间对牛乳中N-乙酰氨基葡萄糖含量的影响Fig. 6 Effect of heating time on the content of N-acetylglucosamine in cow milk
如图6所示,经沸水浴加热60 min后,牛乳中N-乙酰氨基葡萄糖含量与加热前相比无统计学显著差异(P>0.05),说明热处理对牛乳中N-乙酰氨基葡萄糖含量无显著影响。
2.2.6 方法学评价结果
2.2.6.1 检出限、定量限和线性范围结果
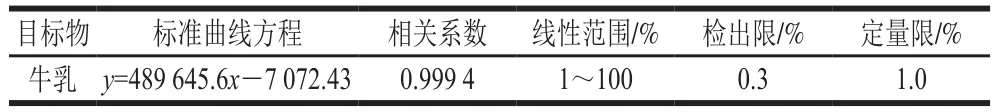
表1 方法的标准曲线方程、相关系数、检出限和定量限Table 1 Calibration equation, correlation coefficient, limit of detection and limit of quantification for the method
如表1所示,该方法检出限和定量限分别为0.3%和1.0%的牛乳添加量。以N-乙酰氨基葡萄糖的色谱峰面积为纵坐标,牛乳添加量为横坐标绘制标准曲线,相关系数高于0.999 0。山羊乳中掺加的牛乳在定量限至100%的范围内显示了良好的线性关系,方法最低可准确检测羊乳中掺加的1%牛乳。Iverson等[22]开发了以牛DNA为目标物的检测羊乳中掺加的牛乳的方法,其可以检测到山羊乳中掺加的0.01%的牛乳;Ma Yongjie等[14]报道一种基于毛细管电泳法识别羊乳中掺加的牛乳的技术,最低可检测5%的牛乳掺加量;Ke Xing等[11]基于牛乳和羊乳在β-乳球蛋白结构上的差异使用高效液相色谱-电喷雾串联质谱法对羊乳掺假进行了检测,检出限为5%的牛乳添加量。在文献报道的检测方法中,牛乳添加量的最低检出水平在0.01%~5%之间,但由于过低的牛乳掺加量并不会带来实际经济利益,因此能够检测到1%的掺加水平已经能够满足实际应用。
2.2.6.2 准确度和精密度结果

表2 方法的准确度和精密度Table 2 Accuracy and precision for the method
向山羊乳中分别加入3 种不同质量浓度的N-乙酰氨基葡萄糖,按照所建立的衍生方法和色谱程序对目标物进行检测。如表2所示,N-乙酰氨基葡萄糖的加标回收率在100.4%~105.1%之间,日内精密度介于1.7%~2.6%之间,日间精密度在2.0%~3.7%范围内,表明本方法的准确度和精密度均较高。
3 结 论
本研究成功挖掘到牛乳区别于山羊乳的关键非蛋白生物标志物——N-乙酰氨基葡萄糖,并建立了一种以该标志物为靶标的基于高效液相色谱手段定量检测山羊乳中掺加的牛乳的方法。该方法具有较高的灵敏度、准确度和精密度,为山羊乳中掺加牛乳的定性识别及定量检测提供了有效技术手段,将为我国山羊乳产业的健康发展提供技术支撑。

