适配体结合量子点技术同时检测金黄色葡萄球菌和大肠埃希氏菌O157:H7方法
王 玥,邵 琳,李乾学,易 乐,曲 晗,王洪利,沈明浩,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.军事科学院军事医学研究院军事兽医研究所,吉林 长春 130122;3.长春理工大学,吉林 长春 130022)
大肠埃希氏菌O157:H7是肠出血性大肠埃希氏菌的主要血清型,其致病力强,能引起人类出血性腹泻和溶血性尿毒综合症以及血栓性血小板减少性紫癜等[1-2]。该病已被世界卫生组织列为新的食源性疾病,是导致食源性疾病的主要致病菌之一[3]。此外,据美国疾病控制中心报告,在美国由金黄色葡萄球菌引起的食物中毒数量仅次于大肠埃希氏菌,居第2位,占细菌性食物中毒的33%[4-5],在我国的细菌性食物中毒事件中,由金黄色葡萄球菌引起的食物中毒占1/4[6]。近年来,由以上2 种菌引起的食物中毒有明显上升趋势,建立一种快速、特异性强、简便的检测大肠埃希氏菌O157:H7和金黄色葡萄球菌的方法是当务之急。
近年来,由于适配体和抗体相比在亲和力和特异性方面都有更显著优势。应用体外筛选适配体技术[7]结合表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)技术[8-9]进行食源性致病菌的检测方法具有筛选周期短、特异性及稳定性高、方便快捷等优点,已成为近年来细菌检测领域的研究热门[10-11]。该方法应用广泛,如在生物医药领域已检测DNA[12]、细胞[13-14]、葡萄糖[15]等,尤其是Smolsky[16]、Roy[17]等在生物传感器、新药研发、临床诊治等领域的研究尤为突出。在食品领域主要是针对食品添加剂、抗生素残留[18]以及病原微生物[19]等食物中存在的污染物进行检测。而随着新型纳米材料的不断兴起,量子点技术在快速检测方面的应用逐渐突显出来,这主要是由于量子点具有光学信号强、荧光量子产率高[20-21]、尺寸可调、光学性质稳定等特点,可与生物材料附加进而实现样本的快速定量检测[22]。
本研究利用2 种致病菌的适配体与纳米磁珠共价结合的技术,形成能够特异性吸附目标病原菌的免疫磁性颗粒[23]。同时将链霉亲和素量子点标记到特异性适配体上;在富集过程中,免疫磁球、目标致病菌和免疫量子点形成一个“三明治结构”复合物(适配体功能化磁球-细菌-适配体功能化量子点);利用荧光光谱法和荧光显微技术考察量子点荧光强度中致病菌的生长情况,最后应用到市售无菌牛乳实际样品中进行加标回收率实验。该技术高效、灵敏,有望在食品相关领域得到广泛应用。
1 材料与方法
1.1 材料与试剂
袋装全脂灭菌纯牛乳(240 mL/袋) 市购。
金黄色葡萄球菌(Staphylococcus aureusCICC:21600)、大肠埃希氏菌O157:H7(Escherichia coliCICC:21530) 中国工业微生物菌种保藏中心(China Center of Industrial Culture Collertion,CICC);生物素化金黄色葡萄球菌适配体[24](序列:5′-TCCCT ACGGC GCTAA CCTCC CAACC GCTCC ACCCT GCCTC CGCCT CGCCA CCGTG CTACA AC-3′)、生物素化大肠埃希氏菌O157:H7适配体[25](序列:5′-AAAAC CGCAT TTATG CTCAG CGATA CTACG CGCGC GTCC TCGAG CGACG CGGAT-3′)合成于吉林省库美生物科技有限公司(100 μmol/L),记为aptS和aptE;链霉亲和素的量子点(quantum dots,QDs;发射波长525 nm-QDs525,发射波长605 nm-QDs605)(1.01 μmol/L,100 μL)(本实验记为QDs605和QDs525) 武汉珈源量子点技术开发有限责任公司;链霉亲和素纳米磁珠BeaverBeadsTMStreptavidin(IMB)(25 μm,50 mg/mL) 苏州Beaver公司;磷酸盐缓冲液(phosphate buffered solution,PBS) 美国Hyclone公司;肉汤液体培养基(胰蛋白胨10 g/L、酵母提取物5 g/L、氯化钠10 g/mL,pH 7.4,LB液体培养基);琼脂糖 鼎国生物工程公司;1×缓冲溶液(Binding Buffer,1×BB;50 mmol/L,Tris-HCl,5 mmol/L KCl,100 mmol/L NaCl,1 mmol/L MgCl2,pH 8.2);牛血清白蛋白、99.999% AgNO3德国Sigma Aldrich Taufkirchen公司。
1.2 仪器与设备
DynaMagTM-2 Magent磁力架 赛默飞世尔科技(中国)有限公司;AB204-S电子天平 梅特勒-托利多仪器(上海)有限公司;LDZ5-2水平离心机 北京雷勃尔离心机有限公司;BSC-1300 II A2生物安全柜 苏州净化公司;LabRAM HR Evolution拉曼光谱仪 法国Horiba Scientific公司;ZWYR-204恒温水平摇床、LS-55 Perkin Elmer荧光分光光度计 上海智成分析仪器制造有限公司;IX73倒置荧光显微镜 北京奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 菌悬液的制备及保存
取冷冻保存的金黄色葡萄球菌、大肠埃希氏菌各20 μL,分别加入5 mL肉汤液体培养基中,摇床过夜(37 ℃、200 r/min、离心半径10 cm)。所得细菌置于平板上进行接种后,倒转平板,37 ℃恒温箱内培养24 h并计数,得到108CFU/mL菌液浓度。5 000 r/min离心2 min收集菌液,弃上清液,用1×BB清洗2 次,去除多余的培养基成分。新鲜LB液体培养基重悬至浓度为107CFU/mL,4 ℃保存备用。
1.3.2 适配体与目标菌结合特异性分析
1.3.2.1 金黄色葡萄球菌适配体特异性测定
将aptS稀释至500 nmol/L,利用聚合酶链式反应仪进行折叠:95 ℃变性2 min,然后以2 ℃/40 s的速率冷却至37 ℃,4 ℃保存备用。取稀释为107CFU/mL浓度2 种菌液(S. aureus、E. coli)各1 000 μL,分别置于1.5 mL离心管中,顺次加入折叠后aptS,混合均匀后向离心管内加入100 μL AgNO3溶液(0.1 mmol/L),充分混匀,避光孵育5 min,顺次加入100 μL NaBH4溶液(0.1 mmol/L),混匀,离心处理(3 000 r/min,瞬离5 s),弃上清液,留沉淀加入200 μL去离子水复溶,即得金黄色葡萄球菌适配体特异性待测样品,记为S. aureus-aptS@AgNP和E. coliaptS@AgNP。4 ℃保存备用。
1.3.2.2 大肠埃希氏菌适配体特异性测定
大肠埃希氏菌适配体特异性检测样品制备步骤同上。取aptE,所得样品记为E. coli-aptE@AgNP、S. aureus-aptE@AgNP。4 ℃保存备用。进行表面增强拉曼光谱检测,首先使用硅片在基准峰(520.7 cm-1)处对仪器进行校准。随后取待测样品4 μL,滴至石英载玻片正中心凹槽内,对样品峰值采集时使用632.8 nm氦氖激光,在激光强度14 mW,物镜50 倍条件下,设置积分时间2 s,积分次数5 次,分辨率1 cm-1,狭缝宽度100 μm,扫描范围500~2 000 cm-1,利用Origin 9.1进行终数据处理。
1.3.3 适配体功能化的磁珠制备及结构表征
取链霉亲和素磁珠100 μL于1.5 mL离心管中,磁性分离,PBS清洗2 次,吸弃上清液,用PBS复溶至1 000 μL体系,平均加到2 个离心管内。分别选取2 种已折叠适配体500 μL加入到500 μL的磁珠(10 mg/mL)中,轻微振荡反应30 min,通过外加磁场,磁性分离去除游离的适配体,加入1%牛血清白蛋白封闭磁珠表面未结合的位点,振荡孵育1 h,最后PBS清洗2 次,去离子水复溶至200 μL。将所得适配体功能化的纳米磁珠记为IMB-aptS、IMB-aptE。取2 种备用目标菌液各800 μL,分别与功能化磁珠混合,室温孵育45 min,磁性分离清洗,得到样品S. aureus-IMB-aptS、E. coli-IMB-aptE。通过扫描电镜观察其结合状态。
1.3.4 量子点显微成像及其功能化
分别取2 种量子点原液各5 μL滴在载玻片正中心,静置待干后通过倒置荧光显微镜观察其激发后的颜色、形态以及发射波长。取QDs605、QDs525各10 μL于离心管中,分别加入90 μL纯水制得10 倍稀释的量子点溶液。向量子点QDs605中加入500 μL折叠后aptS,向量子点QDs525中加入500 μL折叠后aptE,混合均匀后在室温条件下以15 r/min振荡孵育45 min,得到2 种功能化量子点记为QDs605-aptS、QDs525-aptE,4 ℃备用。
1.3.5 “三明治结构”表征
将样品IMB-aptS-S. aureus与QDs605-aptS混匀孵育2 h,清洗得到金黄色葡萄球菌“三明治结构”复合物样品记为IMB-S. aureus-QDs605,大肠埃希氏菌样品记为IMB-E. coli-QDs525,步骤同上。将上述样品置于倒置荧光显微镜下,通过观察细菌在明暗场条件下的不同状态,确定荧光标记是否成功。取2 种目标菌液各1 000 μL(共2 000 μL)混匀,3 000 r/min离心5 min清洗得到混合菌液沉淀,分别与2 种功能化量子点和磁珠混匀孵育得到混合菌液的“三明治结构”复合物,通过流式细胞仪FL1通道与FL2通道能够吸收不同荧光物质的原理,达到单独和同步检测2 种目标菌的结果。
1.3.6 对“三明治结构”捕获条件优化
1.3.6.1 适配体浓度优化
取适配体(100 μmol/L)分别稀释为100、200、300、400、500、600 nmol/L 6 个浓度,取稀释后浓度适配体各200 μL分别置于6 支离心管内,进行折叠处理。取60 μL磁珠原液,磁性吸附,PBS清洗3 次,沉淀用600 μL PBS定容后,分别取100 μL体积加到折叠后6 个浓度的适配体中,室温振荡孵育30 min,随后步骤同1.3.3节,得到6 份样品IMB-apt100~IMB-apt600。取备用菌液于6 支离心管内各800 μL,离心2 次(3 000 r/min、5 min),弃去上清液。对应加入6 份不同浓度IMB-apt样品,充分混匀后,振荡孵育1 h,随即取出进行磁性分离,PBS清洗2 次,去离子水清洗1 次,得到6 份样品IMB-apt100-目标菌(OTA)~IMB-apt600-OTA,备用。同步进行6 份功能化量子点制备(方法步骤同1.3.4节),将制得的功能化量子点与不同适配体浓度的6 份样品IMB-apt100-OTA~IMB-apt600-OTA充分混匀,室温孵育2 h,期间保持振荡。随后取6 份样品5 000 r/min离心2 min,PBS清洗2 次,去离子水清洗1 次,沉淀用600 μL去离子水定容、待检。
1.3.6.2 捕获时间优化
取优化后适配体最适浓度,按1.3.6.1节步骤制备2 种IMB-apt-OTA样品,室温孵育条件下的振荡时间分别选取30、45、60、75 min,同时加入阳性对照菌液,将所得样品与阳性对照重悬后分别取100 μL进行平板计数,计算捕获效率:
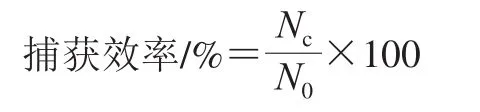
式中:Nc为捕获得到的细菌数/(CFU/mL);N0为原始的细菌数/(CFU/mL)。
1.3.6.3 磁性分离时间优化
按1.3.6.2节步骤制备2 种IMB-apt-OTA样品,选取最适捕获时间,磁性分离时间分别选取1、2、3、4、5、6 min后对所得样品及其阳性对照进行平板菌落计数,计算捕获效率。
1.3.7 同步检测2 种目标菌并确定其检出限
对混合菌进行10 倍浓度梯度稀释(106、105、104、103、102、101)得到6 份不同浓度的混合菌液,离心清洗,沉淀待用。结合以上优化条件,按1.3.3节步骤制备IMB-aptS、IMB-aptE样品各6 份,每份200 μL,分别与6 份菌沉淀混匀,振荡孵育1 h,5 000 r/min离心2 min,PBS清洗后留混合样品沉淀。按1.3.4节制备QDs605-aptS、QDs525-aptE样品各6 份,每份500 μL,与所得6 份混合样品沉淀混匀,室温孵育2 h,5 000 r/min离心2 min,清洗,得到6 份不同浓度混合菌液的“三明治结构”复合物样品,600 μL体系定容。将上述样品通过荧光分光光度计检测,并提取不同浓度目标菌的荧光强度曲线,确定检出限,拟合线性关系并建立标准曲线。
1.3.8 牛乳样品中金黄色葡萄球菌及大肠埃希氏菌O157:H7加标回收实验
取新鲜LB液体培养加入琼脂粉15 g,加入1 L去离子水同时搅拌混匀,调节pH值至7.2±0.2,高压灭菌,倒入平板培养皿内冷却,4 ℃保存备用。取购买的市售无菌牛乳添加混合菌配制成不同浓度的菌液样品,随后10 000 r/min离心8 min,去除上层乳脂,沉淀用去离子水稀释20 倍,静置30 min后滤出上层清液分装在离心管内,利用本实验建立的方法进行检测,得到结果与传统平板计数法相比较,并计算其回收率。
2 结果与分析
2.1 适配体特异性分析
如图1A所示,S. aureus-aptS@AgNP光谱的信号强度明显,随后在15 min内针对S. aureus-aptS@AgNP进行10 次随机检测,结果如图1B所示,该谱图吻合度极高,重复性良好。图1C为大肠埃希氏菌O157:H7适配体特异性结果,E. coli-aptE@AgNP光谱的峰值信号强度比S. aureus-aptE@AgNP明显,图1D为样品重复性检测,表明结果稳定可靠。

图1 适配体与目标菌特异性分析Fig. 1 Specificity analysis of aptamers for the target bacteria
2.2 适配体功能化磁珠制备及结构表征

图2 适配体功能化磁珠制备及结构表征Fig. 2 Preparation and structural characterization of aptamer functionalized magnetic beads
图2 A为链霉亲和素纳米磁珠的扫描电镜照片,可以看出该磁珠形态清晰,大小一致。图2B为样品S. aureus-IMB-aptS,图2C为样品E. coli-IMB-aptE的扫描电镜照片。其中明显看出磁珠周围富集了大量目标菌,且分散均匀,结合紧密。
2.3 量子点显微成像及其功能化表征
图3A为2 种量子点QDs605和QDs525在荧光分光光度计激发光源下所呈现的荧光光谱图;图3B与图3C为QDs605和QDs525原液在倒置荧光显微镜下成像图。该结果表明被激发光激发后的QDs605呈现绿色荧光,QDs525呈现橙色荧光。
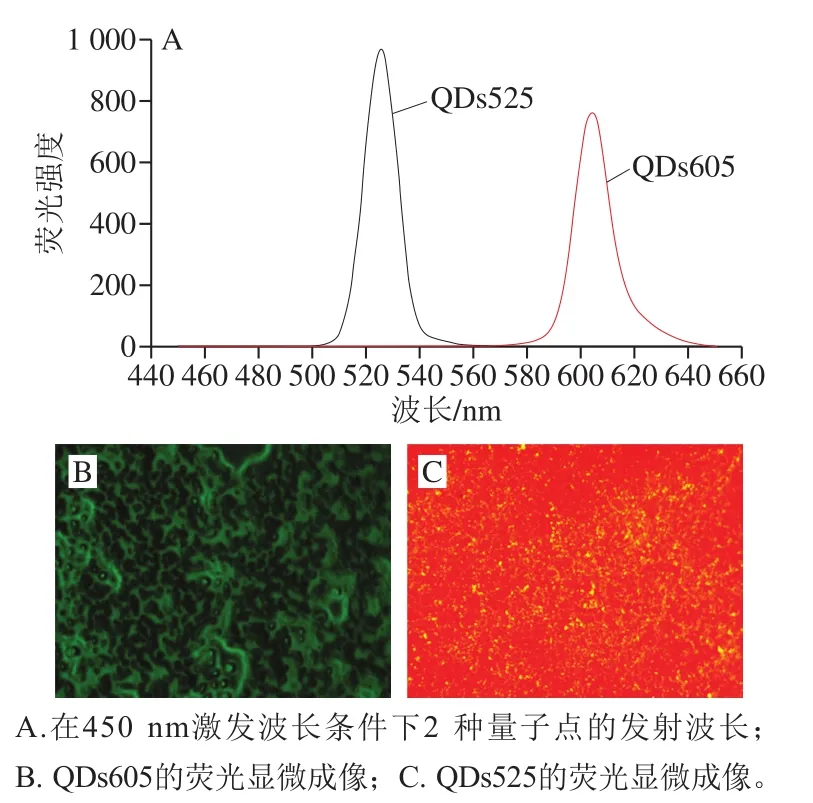
图3 量子点显微成像及其功能化表征Fig. 3 Microscopic imaging of quantum dot and its functional characterization
2.4 “三明治结构”表征

图4 三明治结构的荧光显微成像Fig. 4 Fluorescence microscopy images of the sandwich structure
图4 A、B为标记有QDs605的金黄色葡萄球菌“三明治结构”在倒置荧光显微镜下的图像。可以清晰地观察到金黄色葡萄球菌在明、暗场条件下的形态大小都保持一致,并且在暗场条件下通过荧光标记的金黄色葡萄球菌被激发出绿色荧光;图4C、D为标记有QDs525的大肠埃希氏菌“三明治结构”,可以看到在明暗场之中都保持一致的细菌形态,在暗场下通过荧光标记的大肠埃希氏菌呈现橙红色荧光。
结合流式细胞术对单独识别目标菌和同步检测2 种目标菌的“三明治结构”的验证,如图5所示,其中图5A为对照组的混合菌液未标记荧光信号出现在阴性区。图5B是标记有QDs605的金黄色葡萄球菌“三明治结构”在绿色荧光FL2-H通道的阳性区域内出现。图5C是标记有QDs525的大肠埃希氏菌“三明治结构”在橙红色荧光FL1-H通道的阳性区域内出现。图5D是分别标记QDs605和QDs525混合菌液的“三明治结构”,分别在FL1-H,FL2-H通道内的阳性区域出现,证明同步检测2 种目标菌的方法验证成功。

图5 流式细胞分析图Fig. 5 Flow cytometric analysis
2.5 对“三明治结构”捕获条件优化
2.5.1 适配体浓度优化

图6 “三明治结构”捕获条件优化Fig. 6 Optimization of sandwich structure capture conditions
分别选取100、200、300、400、500、600 nmol/L 6 个适配体浓度,通过荧光分光光度计在不同适配体浓度下所激发出不同的荧光强度进行谱图绘制。图6A、B分别为金黄色葡萄球菌与大肠埃希氏菌适配体浓度优化结果。结果表明适配体浓度为400 nmol/L时混合样品荧光强度均达到最高。最终选取400 nmol/L为2 种适配体在“三明治结构”中的最适浓度。
2.5.2 捕获时间优化
如图6C所示,捕获时间30~45 min内,2 种细菌的捕获效率随时间延长逐渐增大。当捕获时间为45~50 min时,磁珠的捕获效率相对较高。随后50~75 min内捕获效率缓慢下降。综上,最佳捕获时间为45 min。
2.5.3 磁性分离时间优化
从图6D可以看出,磁分离时间在1~2 min以内,捕获效率随时间而提高。当磁性分离时间为2 min,磁珠捕获目标细菌相对最有效,随后捕获效率在磁性分离时间2~6 min内持续下降。因此,最佳磁分离时间选择2 min。
2.6 同步检测2 种目标菌并确定其检出限
在450 nm激发波长条件下对混合菌液的“三明治结构”进行荧光强度的测定,此时混合菌液浓度梯度为106、105、104、103、102、101CFU/mL。由图7A可知,金黄色葡萄球菌混合菌液中检出限为101CFU/mL,由图7B可知,大肠埃希氏菌在混合菌液中的检出限为102CFU/mL。

图7 同步检测2 种目标菌检出限Fig. 7 Detection limits for simultaneous detection of two target bacteria
如图8所示,以其细菌菌落数的对数值为横坐标,荧光强度值为纵坐标,得到线性关系。其中,金黄色葡萄球菌线性方程为Y=28.51X+126.67,R2=0.973;大肠埃希氏菌线性方程为Y=92.86X-64.67,R2=0.987。结果表明针对2 种菌的目标检测均呈现良好递增趋势。

图8 细菌菌落数的对数值与荧光强度的线性关系Fig. 8 Linear relationship between logarithmic bacterial colony number and fluorescence intensity
2.7 牛乳样品中金黄色葡萄球菌及大肠埃希氏菌O157:H7加标回收实验

表1 牛乳样品中金黄色葡萄球菌及大肠埃希氏菌O157:H7的检测回收率Table 1 Recoveries of S. aureus and E. coli spiked in milk samples
如表1所示,金黄色葡萄球菌的检测回收率在94.6%~102.8%之间,大肠埃希氏菌O157:H7回收率在93.4%~100.4%之间,所得回收率良好。由此证明与传统平板计数法相比,本实验所建立的检测方法的一致性良好,可以应用于实际样品中致病菌的检测。
3 讨 论
近年来基于适配体的快检技术在生物和食品领域得到了急速的发展,这主要是基于适配体对pH值、温度等环境因素较不敏感,生产成本低[26],且与抗体比较具有对目标细菌更佳的特异性,因此有潜力成为抗体的替代品[27-28]。在食源性致病菌的检测中同时实现对多种目标菌的快速检测具有积极的现实意义,对食品安全领域具有很大的需求和发展潜力。但目前基于适配体技术对目标菌的快检应用还存在很多问题,其根本原因是适配体的亲和力和特异性问题,以及检测灵敏度问题而无法实现对生产现场的实际应用[29]。
本研究所建立方法的取决于金黄色葡萄球菌的适配体与其特异性结合能力以及大肠埃希氏菌O157:H7的适配体与其特异性结合能力。基于本研究所建立的金黄色葡萄球菌和大肠埃希氏菌O157:H7的“三明治结构”的模式分别为IMB-S. aureus-QDs605和IMB-E. coli-QDs525,观察荧光信号的变化结果显示由目标菌种引起的荧光信号的改变非常显著,该结果证明了基于适配体结合量子点的荧光标记技术分析检测金黄色葡萄球菌和大肠埃希氏菌O157:H7的方法具有高度特异性。本研究不仅对“三明治结构”中的适配体浓度进行优化,还对2 种目标菌的捕获时间和磁性分离时间进行优化,使金黄色葡萄球菌和大肠埃希氏菌O157:H7的捕获效率达到90%左右。实现对“三明治结构”完整的评价和改良,大大提高了本方法的检测效率。同时检测2 种目标细菌的结果表明,金黄色葡萄球菌与荧光强度在101~106CFU/mL的范围内线性相关:R2=0.973,检出限为101CFU/mL。大肠埃希氏菌O157:H7与荧光强度在101~106CFU/mL范围内线性相关:R2=0.987,检出限为102CFU/mL。此研究可证明,在短时间内建立适配体结合量子点技术的“三明治结构”可以对2 种食源性致病菌在101~106CFU/mL浓度范围内进行同时分离富集和定量检测,向市售无菌的牛乳样品中加入金黄色葡萄球菌和大肠埃希氏菌O157:H7,利用本研究的新方法与传统平板法进行回收率实验比较结果表明所建立方法准确度良好,可适用于实际样品的检测,显示该技术在致病微生物多元检测的现场也具有极大的应用潜力。
4 结 论
本研究利用适配体结合量子点技术建立了可以同时检测金黄色葡萄球菌和大肠埃希氏菌O157:H7的“三明治结构”,该方法特异性强、检测灵敏度较高,缩短了2 种食源性致病菌的检测时间,减小了检测难度。且可实现牛乳样品的快速检测,为同时检测由上述2 种食源性致病菌污染牛乳引起的食物中毒提供可靠技术支持。

