基于酶活力模型和细胞模型分析红毛藻多糖降血脂活性
詹 慧,宋田源,余 刚,姜泽东,2,3,4,,杜希萍,2,3,4,朱艳冰,2,3,4,倪 辉,2,3,4,李清彪,2,3,4
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;3.厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建 厦门 361021;4.厦门市食品生物工程技术研究中心,福建 厦门 361021)
高脂高糖的饮食习惯是诱发多种慢性疾病,如肥胖、动脉粥样硬化、高脂血症等的重要因素,过量摄入脂质会增加心/脑血管疾病发生的风险[1]。胰脂肪酶是最主要的脂肪水解酶,它可将膳食中的大部分脂肪水解为脂肪酸和甘油单酯,在脂肪和胆固醇的吸收过程中具有非常重要的作用[2]。研究表明特异性的胰脂肪酶抑制剂可作为高脂血症类疾病的有效治疗药物[3],如奥利司他[4],但长期服用这类药物会产生腹泻、腹痛、溏便、恶心等副作用[5]。从天然膳食材料中筛选安全的脂肪酶抑制剂是解决该问题的重要途径之一。
多糖是海藻中重要的膳食营养元素之一。海藻多糖的化学组成和结构特征多样,表现出多种理化性质和生物活性。近年来,海藻多糖如岩藻聚糖、泡叶藻聚糖、褐藻胶、龙须菜多糖、紫菜多糖和琼脂等因具有优良的物理化学特性和生物活性,如降血糖[6-7]、降高血压[8-9]、抗氧化[10]、抗肿瘤[11]、抗炎[12]和降血脂活性[13-14]等,已被作为功能性食品、化妆品甚至是药物广泛应用[15-16]。红毛藻(Bangia fusco-purpurea)又称红毛菜,在中国东南沿海分布较广,福建省莆田市南日岛镇是其主要产区之一[17-18]。红毛藻具有提高免疫力、降血压、降血脂、滋阴祛火和防止动脉粥样硬化等多种食药用功效[19],但其食药用功效机理尚不明确。Jiang Zedong等[20]报道红毛藻多糖(B.fusco-purpureapolysaccharide,BFP)可通过竞争性抑制β-淀粉酶活力和非竞争性抑制β-葡萄糖苷酶活力,具有潜在抑制餐后血糖升高的功效。蔡薇[21]研究发现BFP及其分离组分(F1、F2、F3)能够通过诱导核因子κB和细胞外调节蛋白激酶/丝裂原活化蛋白激酶信号通路诱导小鼠巨噬细胞(RAW264.7)活化释放NO和分泌肿瘤坏死因子α,具有潜在的免疫诱导活性。目前,鲜有对红毛藻降血脂活性机理的研究报道。本研究在分离纯化红毛藻主要营养元素多糖组分的基础上,研究其对胰脂肪酶活力的影响,并利用Caco-2细胞模型和高血脂/高胆固醇HepG2细胞模型,评价各BFP组分对游离脂肪酸吸收及细胞模型中甘油三酯与胆固醇合成能力的抑制作用,阐明红毛藻降血脂活性机制。
1 材料与方法
1.1 材料与试剂
红毛藻采集于福建省莆田市南日岛镇红毛藻养殖海域,晾干后,冷藏备用。
人肝癌(HepG2)细胞、人结直肠腺癌(Caco-2)细胞购于中国科学院典型培养物保藏委员会细胞库(上海)。
Sephadex G-75葡聚糖凝胶层析柱 瑞典GE公司;DEAE-cellulose 52阴离子交换柱 美国Whatman公司;胎牛血清、PierceTMBCA蛋白检测试剂盒 美国赛默飞世尔科技公司;100×双抗(100 IU/mL青霉素及100 μg/mL链霉素)溶液、油酸、胰蛋白酶、牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma-Aldrich公司;高糖DMEM培养基 美国Hyclone公司;甘油三酯、总胆固醇、游离脂肪酸和脂肪酶检测试剂盒 南京建成生物工程研究所有限公司;胰脂肪酶(来源于猪胰腺,EC 3.1.1.3)、奥利司他、辛伐他洒 默克生命科学(上海)有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Avanti J26XP高速冷冻离心机 德国贝克曼公司;Free Zone 6 Plus真空冷冻干燥机 美国Labconco公司;Cytation-5细胞成像多功能检测系统、Cytation-5酶标仪美国伯腾仪器有限公司;HERACELL Vois 160i CO2细胞培养箱 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 BFP的提取及各组分的分离纯化
BFP的提取[21-22]:红毛藻经自来水洗净,60 ℃烘干,粉碎并过100 目筛网后得到红毛藻粉。精确称取50 g干燥藻粉,加入300 mL无水甲醇搅拌处理2 h以去除醇溶性色素和杂质。甲醇处理结束后,烘干备用。藻粉和蒸馏水按照1∶100(m/V)比例混匀,于90 ℃热水抽提2 h。水提液冷却至室温后,离心(8 000×g,20 min),收集上清液。在搅拌情况下向上清液中缓慢滴加无水乙醇至乙醇终体积分数为75%,以获得醇沉液。静置过夜后,醇沉液离心(10 000×g,15 min)并收集沉淀。沉淀经适量蒸馏水复溶后,置于透析袋(分子截留量3500 Da)中,在4 ℃下于蒸馏水中透析48 h。透析结束后,透析袋中溶液经旋转蒸发浓缩、冷冻干燥后得到红毛藻粗多糖。
BFP的分离纯化[21]:采用Sevag法[23]去除红毛藻粗多糖中蛋白质,冷冻干燥得到去蛋白的红毛藻粗多糖。取3.0 mL 5 mg/mL红毛藻粗多糖溶液,加载到Sephadex G75凝胶层析柱(1.6 cm I.D.×100 cm),用0.1 mol/L NaCl溶液以0.5 mL/min的流速进行洗脱,用苯酚-硫酸法[24]监测并收集多糖组分。收集的组分经透析、浓缩、冷冻干燥后获得纯化的BFP。配制一定质量浓度的BFP溶液,采用DEAE Cellulose 52柱层析法(2.6 cm I.D.×20 cm)进一步分离纯化,用不同浓度(0、0.1、0.3、0.5 mol/L)NaCl溶液进行梯度洗脱。用苯酚-硫酸法监测,收集得到3 个组分(F1、F2和F3),经浓缩、透析和冷冻干燥后备用。
1.3.2 BFP组分对胰脂肪酶活力的影响实验
参照文献[25]所述方法分析BFP组分对胰脂肪酶活力的影响。胰脂肪酶溶于50 mmol/L Tris缓冲液(pH 8.0)中,离心(10 000×g,10 min),取上清液,得到1 000 IU/mL的胰脂肪酶溶液。反应底物棕榈酸4-硝基苯酯(4-nitrophenyl palmitate,pNPP)溶于含体积分数5%异丙醇的Tris缓冲液中,制备浓度为2.0 mmol/L的pNPP溶液。BFP各组分(F1、F2和F3)溶于Tris缓冲液中,制备各BFP各组分溶液。分别将不同质量浓度(0、200、400、600、800、1 000 μg/mL)的各BFP组分溶液(50 μL)和胰脂肪酶溶液(50 μL)混合均匀后,于37 ℃下孵育10 min,然后立即加入100 μL pNPP溶液,再次置于37 ℃下反应10 min。反应结束后,立即100 ℃水浴5 min以终止反应。终止后的反应液离心(5 000×g,10 min)去除沉淀,于405 nm波长处测定各反应体系吸光度。以奥利司他作为阳性对照,BFP组分对胰脂肪酶活力的影响用酶活力抑制率表示,按式(1)计算。通过线性拟合计算BFP组分对胰脂肪酶活力的半抑制浓度(half Inhibiting concentration,IC50)。

式中:AS、AN和AC分别表示添加BFP组分、未添加胰脂肪酶和未添加BFP组分反应体系的吸光度。
1.3.3 酶促动力学分析
取50 μL不同浓度(0、200、400、600、800、1 000 IU/mL)胰脂肪酶溶液与50 μL 500 μg/mL BFP组分溶液混匀,于37 ℃孵育10 min。孵育结束后,加入100 μL 2.0 mmol/L pNPP溶液混匀,于37 ℃反应10 min后终止反应,于405 nm波长处测定各反应体系的吸光度。以不添加BFP组分溶液的反应体系作为对照组。绘制酶解产物对硝基苯酚(p-nitrophenol,pNP)-吸光度标准曲线,根据标准曲线方程y=35.036x-0.002 5(R2=0.999 9),计算pNP浓度(mmol/L),再将反应后的pNP浓度除以反应时间得到反应速率(v,mmol/(L·min))。以v为纵坐标,胰脂肪酶浓度为横坐标绘制曲线,根据曲线斜率进行反应的可逆型判定。
取50 μL 500 IU/mL胰脂肪酶溶液与50 μL 1 000 μg/mL BFP组分溶液混匀,于37 ℃孵育10 min。孵育结束后,加入100 μL不同浓度(0.125、0.25、0.5、1.0、2.0 mmol/L)pNPP溶液混匀,于37 ℃反应10 min后终止反应,于405 nm波长处测定各反应体系的吸光度。以不添加BFP组分溶液的反应体系作为对照。绘制酶解产物对硝基苯酚(p-nitrophenol,pNP)-吸光度标准曲线,根据标准曲线方程y=35.036x-0.002 5(R2=0.999 9),计算pNP浓度(mmol/L),再将反应后的pNP浓度除以反应时间得到反应速率(v,mmol/(L·min))。以反应速率的倒数(1/v)对底物质量浓度的倒数(1/[S])作图,绘制Lineweaver-Burk双倒数曲线,确定最大反应速率(vmax)和米氏常数(Km)。根据双倒数图计算vmax、Km:曲线与纵轴的截距=1/vmax;曲线与横轴截距=-1/Km;根据vmax、Km变化确定抑制类型。
1.3.4 细胞培养
HepG2、Caco-2细胞均采用含10%胎牛血清、100 IU/mL青霉素及100 μg/mL链霉素的高糖DMEM培养基于37 ℃、5% CO2的细胞培养箱中培养。
1.3.5 BFP组分对细胞活力的影响实验
HepG2细胞预处理:HepG2细胞经胰酶消化后,以3×105个/孔接种到96 孔板中,37 ℃下孵育24 h。孵育结束后,移除细胞上清液,用含不同质量浓度(0、10、50、100、200、500 μg/mL)BFP组分或含不同浓度(0.125、0.25、0.5、1.0、2.0 mmol/L)油酸的生长培养基于37 ℃下继续孵育24 h。
Caco-2细胞预处理:Caco-2细胞经胰酶消化后,以3×105个/孔接种到96 孔板中,37 ℃下孵育24 h。孵育结束后,移除细胞上清液,用含不同质量浓度(0、200、400、600、800、1 000 μg/mL)BFP组分或含不同浓度(0.125、0.25、0.5、1.0、2.0 mmol/L)油酸的生长培养基于37 ℃下继续孵育24 h。
细胞活力测定[26]:取BFP组分F1、F2和F3或油酸处理24 h后的HepG2细胞或Caco-2细胞,移除细胞上清液,每孔中加入100 μL 5 g/100 mL噻唑蓝溶液(溶于磷酸盐缓冲液,pH 7.4),于37 ℃下继续孵育30 min。孵育结束,用磷酸盐缓冲液(pH 7.4)轻轻洗涤细胞2 次后,每孔中加入100 μL二甲亚砜溶出细胞内甲瓒。振荡20 min后,于570 nm波长处测定光密度(optical density,OD)值。以不加BFP组分或油酸处理为对照组,以二甲亚砜为溶剂空白。细胞活力按式(2)计算。

式中:AS、AC和A0分别表示BFP组分或油酸处理组、对照组和空白组体系的OD570nm。
Caco-2细胞以3×105个/孔接种至24 孔Transwell小室中,培养24 h。吸走小室内外的细胞上清液,处理组为小室内外均加入含不同质量浓度(50、500 μg/mL)BFP组分F1、F2和F3的生长培养基,于37 ℃下孵育24 h;空白组为小室内外均加入生长培养基孵育24 h。孵育结束后,小室内添加500 μL含油酸的诱导培养基(油酸终浓度100 μmol/L、BSA终浓度2 μmol/L),基底外侧隔室添加生长培养基,再次于37 ℃下孵育24 h。孵育结束后,移除小室内外的培养基,用BCA蛋白检测试剂盒测定细胞蛋白质含量,用游离脂肪酸检测试剂盒测定基底外侧隔室培养基中游离脂肪酸含量[27],结果以蛋白质量计。
1.3.7 BFP组分对高脂HepG2细胞模型甘油三酯合成的影响实验
取HepG2细胞以3×105个/孔接种至96 孔板,待其贴壁。用无血清的DMEM培养基洗涤细胞后,用含不同质量浓度(0、50、100、200、500 μg/mL)BFP组分F1、F2和F3的DMEM培养基,于37 ℃孵育12 h,然后去除细胞上清液,用含油酸的诱导培养基(油酸终浓度0.5 mmol/L、BSA终浓度2 μmol/L)[28]继续培养24 h。以DMEM培养基培养36 h的正常HepG2细胞为空白组。
孵育结束后,用磷酸盐缓冲液(pH 7.4)轻轻洗涤细胞3 次。用RIPA裂解液(50 mmol/L Tris、150 mmol/L NaCl、1% Triton X-100、1 g/100 mL脱氧胆酸盐、0.1 g/100 mL十二烷基硫酸钠,pH 7.4)在冰浴下裂解细胞30 min,4 ℃、10 000×g下离心15 min,取上清液。用BCA蛋白检测试剂盒测定细胞蛋白质含量,使用甘油三酯检测试剂盒测定上清液中甘油三酯含量,结果以蛋白质量计。
1.3.8 BFP组分F3对高胆固醇HepG2细胞模型中脂类合成的影响实验
取HepG2细胞以3×105个/孔接种至96 孔板,待其贴壁,移除细胞上清液,用含不同质量浓度(0、50、100、200、500 μg/mL)BFP组分F3的DMEM培养基于37 ℃孵育12 h,去除细胞上清液,再用含胆固醇的诱导培养基(胆固醇质量浓度15 μg/mL、BSA质量浓度2 μg/mL)[29-30]继续培养24 h;以用DMEM培养基培养12 h,去除细胞上清液,再用含15 μg/mL胆固醇和0.2 μg/mL辛伐他洒的培养基继续培养24 h的细胞为辛伐他洒组。
孵育结束后,用1.3.7节中方法裂解细胞,用BCA蛋白检测试剂盒测定细胞蛋白含量,用总胆固醇检测试剂盒测定HepG2细胞中总胆固醇含量,结果以蛋白质量计。
本试验通过生物显微镜分析了丝瓜络纤维的纵向和横截面结构形态;测定了丝瓜络纤维的回潮率、力学性能、耐酸碱性能以及对重金属的吸附性能等。
1.4 数据统计与分析
每个实验重复3 次,利用Microsoft Office Excel 2016软件处理数据,用Graphpad Prism 8.0软件作图,用SPSS软件单因素方差分析检验数据差异的显著性,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 BFP各组分对胰脂肪酶活力的影响

图1 BFP组分对胰脂肪酶活力的抑制作用Fig.1 Inhibitory effects of polysaccharide fractions from B.fusco-purpurea on pancreatic lipase activity
由图1可知,在质量浓度0~1 000 μg/mL范围内,BFP组分F1、F2和F3对胰脂肪酶活力有不同程度的抑制作用。其中组分F3对胰脂肪酶活力的抑制活性最强,且随着质量浓度的增大,抑制效果极显著增强(P<0.01),呈浓度依赖性;当组分F3质量浓度为1 000 μg/mL时,抑制率达到97.35%。拟合得到组分F3对胰脂肪酶活力的抑制曲线方程为y=0.108 0x-3.325 2,计算得到组分F3对胰脂肪酶活力的IC50为0.49 μg/mL,奥利司他对胰脂肪酶活力的IC50为1.45 μg/mL。
2.2 BFP各组分对胰脂肪酶抑制作用的酶促动力学分析
由于组分F3对胰脂肪酶活力的抑制活性最强,选择组分F3进行BFP对胰脂肪酶抑制作用的酶促动力学分析。由图2A可知:在固定底物浓度(2.0 mmol/L)的情况下,添加和不添加BFP组分F3,胰脂肪酶的酶促反应速率(v)均随胰脂肪酶浓度(0~1 000 IU/mL)的增大而增加;添加BFP组分F3后,v降低,曲线斜率变小;并且两条曲线均过原点,表明BFP组分F3对胰脂肪酶活力的抑制类型为可逆性抑制。由图2B可知:在固定胰脂肪酶浓度(500 IU/mL)的情况下,添加和不添加BFP组分F3,1/v和1/[S]均呈线性正相关;2 条曲线相交于Y轴上同一点,即添加BFP组分F3后,vmax不变,Km增大。由此可判断BFP组分F3对胰脂肪酶活力为竞争性抑制。综上所述,BFP组分F3对胰脂肪酶活力的抑制作用为可逆竞争性抑制。

图2 BFP组分F3对胰脂肪酶活力作用的抑制类型(A)和Lineweaver-Burk曲线(B)Fig.2 Inhibition type of F3 on pancreatic lipase activity (A) and Lineweaver-Burk curve (B)
2.3 BFP组分对HepG2细胞和Caco-2细胞活力的影响

图3 BFP组分和油酸对HepG2细胞和Caco-2细胞活力的影响Fig.3 Effects of polysaccharide fractions from B.fusco-purpurea and oleic acid on the viability of HepG2 cells and Caco-2 cells
由图3A可知,在质量浓度0~500 μg/mL范围内,BFP组分F1、F2和F3对HepG2细胞活力均无显著影响(P>0.05),表明3 种BFP组分在实验选取质量浓度范围内对HepG2细胞没有直接毒性作用。由图3B可知,与对HepG2细胞活力的影响相似,BFP组分F1、F2和F3在质量浓度0~1 000 μg/mL范围内对Caco-2细胞也均无毒性作用。由图3C可知,在浓度超过1.0 mmol/L后,油酸对HepG2和Caco-2细胞活力均有显著抑制作用,表明较高浓度的油酸对HepG2和Caco-2细胞有毒性作用。因此,后续实验采用0.5 mmol/L油酸作为构建细胞模型的上限浓度。
2.4 BFP组分对油酸诱导Caco-2细胞模型中游离脂肪酸吸收的影响
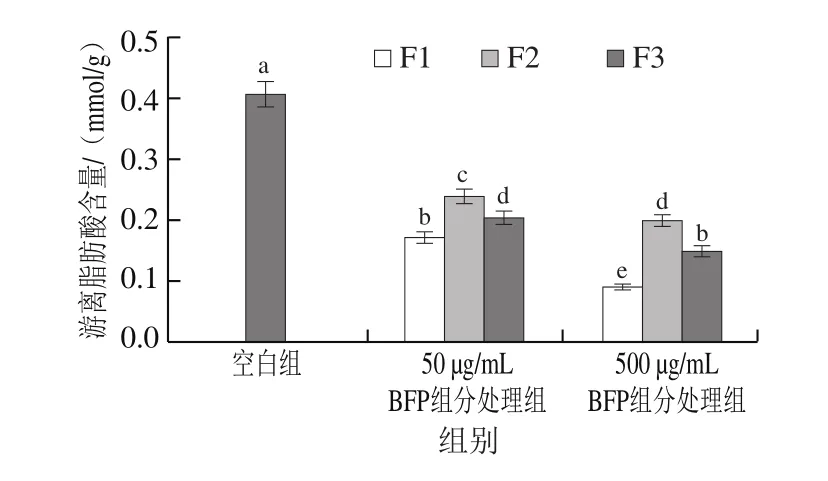
图4 BFP组分对油酸诱导Caco-2细胞游离脂肪酸吸收的影响Fig.4 Effects of polysaccharide fractions from B.fusco-purpurea on absorption of free fatty acids in Caco-2 cells induced by oleic acid
由图4可知,与空白组相比,经不同质量浓度(50、500 μg/mL)BFP组分F1、F2和F3处理后,油酸诱导Caco-2细胞对游离脂肪酸的吸收均显著降低(P<0.05),表明3 种BFP组分均能有效抑制油酸诱导Caco-2细胞对游离脂肪酸的吸收。其中,组分F1抑制Caco-2细胞吸收游离脂肪酸的活性优于组分F2和F3(P<0.05)。
2.5 BFP组分对高脂HepG2细胞模型中甘油三酯合成的影响

图5 BFP对高脂HepG2细胞甘油三酯合成的影响Fig.5 Effects of polysaccharide fractions from B.fusco-purpurea on triglyceride synthesis in high-fat HepG2 cells
由图5可知,与空白组正常HepG2细胞相比,0.5 mmol/L油酸诱导的模型组高脂HepG2细胞中甘油三酯含量显著提高(P<0.05),表明高脂HepG2细胞模型构建成功。与模型组相比,BFP组分F1、F2和F3处理后,0.5 mmol/L油酸诱导高脂HepG2细胞中的甘油三酯含量均显著降低(P<0.05),表明3 种BFP组分对高脂HepG2细胞中甘油三酯的积累均具有显著抑制作用,且随BFP组分质量浓度的增加,抑制效果也相应增强,呈浓度依赖性。其中,组分F3对高脂HepG2细胞甘油三酯合成的抑制活性最强。
2.6 BFP组分F3对高胆固醇HepG2细胞模型中脂类合成的影响
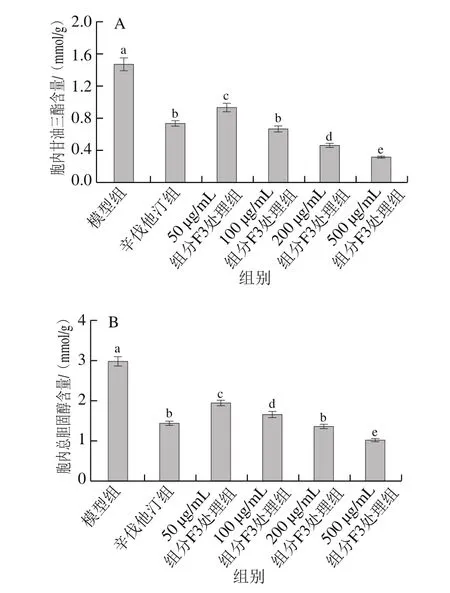
图6 BFP组分F3对高胆固醇HepG2细胞中脂类合成的影响Fig.6 Effect of F3 on lipid synthesis in high-cholesterol HepG2 cells
由于BFP组分F3对油酸诱导高脂HepG2细胞中甘油三酯积累的抑制活性最强,选择组分F3研究其对高胆固醇HepG2细胞模型中脂类合成的影响。由图6可知,与模型组相比,辛伐他洒组HepG2细胞内甘油三酯和总胆固醇含量均显著降低(P<0.05),表明辛伐他洒作为临床应用的血脂调节剂和胆固醇合成关键酶羟甲基戊二酰辅酶A还原酶抑制剂,可有效抑制高胆固醇HepG2细胞模型中的脂类合成。与模型组相比,在质量浓度50~500 μg/mL范围内,BFP组分F3处理高胆固醇HepG2细胞的胞内甘油三酯和总胆固醇含量均显著降低(P<0.05),且呈浓度依赖效应,表明组分F3在实验所选质量浓度范围内具有较好的抑制高胆固醇HepG2细胞模型中脂类合成的活性。并且,在较高质量浓度(200~500 μg/mL)范围内,组分F3抑制高胆固醇HepG2细胞模型中脂类合成的活性显著优于0.2 μg/mL辛伐他洒(P<0.05)。
3 讨 论
蔡薇[21]的研究结果表明,红毛藻中提取的粗多糖经Sephadex G75葡聚糖凝胶过滤柱层析和DEAE-cellulose 52阴离子交换柱分离纯化得到3 个多糖组分,红毛藻中提取的粗多糖及3 个组分的得率分别为5.68%、40.8%、6.0%、6.8%,且均为杂多糖,不同组分的单糖组成也存在较大差异。多糖组成是其生物活性差异的基础。本实验选取BFP组分F1、F2和F3为研究对象,结果表明,BFP组分F1、F2和F3对胰脂肪酶活力均有显著抑制作用,其中组分F3表现出的胰脂肪酶活力抑制作用最强,组分F3质量浓度为1 000 μg/mL时胰脂肪酶活力抑制率达到97.35%。酶促动力学分析结果表明,组分F3对胰脂肪酶活力的抑制属于可逆竞争性抑制。胰脂肪酶是水解膳食中脂类的关键酶,在甘油单酯和脂肪酸的消化和吸收中起到重要作用[2]。因此,抑制胰脂肪酶的活性对于治疗高脂饮食所导致的高血脂疾病具有重要意义。
过量摄入脂肪后,人体会生成大量游离脂肪酸,进而导致机体甘油三酯积累和相关脂蛋白的分泌,最终增加血脂水平[31]。人体中的甘油三酯主要来源于2 条途径:小肠黏膜细胞吸收食物中脂肪消化产物(甘油和脂肪酸)重新合成甘油三酯(外源性);以及肝细胞和脂肪细胞通过非脂类物质生物合成甘油三酯(内源性)。相关研究表明,Caco-2细胞具有小肠黏膜细胞的生理生化功能,多用于与肠道吸收过程相关的研究[31];HepG2细胞保留了天然肝细胞的正常生化功能,因此被广泛用于研究甘油三酯在肝脏中的合成能力[28]。因此,本实验采用油酸诱导Caco-2细胞模型研究BFP组分对游离脂肪酸吸收的影响(外源性);采用高脂HepG2细胞模型研究BFP组分对甘油三酯合成的影响;采用高胆固醇HepG2细胞模型研究BFP组分F3对脂类合成的影响(内源性),以评价BFP组分的体外降血脂活性。结果表明:在毒性限制质量浓度范围内,组分F1表现出较强的抑制油酸诱导Caco-2细胞对游离脂肪酸吸收的作用,且具有浓度依赖性(P<0.05),是抑制Caco-2细胞摄取游离脂肪酸的主要活性组分;组分F3能够显著抑制高脂HepG2细胞模型中细胞内甘油三酯的合成(P<0.05)和高胆固醇HepG2细胞模型中细胞内脂类(总胆固醇和甘油三酯)的合成,且均呈浓度依赖性(P<0.05)。基于细胞模型实验结果,认为BFP是一种潜在的天然降血脂活性成分,可应用于调节血脂健康食品的开发,为降血脂健康食品甚至药品开发提供良好原料。
4 结 论
BFP经分离纯化获得3 个组分F1、F2和F3。组分F1是BFP抑制Caco-2细胞吸收游离脂肪酸的主要活性片段;组分F3可以有效抑制胰脂肪酶活力(IC50=0.49 mg/mL);组分F3可抑制高脂HepG2细胞中甘油三酯的合成和高胆固醇HepG2细胞中脂类(甘油三酯和胆固醇)的合成。综上所述,BFP各组分(主要是F1和F3)共同作用,可通过竞争性抑制胰脂肪酶活性,有效降低外源性膳食脂肪的水解和消化,抑制肠道对游离脂肪酸的吸收;同时,内源性抑制肝脏对甘油三酯的合成,具有潜在的降血脂功效。本研究应用酶活力分析模型和细胞模型评价BFP的潜在降血脂活性,阐明BFP的降血脂活性机制,为提升红毛藻精深加工产业价值和促进BFP在健康食品、生物医药等领域的应用奠定理论基础。

