解淀粉芽孢杆菌素Amylocyclicin W5的纯化及其抑菌机理
王 伟,李津津,迟 海,
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海理工大学医疗器械与食品学院,上海 200093)
近年来抗生素长期的滥用促使细菌耐药性增强,进而导致耐药性致病菌的检出频率增加。耐药性致病菌的传播给人类健康带来了一定威胁[1-2]。同时,食源性致病菌污染和繁殖是造成食品安全隐患的首要问题之一[3]。全球因误食污染食源性致病菌食物而引发的中毒现象普遍存在[4-5]。添加化学食品抑菌剂是抑制食源性致病菌生长的有效手段之一,然而化学抑菌剂对人体的潜在危害成为消费者日益担忧的食品安全问题。细菌素是细菌核糖体编码合成的一类对亲缘微生物具有高效抑制作用的抑菌肽或前体多肽[6]。由于细菌素具有绿色、无残留、安全、高效的特点,目前已成为抗生素和化学抑菌剂替代品的极佳选择之一[7-8]。然而目前只有乳酸链球菌素(Nisin)通过美国食品药品监督管理局/世界卫生组织认证并允许在食品中应用,主要原因是其他细菌素大多存在抑菌谱窄和抑菌机理不明确两方面的局限性[9-11]。因此筛选、鉴定具有广谱抑菌性的细菌素并对其抑菌机理进行研究对细菌素的应用推广具有重大意义。
芽孢杆菌(Bacillussp.)作为动植物和微生态的优势菌广泛存在于自然界中[12-16]。其中解淀粉芽孢杆菌(B.amyloliquefaciens)能够产生多种活性物质,这些活性物质可以有效抑制多种病原微生物的生长,具有良好的研究和应用价值[17-21]。本研究基于前期筛选所得到的一株解淀粉芽孢杆菌DH8030(B.amyloliquefaciensDH8030),通过对其产生的具有广谱抑菌效应的细菌素(命名为Amylocyclicin W5)进行系统纯化,估测了该细菌素分子质量;同时通过抑菌能力分析、扫描电子显微镜以及透射电子显微镜观察3 个方面对Amylocyclicin W5的抑菌机理进行了探究,旨在为新型广谱细菌素的开发利用及其在食品安全领域的应用研究提供数据支持。
1 材料与方法
1.1 菌株、材料与试剂
指示菌蜡样芽孢杆菌(B.cereus)LMGT2805、耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcus aureus,MRSA)LMGT3263[22]、肠出血性大肠杆菌O157:H7(Escherichia coliO157:H7)DH8013[23]和产细菌素的解淀粉芽孢杆菌DH8030(B.amyloliquefaciensDH8030)均由中国水产科学研究院东海水产研究所提供。
Nisin 北京蕾创生物科技有限公司;脑心浸出液(brain heart infusion,BHI)培养基 英国OXIOD公司;琼脂粉 上海蓝季科技发展有限公司;硫酸铵、磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 6.8)、透析袋 国药(上海)化学试剂有限公司;0.22 μm聚偏氟乙烯滤膜、0.45 μm聚偏氟乙烯滤膜上海生工生物工程股份有限公司;ExBlue蛋白超快染色液北京庄盟国际生物基因科技有限公司;三氟乙酸(trifluoroacetic acid,TFA)、乙腈 美国Sigma公司;氯化钠 北京华奥宝生科技有限公司;三羟甲基-甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳凝胶制备试剂盒、超低分子质量蛋白Marker(3.3~31.0 kDa)、1×三羟甲基-甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳电泳缓冲液、2×三羟甲基-甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳上样缓冲液北京索莱宝科技有限公司。
1.2 仪器与设备
Power Wave XS微孔板扫描分光光度计 美国BIO-TEK有限公司;SEX-TJ超净工作台 上海生叉仪器有限公司;YXQ-LS-50 SII立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;CHA-S恒温振荡器 国华电器有限公司;CF 16RXII低温离心机、SU8010高分辨冷场发射扫描电子显微镜、ES-2030型冷冻干燥仪日本日立有限公司;ÄKTA蛋白纯化系统 通用电气(中国)医疗集团生命科学部。
1.3 方法
1.3.1 最低半抑菌浓度确定
将过夜培养的B.amyloliquefaciensDH8030菌液按1%(体积分数)接种量接种到400 mL的BHI液体培养基中,30 ℃条件下培养至少12 h。发酵液于12 000 r/min、4 ℃条件下离心30 min,收集上清液并用0.22 μm的滤膜过滤。按照Chi Hai等的方法[24],利用96 孔板二倍稀释法测定Amylocyclicin W5发酵上清液和Nisin(质量浓度为10 mg/mL)分别对B.cereusLMGT2805、MRSA LMGT3263以及E.coliO157:H7 DH8013的最低半抑菌浓度(minimum inhibitory concentration,MIC50)。其中,细菌素的抑菌单位(bacteriocin unit,BU)被定义为抑制200 μL条件下50%指示菌(B.cereusLMGT2805)菌量(OD600nm≈0.20~0.25)所需要Amylocyclicin W5最少的体积[24]。不同稀释倍数的细菌素Amylocyclicin W5抑制指示菌所需体积越少,即对应的抑菌孔数越多,抑菌效果越明显。
1.3.2 硫酸铵沉淀初步纯化
将制备好的Amylocyclicin W5发酵上清液平均分装成8 份,每份50 mL;将硫酸铵分别添加至每份上清液中至不同的硫酸铵饱和度(10%~80%)[25]。待硫酸铵完全溶解后,于4 ℃条件下静置过夜后10 000 r/min离心25 min,取上清液作为粗提物。对得到的粗提物分别进行抑菌实验并对抑菌效果最好的粗提物进行透析。利用截留分子质量为8.0~14.0 kDa的透析袋,以体积分数0.1%的TFA为透析液对该粗提物进行反复透析,透析5 次后的粗提物置于-20 ℃冰箱备用并利用96 孔板二倍稀释法测定抑菌活性。
1.3.3 离子交换分离纯化
将10 mL细菌素粗提物经恒流泵以5 mL/min的流速加入至Hiprep SP XL 16/10离子交换柱。当粗提物全部加入完毕后,用2~3 倍细菌素体积的PBS进行洗脱平衡,然后分别使用0.5 mol/L和1 mol/L NaCl进行梯度洗脱。收集每一步所得的洗脱液,利用1.3.1节的方法测定抑菌活性。
1.3.4 ÄKTA蛋白纯化系统纯化
参考Halimi等[26]方法,在ÄKTA蛋白纯化系统中使用C18反向色谱柱(250 mm×4.6 mm)对细菌素进行进一步的分离纯化,并对分离纯化后的细菌素进行冷冻干燥,同时采用抑菌圈实验确定抑菌活性:将不同纯化组分用高纯水溶解,取2 μL点于BHI培养基观察抑菌圈。
1.3.5 三羟甲基-甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
参考Schägger等[27]的方法,将冻干浓缩好的细菌素提纯物质进行三羟甲基-甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。其中浓缩胶质量分数为4%,夹层胶质量分数为10%,分离胶质量分数为16.5%。采用分子质量3.3~31.0 kDa的Marker作为标准参照。电泳结束后使用ExBlue蛋白超快染色液对胶进行染色和脱色,在Bio-Rad成像系统中进行观察分析。
1.3.6 Amylocyclicin W5对B.cereusLMGT2805的抑菌实验
以过夜培养的B.cereusLMGT2805为指示菌,采用96 孔板微量测定法测定不同倍数最低半抑菌浓度(MIC50、2 MIC50和4 MIC50)Amylocyclicin W5在12 h内对B.cereusLMGT2805的抑菌情况。每隔0.5 h测定一组OD600nm。以时间为横坐标、OD600nm为纵坐标绘制B.cereusLMGT2805的生长曲线。
1.3.7 扫描电子显微镜和透射电子显微镜观察
将1 L过夜培养的B.cereusLMGT2805菌液平均分成4 份,分别在3 500 r/min、4 ℃下离心15 min,弃上清液收集沉淀,得到B.cereusLMGT2805的营养型菌体;取两份沉淀分别与体积分数50%乙醇溶液等体积混合后静置1 h,3 500 r/min、4 ℃下离心15 min,弃上清液,收集沉淀得到B.cereusLMGT2805的芽孢型菌体[28]。等体积的细菌素Amylocyclicin W5发酵上清液分别与营养型和芽孢型菌体混合作为实验组,未经过细菌素Amylocyclicin W5发酵上清液处理的营养型和芽孢型菌体作为对照组。将对照组和实验组置于30 ℃摇床中培养4 h后,分别在3 500 r/min、4 ℃条件下离心15 min,弃上清液收集沉淀。参考高明明[29]的方法将样品置于固定液中进行样品制备,并参考Lee等[30]的方法,分别对对照组和实验组的B.cereusLMGT2805进行扫描电子显微镜和透射电子显微镜观察。
1.4 数据处理与分析
采用Excel软件对数据进行分析处理,采用Origin 8.0软件作图。
2 结果与分析
2.1 Amylocyclicin W5的抑菌活性
表1为Amylocyclicin W5及Nisin的抑菌活性比较,结果显示,Amylocyclicin W5对B.cereusLMGT2805的MIC50为5 BU/mL,Nisin抑制同样体积的B.cereusLMGT2805时其MIC50为1.6 μg/mL;抑制相同体积的MRSA LMGT3263时Amylocyclicin W5的MIC50为20 BU/mL,Nisin的MIC50为50 μg/mL;Amylocyclicin W5对E.coliO157:H7 DH8013有抑制作用(MIC50为1 280 BU/mL),而Nisin单独作用时不能抑制E.coliO157:H7 DH8013。以上结果表明,Amylocyclicin W5不仅可以抑制革兰氏阳性菌B.cereus和MRSA,还可以对革兰氏阴性菌E.coliO157:H7产生抑制作用。
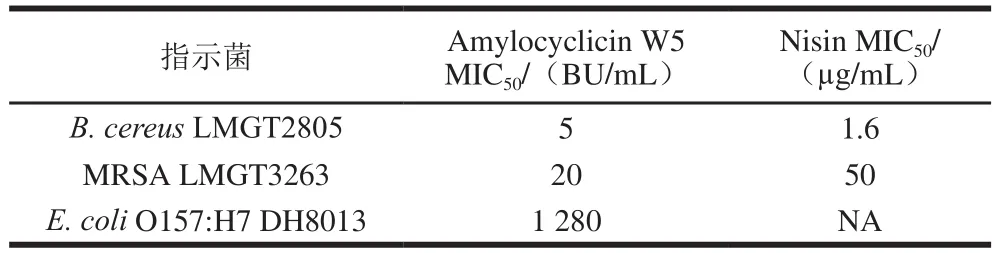
表1 Amylocyclicin W5及Nisin的抑菌活性比较Table 1 Comparison of inhibition activity of amylocyclicin W5 and nisin
2.2 硫酸铵最佳饱和度的确定
发酵上清液经不同饱和度硫酸铵沉淀得到的细菌素粗提物对B.cereusLMGT2805的抑菌活性见图1,40%~60%饱和度硫酸铵沉淀的抑菌孔数呈增加趋势,说明随着硫酸铵饱和度的增加,发酵上清液中的抗菌蛋白的沉淀量也在增加;但抑菌孔数并未达到最大,说明还有部分抗菌蛋白没有沉淀。当硫酸铵饱和度为70%时,抑菌孔数增加至8时,达到最大抑菌孔数;但当硫酸铵饱和度增加至80%时,抑菌孔数未见继续增加,这说明硫酸铵饱和度为70%时抗菌蛋白基本已经完全沉淀,当饱和度进一步增加时沉淀的可能是一些无抗菌活性的蛋白。因此,最适宜沉淀解淀粉芽孢杆菌素Amylocyclicin W5的硫酸铵饱和度为70%。
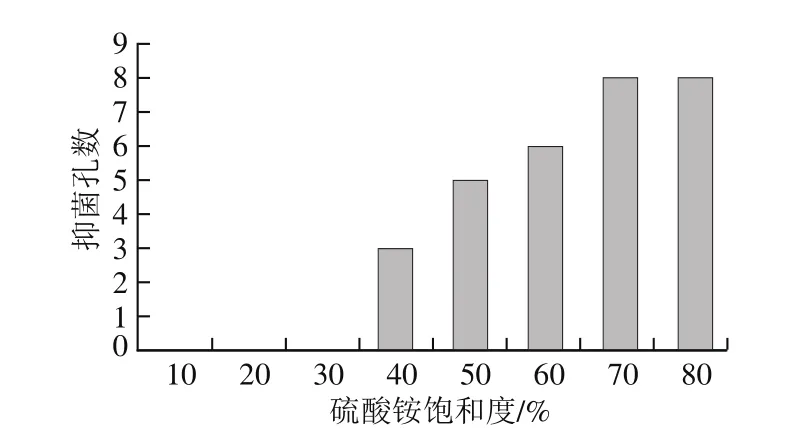
图1 不同饱和度硫酸铵沉淀得到的细菌素粗提物的抑菌效果Fig.1 Antimicrobial activity of crude bacteriocin precipitated by different concentrations of ammonium sulfate
2.3 离子交换柱层析纯化和ÄKTA蛋白纯化系统分离纯化结果
离子交换柱层析纯化结果显示,只有经过0.5 mol/L NaCl洗脱后对应的收集液对B.cereusLMGT2805具有抑菌效果。这说明0.5 mol/L NaCl可以很好地将吸附在HiPrep SP XL 16/10柱上的细菌素洗脱。图2为经过离子交换柱层析纯化后的细菌素Amylocyclicin W5经C18反向色谱柱及ÄKTA蛋白纯化系统纯化后的结果,细菌素Amylocyclicin W5经流动相(纯乙腈和体积分数0.1%TFA-乙腈溶液)梯度洗脱后共有两个峰(F1和F2)。其中只有组分F2对B.cereusLMGT2805有抑菌效果,因此收集F2对应的洗脱液进行后续实验。
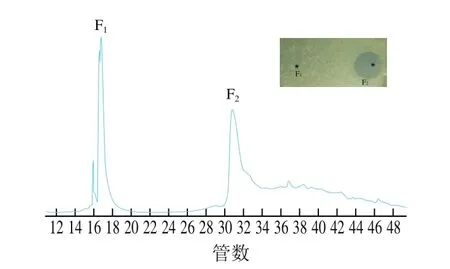
图2 Amylocyclicin W5经ÄKTA蛋白纯化系统纯化结果及对B.cereus LMGT2805 的抑菌活性Fig.2 Elution curve of amylocyclicin W5 using ÄKTA purification system and inhibitory activity of separated fractions against B.cereus LMGT2805
2.4 细菌素Amylocyclicin W5纯化物的三羟甲基-甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析结果
将纯化后的细菌素Amylocyclicin W5进行三羟甲基-甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,结果见图3。细菌素Amylocyclicin W5经过0.5 mol/L NaCl洗脱后得到的细菌素条带不单一,表明纯度较低,还存在较多的杂蛋白;进一步利用C18反向色谱柱经ÄKTA蛋白纯化系统收集到的F2洗脱液在电泳后仅得到一条蛋白条带,初步判断出细菌素Amylocyclicin W5的分子质量约为12.3 kDa。
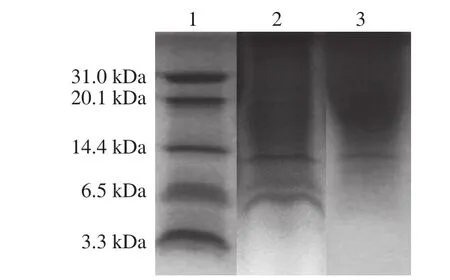
图3 细菌素纯化物的三羟甲基-甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果Fig.3 Tris-tricine-SDS-PAGE electrophoresis of bacteriocin purified products
2.5 Amylocyclicin W5对B. cereus LMGT2805生长的抑制情况
为探究细菌素Amylocyclicin W5对B.cereusLMGT2805的抑菌方式,分别测定了MIC50、2 MIC50、4 MIC50的细菌素Amylocyclicin W5在12 h内对B.cereusLMGT2805的生长抑制曲线。由图4可以看出,与未经Amylocyclicin W5处理的B.cereusLMGT2805(对照组)相比,加入不同MIC50的Amylocyclicin W5对B.cereusLMGT2805生长均有抑制作用,而对照组的OD600nm则一直增加,直到达到稳定期后趋于稳定。对比加入MIC50、2 MIC50、4 MIC50细菌素的B.cereusLMGT2805生长曲线可知,MIC50、2 MIC50的细菌素分别在5、6.5 h内有效地抑制了B.cereusLMGT2805的生长,其菌液的OD600nm均低于0.2;加入4 MIC50细菌素的B.cereusLMGT2805在12 h内OD600nm一直低于0.1,未见B.cereusLMGT2805生长。由此可以看出,低浓度(MIC50和2 MIC50)细菌素Amylocyclicin W5在一定时间内(分别为5、6.5 h)可有效抑制B.cereusLMGT2805的生长,高浓度(4 MIC50)细菌素Amylocyclicin W5则可以在12 h内完全抑制B.cereusLMGT2805的生长。这一结果也说明当细菌素Amylocyclicin W5的浓度大于4 MIC50时,其对B.cereusLMGT2805具有完全抑制作用。
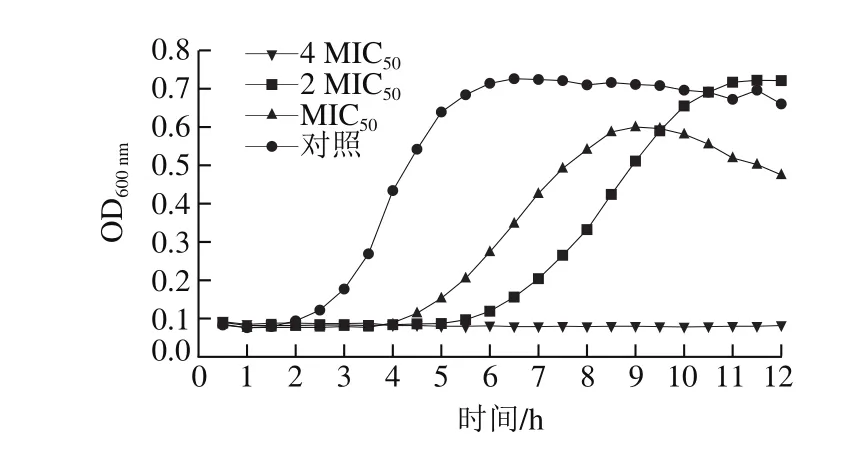
图4 不同浓度的Amylocyclicin W5对B.cereus LMGT2805的生长抑制曲线Fig.4 Growth curves of B.cereus LMGT2805 exposed to amylocyclicin W5 at different concentrations
2.6 Amylocyclicin W5作用后B. cereus LMGT2805在扫描电子显微镜下的细胞形态
Amylocyclicin W5作用4 h时在扫描电子显微镜下的B.cereusLMGT2805菌体细胞形态见图5。对照组(图5A1、B1)菌体细胞均呈均匀的杆状,表面光滑、边缘整齐、轮廓清晰,细胞结构十分完整;芽孢型的B.cereusLMGT2805经细菌素Amylocyclicin W5处理后,菌体细胞边缘粗糙、表面凹凸不平、褶皱明显,已经明显开始破裂,营养型的B.cereusLMGT2805经细菌素Amylocyclicin W5处理4 h后,细胞表面开始变得粗糙,细胞开始破裂,但不如细菌素Amylocyclicin W5对芽孢型B.cereusLMGT2805的菌体细胞表面形态破坏明显。

图5 Amylocyclicin W5作用前后的B.cereus LMGT2805扫描电子显微镜观察结果Fig.5 SEM photographs of B.cereus LMGT2805 treated with amylocyclicin W5
2.7 Amylocyclicin W5作用后B.cereus LMGT2805在透射电子显微镜下的内部结构
为了更加直观地观察细菌素Amylocyclicin W5对B.cereusLMGT2805的作用方式,利用透射电子显微镜观察了B.cereusLMGT2805在Amylocyclicin W5作用后菌体内部结构的变化(图6)。在透射电子显微镜下对照组无论是芽孢型菌体(图6A1、A2)还是营养型菌体的B.cereusLMGT2805(图6B1、B2),其细胞内容物饱满、结构完整,内部原生质结构紧密、无缺陷;实验组中则可以明显地看出芽孢型菌体B.cereusLMGT2805被细菌素作用后,细胞壁膜界限模糊、破损且有孔洞出现(图6A2),营养型状态的B.cereusLMGT2805经细菌素Amylocyclicin W5处理4 h后,观察到菌体边缘破裂,细胞破损严重以至膜结构脱落,大量内容物外泄使菌体细胞形成空泡化(图6B2)。这些结果表明,细菌素Amylocyclicin W5对B.cereusLMGT2805的抑菌机制主要是破坏其细胞壁或者使其形成孔洞,造成其内容物外泄,细胞正常代谢无法进行,从而最终导致细菌细胞的死亡。
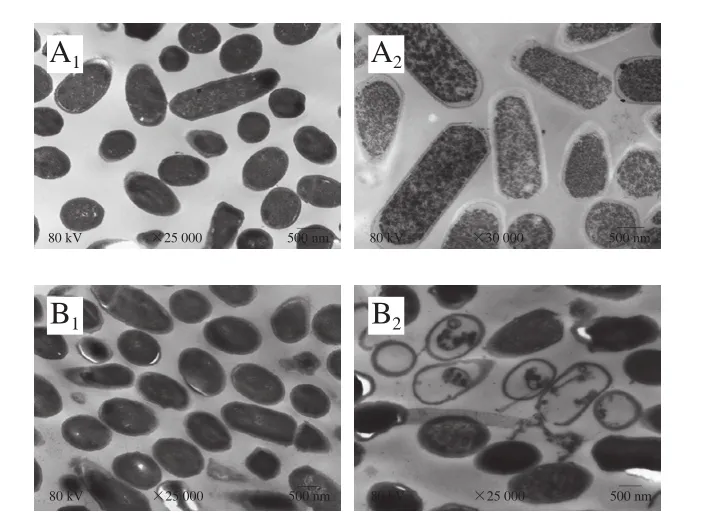
图6 Amylocyclicin W5作用前后B.cereus LMGT2805透射电子显微镜观察图Fig.6 TEM photographs of B.cereus LMGT2805 treated with amylocyclicin W5
3 结 论
本研究通过对Amylocyclicin W5进行一系列纯化及鉴定,对其抑菌性质及其抑菌机理进行阐释。实验结果显示,最适宜沉淀发酵上清液中抗菌蛋白物质的硫酸铵饱和度为70%;硫酸铵沉淀后的细菌素粗提物经HiPrep SP XL 16/10柱层析分离纯化,发现在0.5 mol/L NaCl条件下洗脱的收集液对B.cereusLMGT2805有抑菌活性;利用ÄKTA蛋白纯化系统对收集液进一步纯化,发现2 个收集峰(F1和F2)中只有F2组分对B.cereusLMGT2805有抑菌活性。因此,将收集峰F2对应的洗脱液再次冻干后进行三羟甲基甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,结果显示该细菌素的分子质量约为12.3 kDa。
同时,本研究通过细菌素Amylocyclicin W5对B.cereusLMGT2805的生长抑制情况、细胞形态变化以及细胞内部结构影响3 个方面探讨其抑菌机理。实验结果显示,高浓度(4 MIC50)条件下的Amylocyclicin W5可以在12 h内完全抑制B.cereusLMGT2805的生长。通过扫描电子显微镜观察和透射电子显微镜观察,结果表明,细菌素Amylocyclicin W5对B.cereusLMGT2805的抑菌机制主要是破坏其细胞壁或者使其形成孔洞,使其内容物外泄,细胞正常代谢无法进行,从而最终导致细菌细胞的死亡。
对细菌素Amylocyclicin W5的纯化以及抑菌机理的研究旨在为新型广谱细菌素的开发利用及其在食品安全领域的应用研究提供数据支持。未来有望通过基因工程手段阐明其合成途径,进一步拓宽其抑菌谱,从而将其广泛应用于食品加工、医药、化工等领域。

