黏质沙雷菌磷脂酶A1辅助蛋白S对表达宿主菌大肠杆菌抑制作用机制
甘玉飞,薛正莲,2,3,,周 杰,王 芳,王 洲,2,3,刘 艳,2,3
(1.安徽工程大学生物与食品工程学院,安徽 芜湖 241000;2.安徽省工业微生物分子育种工程实验室,安徽 芜湖 241000;3.微生物发酵安徽省工程技术研究中心,安徽 芜湖 241000)
磷脂酶A1是一类专一水解磷脂sn-1位酰基的水解酶[1],目前磷脂酶A1在食品、医疗、纺织等行业用途十分广泛,如被应用在油脂脱胶[2-6]、生产溶血磷脂[7]、加工卵黄等[8]中。磷脂酶A1在微生物中主要由沙雷氏菌属、假单胞菌、曲霉属和埃希氏杆菌属等产生。
Song[9]和Fu Jianhong[10]等将来源于沙雷氏菌MK1和沙雷氏菌xjF1的磷脂酶A1在大肠杆菌中表达,结果发现沙雷氏菌磷脂酶A1基因下游有一段基因与磷脂酶A1在大肠杆菌中高活性的表达密切相关。本课题组前期研究发现,一株来源于黏质沙雷菌的磷脂酶A1基因下游有一段编码序列,该基因序列的存在也能提高磷脂酶A1在大肠杆菌中的表达活性,并将该基因编码蛋白命名为磷脂酶A1辅助蛋白S(phospholipase A1 accessory protein S,PlaS)。但无论是磷脂酶A1与PlaS共表达,还是PlaS单独表达,都表现出对宿主大肠杆菌生长的抑制作用[11-12]。目前国内外对于PlaS的相关研究鲜有报道。
PlaS能提高磷脂酶A1的表达活性,但抑制宿主菌生长的作用又限制了磷脂酶A1酶活力的进一步提高。所以研究PlaS抑制宿主菌的生长机理具有重要意义。N端截短技术被广泛用于菌株分子改造和蛋白质的结构与功能研究中[13-15]。朱昊等[15]将PlaS的N端区域的前35 个氨基酸截掉之后,发现PlaS对宿主细胞生长的抑制作用消失。同时也有研究表明Sr35蛋白过表达导致了烟草细胞死亡,而Sr35的截短突变体不会触发细胞死亡[16]。因此本研究将从PlaS的N端进行分析,进行N端截短菌株构建。扫描电子显微镜常用于细胞显微观察[17];流式细胞术是一门快速对单个细胞定性定量的技术,可以检测细胞所发生的形态学变化[18],许多学者将其应用到抑菌杀菌实验研究中[19-20]。
本实验通过N端截短来寻找PlaS对宿主菌生长抑制的关键氨基酸序列,同时采用生长曲线检测对截短结果进行验证,并用扫描电子显微镜观察和流式细胞仪检测大肠杆菌,以探究其抑制机理。
1 材料与方法
1.1 菌株、材料与试剂
大肠杆菌BL21(DE3)、质粒pET28a(+)为实验室保存。P28工程菌是将质粒pET28a(+)直接导入大肠杆菌BL21(DE3)中;SP28工程菌是以质粒pET28a(+)为载体,插入plaS基因,导入大肠杆菌BL21(DE3)宿主菌中。
限制性核酸内切酶BamH I、XhoI和T4连接酶美国赛默飞世尔科技公司;卡那霉素(kanamycin,Kan)、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、TaqDNA聚合酶、质粒提取试剂盒、胶回收试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)纯化试剂盒和琼脂糖上海生工生物技术有限公司;其他试剂均购自国药集团化学试剂有限公司;引物合成及DNA测序由南京金斯瑞生物科技有限公司进行。
1.2 仪器与设备
T100 PCR仪 美国Bio-Rad公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司;S4800扫描电子显微镜 日本Hitachi公司;CytoFLEX流式细胞仪 美国贝克曼库尔特公司。
1.3 方法
1.3.1 培养基及反应缓冲液的配制
LB培养基:胰蛋白胨10 g、酵母粉5 g、NaCl 10 g,灭菌水溶解后定容至1 L,调pH值至7.0,高温高压灭菌后4 ℃保存。
Kan溶液:0.5 g Kan溶解与8 mL灭菌水中,定容至10 mL。用0.22 μm有机系滤膜过滤除菌,分装(每份1 mL)后-20 ℃保存。
IPTG溶液:称取1.19 g IPTG溶解于40 mL灭菌水中,定容至50 mL。用0.22 μm有机系滤膜过滤除菌,分装(每份1 mL)后-20 ℃保存。
磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4):称取Na2HPO42.2 g、NaH2PO40.2 g、NaCl 8.5 g,灭菌水定容至1 L。
1.3.2 PlaS氨基酸序列分析
利用生物信息学网站对PlaS进行信号肽(http://www.cbs.dtu.dk/services/SignalP/)、疏水结构(https://web.expasy.org/protscale/)以及跨膜区(http://www.cbs.dtu.dk/services/TMHMM/)在线分析。
1.3.3 PlaS N端截短菌株构建
通过生物信息学网站分析,设计各个截短菌株(dS23P28、dS24P28、dS25P28、dS26P28、dS27P28,以dS23P28为例,即表达PlaS N端截短前23 个氨基酸后的蛋白的菌株,其他菌株以此类推)的上游引物,以及它们共同的下游引物(表1),利用PCR技术,以SP28质粒为模板,对截短辅助蛋白基因进行扩增,反应条件为:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,34 个循环;72 ℃延伸10 min。然后选用XhoI和BamH I为限制性内切酶,分别对胶回收后的扩增产物和pET28a(+)质粒进行双酶切,再用T4连接酶将二者4 ℃过夜连接构成重组质粒,经过化学转导法将质粒导入大肠杆菌BL21(DE3)中,恢复培养后涂布于50 μg/mL Kan筛选平板培养基上37 ℃培养过夜,随后挑取单克隆,接种到含50 μg/mL Kan的LB培养液中培养,然后用培养好的菌液提取质粒,并进行双酶切验证,验证条带准确的菌株送至南京金斯瑞生物科技有限公司测序。

表1 N端截短菌株PCR扩增引物序列Table 1 Primer sequences used for polymerase chain reaction for construction of N-terminal truncated mutants
1.3.4 生长曲线测定
将生长至对数生长期的菌液稀释至OD600nm为0.2,按2%(体积分数)接种量接到100 mL LB+50 μg/mL Kan培养基中培养,待菌液OD600nm为0.6左右时加入终浓度0.1 mmol/L的IPTG进行诱导,整个期间每隔2 h取样一次,用紫外-可见分光光度计测定OD值,以空载菌株P28为对照,培养条件为37 ℃、200 r/min。构建菌株的生长曲线均按照此方法进行测定。
1.3.5 扫描电子显微镜观察
用扫描电子显微镜观察菌株P28、SP28、dS27P28的显微形态,以空载菌株P28为对照。将各个菌株过夜活化后接种于LB+Kan培养基中,37 ℃、200 r/min培养至OD600nm为0.6左右,加入终浓度0.1 mmol/L的IPTG诱导。之后分别取诱导0、4、8、12 h的菌液,用离心法收集菌体沉淀至绿豆大小,用PBS(pH 7.4)洗涤后在4 ℃下与体积分数2.5%的戊二醛混合6 h进行固定。固定后的菌体在PBS中冲洗两次,每次20 min,再用乙醇(体积分数依次为30%、50%、70%、85%、95%、100%)进行梯度脱水,每次20 min。用无水丙酮置换出乙醇后,将细菌沉淀用二氧化碳临界点干燥法干燥,镀金,扫描电子显微镜观察。
1.3.6 细胞膜通透性检测
将菌株过夜活化后接种于LB+Kan培养基中,在37 ℃、200 r/min培养至OD600nm为0.6左右,加入终浓度0.1 mmol/L的IPTG诱导。诱导0、4、8、12 h时取1 mL菌液,4 ℃、4 000 r/min下离心10 min。用PBS(pH 7.4)洗3 次。将碘化丙啶(propidium iodide,PI)染料加入重悬的菌液,4 ℃避光下染色30 min。染色后将菌液过200 目的尼龙筛,放置于流式细胞仪中检测。检测以10 μL/min低速率记录100 000 个细胞,用488 nm激发光检测红色荧光转化的数字信号。
1.3.7 PlaS N端27肽理化性质分析
使用在线程序ExPASyp-ProtParam tool(https://web.expasy.org/protparam/)和Heliquest(http://heliquest.ipmc.cnrs.fr/cgi-bin/ComputParams.py)对PlaS N端27肽的分子质量、等电点、净电荷、疏水性、疏水力矩进行分析。
1.4 数据处理与分析
采用Excel软件进行数据处理,采用Origin软件进行图表绘制。
2 结果与分析
2.1 生物信息学分析PlaS氨基酸序列信息

图1 PlaS氨基酸信息分析Fig.1 Amino acid sequence analysis of PlaS
对PlaS进行信号肽分析发现,该蛋白存在信号肽,为前23 个氨基酸(图1A)。有研究表明,在原核表达过程中,外源信号肽的存在会影响蛋白质的正常表达[21-23],如郭磊周等[24]研究发现耐辐射异常球菌疏水性LEA5C家族蛋白(DrwH)含有信号肽序列,DrwH蛋白过量表达抑制了大肠杆菌的生长。通过跨膜区及蛋白疏水性在线分析,发现蛋白前7~26 个氨基酸为典型的跨膜区域(图1B),第10~27个氨基酸为疏水区(图1C),有研究表明截去蛋白疏水区可高效稳定表达外源蛋白[25-26]。综上,推测PlaS前23~27 个氨基酸有可能与PlaS在大肠杆菌中的表达特性及其对大肠杆菌生长抑制现象有关。
2.2 PlaS N端截短菌株构建结果
对1.3.3节构建的菌株进行测序,测序结果和plaS全长基因进行比对,发现dS23P28、dS24P28、dS25P28、dS26P28、dS27P28都缺少了它们各自需要截短的氨基酸,且未截短部位突变少,相似度高,这表明PlaS N端截短菌株构建成功。图2为PlaS N端截短菌株的N端序列比对结果,使用DNAMAN软件进行比对。

图2 PlaS N端截短菌株测序比对Fig.2 Sequence comparison of PlaS N-terminal truncated strains
2.3 不同PlaS N端截短突变株异源表达生长特性变化

图3 PlaS N端截短菌株生长曲线Fig.3 Growth curves of PlaS N-terminal truncated strains
以菌株SP28和构建成功的N端截短系列菌株进行了生长曲线测定,结果如图3所示。在未加诱导剂IPTG时菌株生长状况一致,在加入IPTG诱导蛋白表达后dS27P28菌株生长情况良好,一直呈现指数增长状态,而表达PlaS的菌株SP28呈现相反情况,生长最慢,其他截短菌株在蛋白诱导表达后均出现不同程度的生长抑制,由此可推测前27 个氨基酸的存在对其表达宿主大肠杆菌的生长有抑制作用。
2.4 PlaS N端截短对大肠杆菌形貌的影响
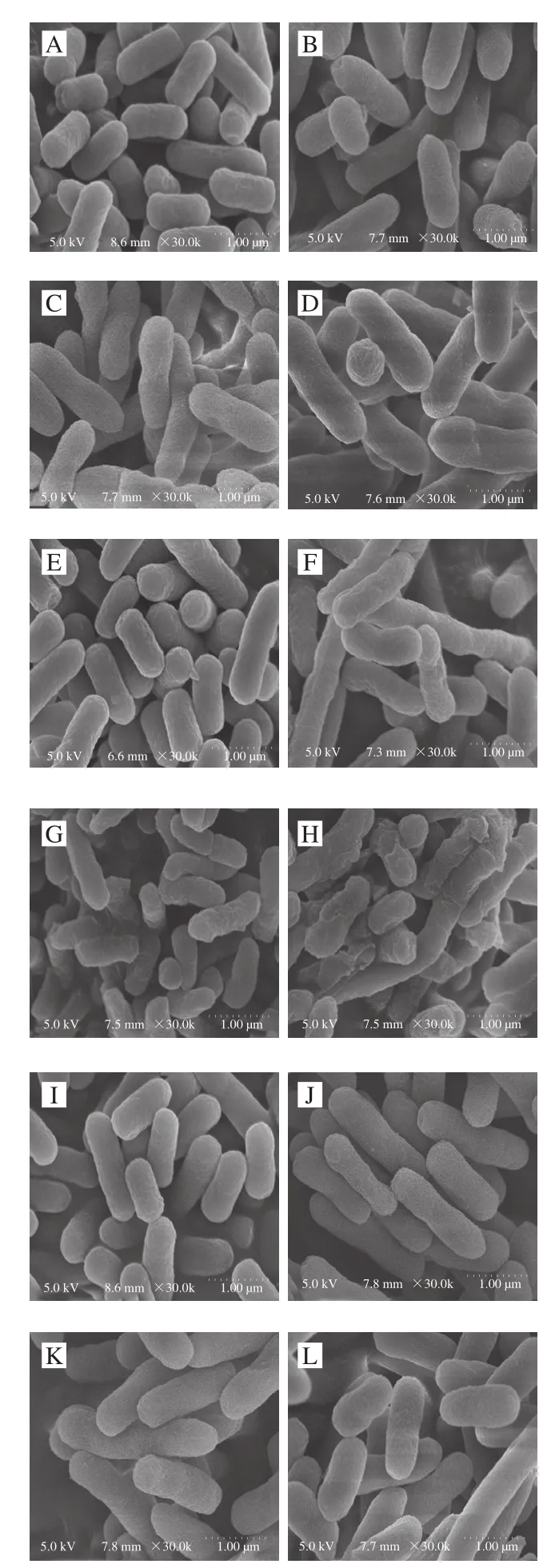
图4 PlaS表达菌株扫描电子显微镜图Fig.4 SEM images of PlaS expression strains
细菌细胞膜的破坏能导致细菌死亡。为了探讨PlaS是否通过破坏细胞膜来抑制大肠杆菌的生长,采用扫描电子显微镜对细胞膜进行了观察。如图4所示,在细胞生长过程中,对照组P28菌株有完整、光滑、规则的形态结构(图4A~D)。相反,表达PlaS的菌株SP28随时间变化的最显著特征是细菌变形、破损。在4 h出现了褶皱、干枯(图4F),在8 h出现部分细胞破损、压缩(图4G),在12 h出现细胞大量破损,细胞形态变得不完整(图4H)。而表达截短N端27 个氨基酸的PlaS菌株dS27P28又恢复了完整、光滑、有规则的形态结构,且随时间延长未出现破损情况(图4J~L)。这些现象说明PlaS对大肠杆菌细胞膜具有严重的损伤作用,也进一步说明了PlaS N端前27 个氨基酸的存在对其表达宿主大肠杆菌的生长有抑制作用。
2.5 PlaS N端截短对大肠杆菌细胞通透性影响
为了进一步探究PlaS对大肠杆菌细胞膜的破坏情况,采用流式细胞技术进行了定量分析。荧光染料PI能够进入细胞膜损伤的细胞与核酸结合,而有完整细胞膜的细胞则不会被染色。用PI染料分别对诱导0、4、8 h的SP28和dS27P28菌株染色,并进行流式细胞仪检测。结果可以看出,随着时间推移,SP28菌株细胞膜损伤的细胞比例在0 h时为9.54%(图5A),4 h时为48.72%(图5B),8 h时达到了66.92%(图5C);相比之下,如图5D~F所示,dS27P28菌株细胞膜损伤率增长则慢的多,8 h时为13.69%。这说明了PlaS对细胞膜有损伤影响,而PlaS的N端截短27 个氨基酸后则损伤现象消失,与扫描电子显微镜观察结果一致。
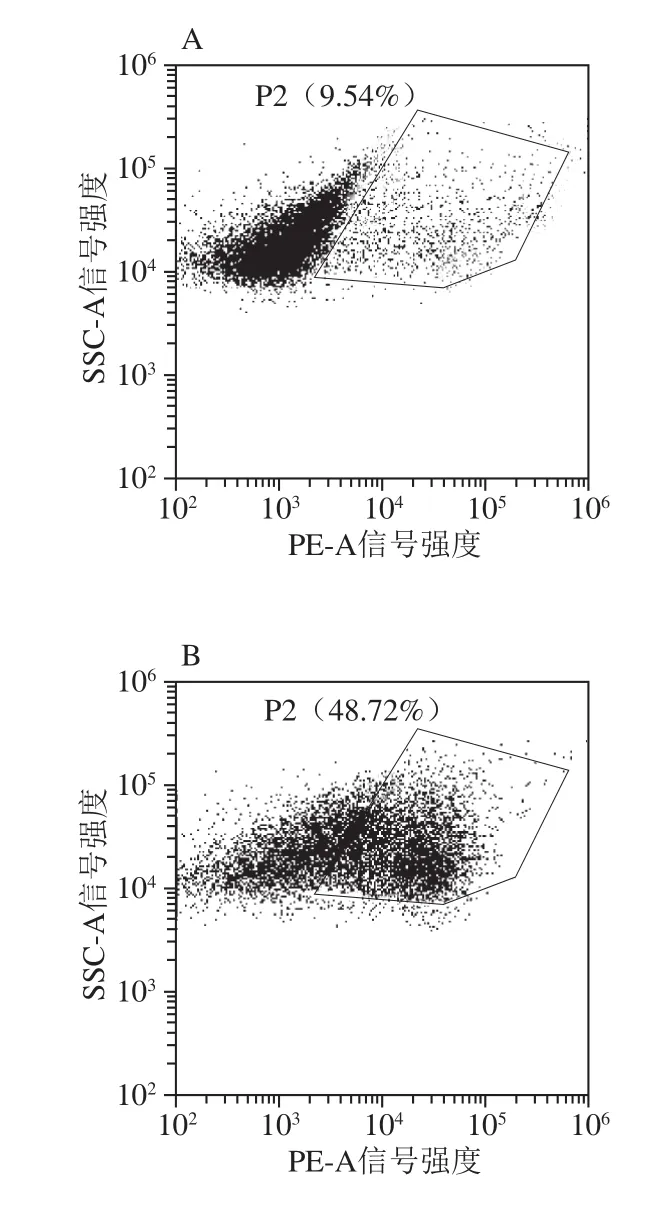
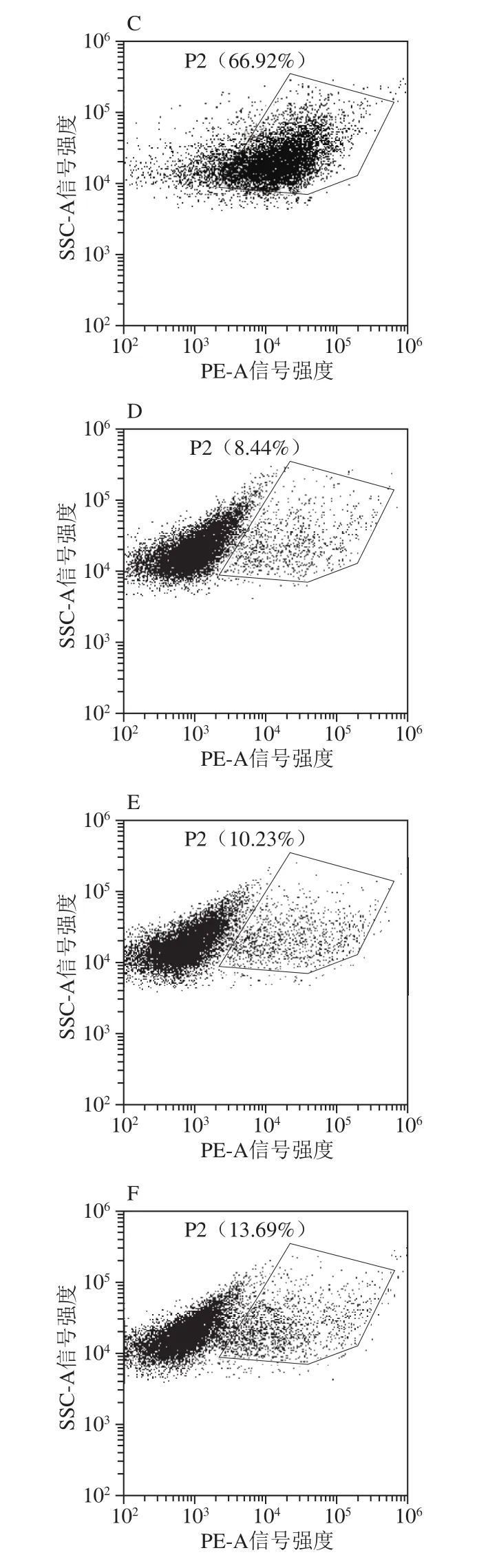
图5 流式细胞仪检测的细胞膜完整性Fig.5 Detection of cell membrane integrity by FCM
2.6 PlaS N端27肽的理化性质分析结果
PlaS N端27肽序列为MPEGRRLRRA LAIALLALAAVTGLLMM。ExPASyp-ProtParam tool软件显示该蛋白质序列分子式为C128H231N39O31S3、分子质量为2 908.66 Da、等电点为12。Heliquest软件分析得到该肽净电荷为+3、疏水性值为0.621 11、疏水力矩为0.147 12、疏水面为ALLLL,螺旋投影图由Heliquest软件得到(图6)。根据软件分析结果,PlaS N端27肽为带阳离子正电荷的疏水性肽。Lin Yanlan等[27]通过设计分析一组新型阳离子抗菌肽,以进一步了解抗菌肽与细胞膜的脂质的相互作用,结果发现疏水性强的抗菌肽与细胞膜亲和性强;Hollmann等[28]选择了两种多肽——P5和P6.2进行进一步研究,发现它们对铜绿假单胞菌和金黄色葡萄球菌具有杀伤活性,同时破坏了两株菌的细胞膜的完整性。因此PlaS对大肠杆菌的抑制作用可能是N端前27 个氨基酸阳离子的疏水性导致的。这27 个氨基酸组成肽的具体功能后续将做进一步的研究。

图6 PlaS N端27肽螺旋投影图Fig.6 Spiral projection of first 27 N-terminal amino acids of PlaS
3 讨 论
本究结果显示PlaS在大肠杆菌体内表达后对其生长有较强的抑制作用,同时通过N端截短技术发现其抑制作用关键区域为PlaS N端前27 个氨基酸,且通过生长曲线测定、扫描电子显微镜观察和流式细胞仪检测细胞膜通透性实验验证了这一结论。
扫描电子显微镜观察到PlaS表达菌株在4 h出现了褶皱、干枯,在8 h时出现部分细胞破损、压缩,在12 h时相比出现大量破损,结构变得不完整。这初步揭示了PlaS主要通过破坏大肠杆菌细胞形态的完整性抑制其生长。很多学者研究表明细胞膜的完整性对于细菌生长至关重要,细胞损伤直接抑制了细菌的生长[29-32],而一般细胞破损会引起离子(K+、Na+、Ca2+)的泄漏[33],这会影响细胞正常的生命活动,其存活所需的各种生物酶也将不会被合成。流式细胞仪数据显示在SP28菌株诱导表达8 h时细胞膜损伤率达到66.92%,也进一步验证了PlaS对大肠杆菌细胞膜有损伤作用。
对PlaS N端前27 个氨基酸组成的多肽进行了理化分析,结果显示其为阳离子疏水性多肽。微生物膜通常呈现阴离子表面,富含脂质(如磷脂酰甘油),而阳离子与疏水性非常适合与微生物膜作用[34-35]。根据这个特点此27肽有望开发成新型抗菌肽。
PlaS对其表达宿主大肠杆菌生长抑制及细胞损伤的分子机理还有待后续深入研究,可通过转录组和蛋白组学技术比较SP28菌株和PlaS N端截短菌株之间与细胞膜合成有关基因(如oppA、ompA、lpxT、plsB等[36]及与细胞壁合成有关基因Pal、MtgA、NagA等[37])的转录和表达水平。

