水稻全基因组磷脂酶家族蛋白筛选及其生物信息学分析
曹梦雨,桑世飞,王亚男,周静,王君怡,张文玲,姬生栋
(1.河南师范大学 生命科学学院,河南 新乡 453007;2.河南省种子管理站,郑州450046)
磷脂酶是植物磷脂信号网络的重要成分,目前植物中已经鉴定出4种形式的磷脂酶[1],参与调控植物体内的多种生理过程,并对各种生物与非生物胁迫作出相应的响应.磷脂酶家族基因(OsPLX)可从多个途径参与非生物胁迫信号和发育事件[2],如大豆磷脂酶C基因GmPLC10具有耐干旱的作用,能帮助植物有效抵御干旱胁迫[3],拟南芥磷脂酶C2参与拟南芥的细胞凋亡及丁香假单胞菌(Pseudomonassyringae)病原体的攻击[4],拟南芥磷脂酶D1和磷脂酶D2则与植物响应盐碱胁迫相关[5].在拟南芥磷脂酶基因家族的研究中,诸多研究都提出了磷脂酶参与许多信号网络和调控细胞的过程,如应激信号和耐受性[6],显然作为磷脂酶家族相关基因,在水稻中很可能也参与这些代谢调控.
水稻磷脂酶A家族的OspPLAIIβ基因编码花粉特异性磷脂酶,其突变体具备诱导水稻形成单倍体的功能[7].过表达OspPLAIIIα基因会导致水稻表现出半矮化,同时引起茎、根、叶、种子以及穗的长度降低,机械强度下降,还会导致组织中的纤维素含量降低,影响到了植株发育,而OspPLAIIIα基因敲除系却具有更长的穗和籽粒[8].OspPLAIIIδ是直立型密穗基因,与野生型相比,OspPLAIIIδ基因突变系的穗从生长到成熟一直能够保持直立,穗粒形状大小及穗长都发生了变化[9].磷脂酶C家族中的OsNPC1基因具有组成型表达的特征,与野生型相比,水稻中过表达OsNPC1基因会使植株表现出茎节较脆,茎节中硅含量降低,但颖壳中硅含量增加,穗茎尖较脆,落粒性增加的特征[10].磷脂酶D亚家族的OsPLDα4和OsPLDα5基因均受二化螟、机械损伤和JA处理的诱导表达[11].抑制OsPLDβ1表达的植株在发育后期表现出类似超敏反应的细胞死亡以及植物抗毒素的积累,在没有病原菌侵染的情况下可自发激活防御反应,并且OsPLDβ1通过负调节防御反应来参与水稻的抗病性[12].OsPLDα基因在植物响应盐胁迫过程中通过调节H+-ATPase的活性和表达来影响水稻对盐的耐受性[13].目前磷脂酶A亚家族更倾向参与到植物的生长发育,而磷脂酶D亚家族在逆境胁迫方面扮演了重要角色.然而拟南芥磷脂酶A IIA则参与到生物与非生物胁迫[14],表明磷脂酶基因家族基因的功能在进化中可能出现了一定分化.以往关于磷脂酶家族基因的研究工作多集中在模式植物拟南芥和其他一些双子叶植物中,对单子叶植物中磷脂酶基因的报道较少,借助同源比对方法对水稻磷脂酶家族基因进行生物信息学分析,为深入研究水稻磷脂酶家族基因功能提供参考.
1 材料和方法
1.1 水稻磷脂酶家族基因鉴定及理化性质分析
从RiceData数据库搜索并下载磷脂酶家族基因的编码区序列.在RGAP水稻数据库将已下载的磷脂酶家族核苷酸序列采用同源搜索的方法,BLAST水稻蛋白质模型数据库,筛选标准为相似度大于40%,覆盖度大于40%,搜索的E值设为10-5,获得水稻磷脂酶家族基因及同源基因.利用ExPASy-ProtParam tool获得磷脂酶家族基因的分子量、等电点和氨基酸数目.通过TMHMM在线分析蛋白质序列的跨膜区[15].利用ProtComp v.9.0软件对磷脂酶家族蛋白进行亚细胞定位分析[16].
1.2 水稻磷脂酶家族基因生物信息学分析
基因进化及基序分析采用MEGA-X软件中的Clustal W对磷脂酶家族的蛋白质序列进行比对,采用极大似然法将比对后的序列构建系统发育树,bootstrap参数设置为1 000[17].通过MEME在线分析磷脂酶家族蛋白质序列的基序种类与特征[18].通过Ensembl Plants 网站获得水稻12条染色体的长度数据,在RiceData网站搜索获得磷脂酶家族基因的起始位点,最后使用MapChart 2.32绘制磷脂酶家族基因在染色体上的定位图[19].利用Rice eFP Browser网站(http://bar.utoronto.ca/efprice/cgi-bin/efpWeb.cgi)公布的水稻(亚种.indica var IR64)材料的转录组数据,调取穗和种子发育过程中不同阶段的磷脂酶家族基因的表达量数据,进行标准化的处理,采用Heml软件得到磷脂酶家族基因的组织表达谱热图[20].
2 结果和分析
2.1 OsPLX家族基因全基因组筛选与理化性质分析
从RiceData网站搜索并下载磷脂酶家族的基因登录号、基因名称以及CDS序列,并根据水稻已知的OsPLX蛋白序列,在RGAP水稻数据库检索所有水稻中的直系同源基因,共计获得了64个OsPLX基因家族成员(表1).理化性质分析发现OsPLX家族基因长度为402~3 801 bp,编码氨基酸序列为133~1 266个,蛋白质分子质量大约在14.09~134.36 kDa之间,蛋白质等电点在4.977~12.12之间(表1).
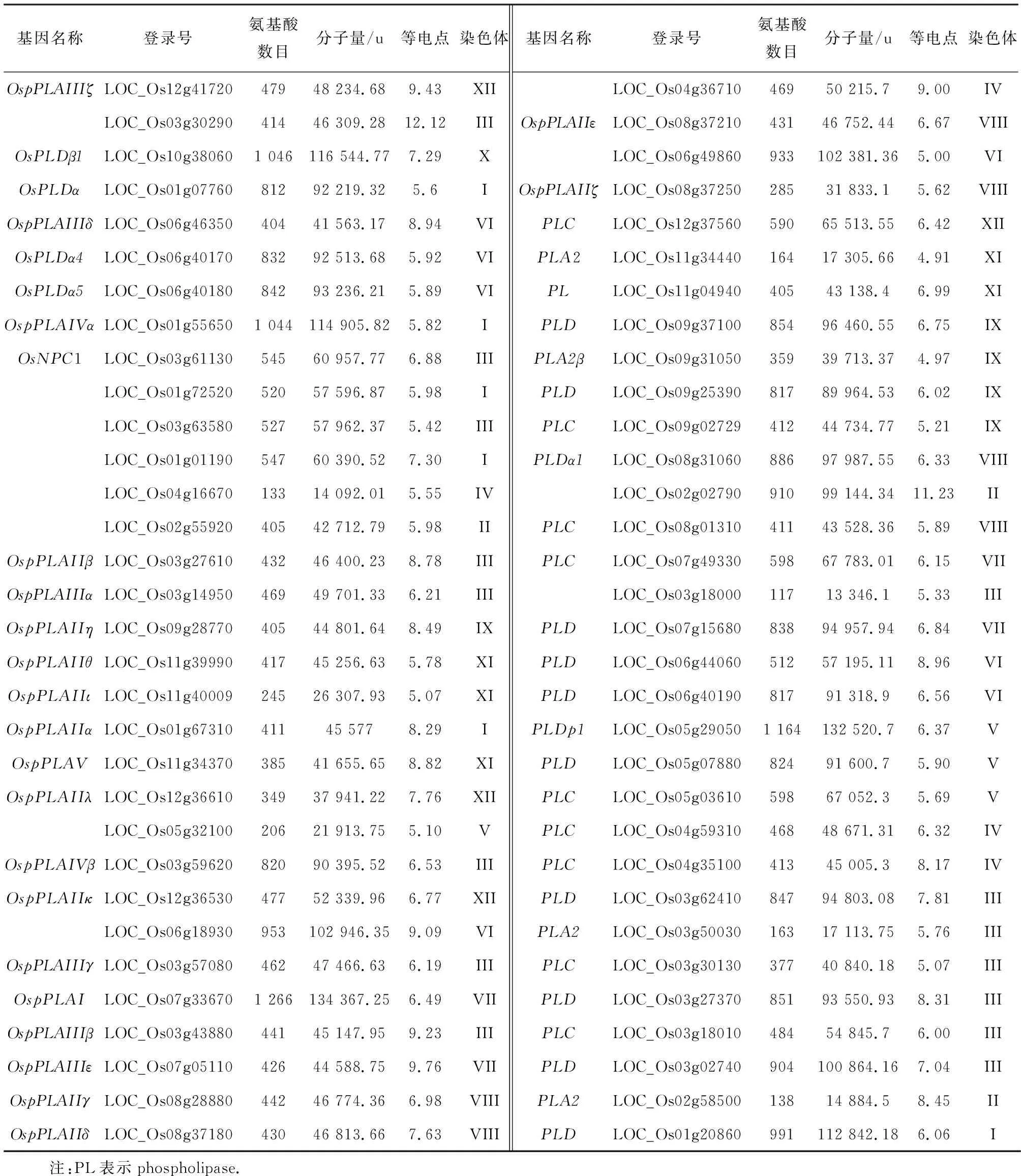
表1 64个磷脂酶家族基因的理化信息
将上述初步筛选出的 64个蛋白序列进一步用 ProtComp v9.0 软件进行分析,共预测到37个信号肽分泌至胞外,3个转运至液泡膜,2个转运到了叶绿体膜,1个转运至高尔基体膜,12个转运至细胞质,9个转运至细胞质膜.通过TMHMM在线网站对磷脂酶家族蛋白的跨膜序列区分析发现,水稻中已经鉴定出的64个磷脂酶基因中只有8个基因所编码的蛋白质含有跨膜区. LOC_Os08g01310、LOC_Os06g49860、LOC_Os04g36710、LOC_Os03g50030、LOC_Os04g35100和LOC_Os04g59310等6个基因编码的蛋白中各含有1个跨膜区;基因LOC_Os03g50030所编码蛋白中的跨膜区较大;基因LOC_Os06g18930 编码的蛋白中含有18个较小的跨膜区;基因LOC_Os01g67310所编码蛋白含有3个跨膜区.
利用MEME在线网站分析磷脂酶家族蛋白序列的基序种类与特征,发现所有的蛋白质都含有相同的3个保守基序:基序1为氨基酸序列IYIENQYF;基序2为氨基酸序列IYIENQYF;基序3为氨基酸序列AAWDVLYNFEQRWRKQ.且亲缘关系越近的磷脂酶家族基因,其编码的蛋白基序结构相似度越高.
2.2 水稻磷脂酶家族基因染色体定位分析
利用MapChart 2.32对已鉴定的OsPLX家族基因进行染色体定位,分析发现家族基因在染色体的分析呈现出明显的不均匀分布,不同染色体上的该家族基因的数目差别很大,如10号染色体含有一个磷脂酶基因;2号染色体上有3个磷脂酶基因;4号、5号、7号和12号染色体上有4个磷脂酶基因;9号和11号染色体上有5个磷脂酶基因;1号染色体上有6个磷脂酶基因; 3号染色体上有15个磷脂酶基因,各染色体上的磷脂酶家族基因表现出了明显的不均衡性.
2.3 水稻磷脂酶家族基因OsPLX进化分析
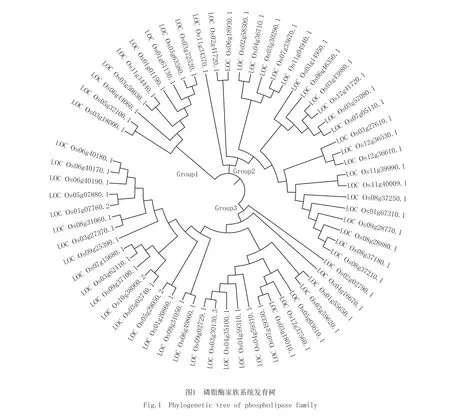
根据磷脂酶家族基因OsPLX编码的蛋白质序列,采用Mega X进行多序列比对并构建系统发育树(图1).从图1的系统发育树可知,家族基因编码蛋白质被分为3个亚组(group),即亚组I(group1)、亚组II(group2)和亚组III(group3),其中亚组I包含9个磷脂酶基因,包含了2个已经鉴定功能的磷脂酶OsPLA2类基因;亚组II包含25个磷脂酶基因,主要是OsPLA家族;亚组III包含29个磷脂酶基因,主要是OsPLC和OsPLD亚家族基因.
2.4 水稻磷脂酶家族组织特异性表达分析
对水稻中磷脂酶家族基因OsPLX在穗和种子发育过程中的全基因组分析、分类、时空基因表达及光和非生物胁迫的调控等相关数据进行处理,利用Heml软件绘制磷脂酶家族的组织表达谱热图.结果表明(图2),磷脂酶家族基因并没有表现出明显的组织特异性,然而从整体来看,大多数的磷脂酶家族基因在各个组织的表达量都比较低,其中LOC_Os01g07760(OsPLDα),LOC_Os03g59620(OspPLAIVβ),LOC_Os03g61130(OsNPC1),LOC_Os07g49330,LOC_Os12g37560在水稻的生长发育过程中都维持相对较高的表达量;还有部分基因表现出了比较强的组织偏好性,比如LOC_Os06g40180(OsPLDα5)在根以及叶子花序中表达量较高;LOC_Os09g28770(OspPLAIIη)则在种子中的表达量非常的高;LOC_Os12g36610(OspPLAIIγ)和LOC_Os03g43880(OspPLAIIIβ)都只在幼根中高表达;LOC_Os12g36530(OspPLAIIk)则在花序中集中高表达.这些结果表明,磷脂酶家族基因在水稻生长发育中扮演了重要角色.

3 讨 论
相对于NAC,WRKY,ARF,GH3等家族基因[21-23],磷脂酶基因家族研究相对较少,越来越多的证据表明,植物细胞含有多种基于磷脂的信号通路,参与植物的生长发育与胁迫响应[24-25].在水稻磷脂酶A亚家族的研究中,SINGH等[2]通过对水稻全基因组鉴定,分析了磷脂酶A家族基因,发现水稻PLA家族基因在非生物胁迫信号传递和发育中可能具有重要作用.磷脂酶C亚家族的多个基因在干旱或者盐胁迫条件下会得到诱导性表达[26],研究表明在干旱条件下,植物会通过表达PLC基因来控制气孔的开闭[27].在拟南芥研究中磷脂酶D被认为是抗性响应基因,在水稻中通过对2个定位于叶绿体的基因OsPLDa4和OsPLDa5研究发现,在受到二化螟的摄食、机械伤害以及茉莉酸(JA)处理时会诱导基因上调表达[28].YAO等[7]发现在水稻中OspPLAIIβ(OsMTL)基因编码的花粉特异性磷脂酶能诱导水稻形成单倍体 ,关于该家族基因生物学功能的研究相对较少,综合当前研究认为磷脂酶家族基因在参与逆境胁迫、抗病方面扮演了重要角色,这一点基本达成共识.但是家族基因是否会像OspPLAIIβ具有新的功能,是今后值得研究的问题.
本研究中的不同磷脂酶亚细胞定位预测表明,不同磷脂酶基因定位有所区别,说明磷脂酶基因在进化中出现了功能性分化.比如OspPLAIIβ基因能够编码花粉特异性磷脂酶,与玉米的ZmMATL基因同源,能诱导水稻形成单倍体[7].OsPLDβ1基因在植物响应生物和非生物胁迫的过程中发挥重要作用,抑制OsPLDβ1表达提高植株对水稻主要病原菌的抗性[12],OsPLDα基因在植物响应胁迫中发挥正调控作用[11].磷脂酶家族基因间呈现出比较明显的功能分化,OsPLD和OsPLC家族基因表现出了抗逆功能,而OsPLA基因的克隆数量偏少,A亚家族基因是否如OspPLAIIβ一般具有单倍体诱导功能还有待进一步的研究.本研究也发现,大多数磷脂酶家族基因组织特异性非常弱,基因在根、叶、花序、种子中属于低表达,仅少部分基因在特定组织或者发育时期表现出较高的基因表达量,这些磷脂酶家族基因或许具备组织特异性功能.其中少数几个在生长发育各个阶段高表达的基因,如LOC_Os01g07760(OsPLDα),LOC_Os03g59620(OspPLAIVβ),LOC_Os03g61130(OsNPC1),LOC_Os07g49330,LOC_Os12g37560在维持水稻生长过程中可能具有重要作用.
综合本研究结果,可对部分已经克隆基因的同源基因功能以及组织特异性高表达基因的功能做出初步的推测,为进一步分析研究水稻磷脂酶家族基因在水稻发育过程中的生物学功能提供参考.

