武汉市湖泊浮游动物群落特征及其影响因素
宋高飞,朱宇轩,2,米武娟,Anila P. Ajayan,毕永红
(1.中国科学院 淡水生态与生物技术国家重点实验室;水生生物研究所,武汉 430072;2.中国科学院大学,北京 100049)
武汉市在新冠肺炎疫情期间对居民社区、公共环境及饮用水采取或加强了消毒措施[1].据相关资料,截至2020年2月18日,全市累计投放消毒剂1 963.58 t,其中,以含氯消毒剂为主.全市26座污水处理厂均采用次氯酸钠24 h连续消毒,累计强化消毒剂用量共计1 777.36 t,污泥消毒剂用量共计33.69 t[2-3].大量消毒剂的使用在防控疫情传播方面发挥了重要作用,但水体是消毒剂的重要受纳场所和最终归趋,含氯消毒剂会与水中的多种有机与无机物成分反应,生成毒性强、危害生物健康的消毒副产物(disinfection by-products,DBPs)[4].同时,由于次氯酸具有很强的氧化性,水体环境中原有的氧化还原平衡可能被打破,氮、磷、有机物等降解和归趋途径相应地被改变[5].而氮、磷等营养盐含量及水体营养状态是影响水体浮游生物群落和湖泊生态系统结构功能的主要因子[4-7].浮游动物在湖泊生态系统食物网中占据着重要的基础生态位.一方面是鱼类等上层营养级的食物来源,另一方面又制约着初级生产者浮游植物及其他微生物的种群组成及丰度变化.浮游动物的群落组成、种类丰富度、个体密度、优势种等群落结构特征与水体环境状况密切相关,对水体生态系统中的理化因子和生物因子的变化具有直接且敏感的反应[6,12-13].
消毒剂的大量使用对武汉市湖泊水生生物和水生态系统是否存在影响以及具体影响效应是一个迫切需要回答的问题,为此,本研究以浮游动物为切入点,在野外原位调查的基础上运用多元统计分析大量消毒剂的使用对湖泊浮游动物群落的影响,浮游动物与环境因子的相关关系,探究常规理化因子与消毒副产物对浮游动物的影响权重,为认识消毒剂使用的生态环境效应提供理论依据.
1 材料与方法
1.1 研究区域概况
2020年4月27日至30日在武汉市共进行了11个湖泊的样品采集,分别为东湖(East Lake,DH)(DHS1 30°32′46.07″ N,114°21′55.62″ E;DHS2 30°32′4.27″ N,114°22′18.70″ E;DHS3 30°32′17.20″ N,114°22′21.83″ E;DHS4 30°33′50.08″ N, 114°20′50.08″ E),南湖(South Lake,NH)(NHS1 30°28′33.86″ N,114°22′0.25″ E;NHS2 30°29′9.91″ N,,114°22′43.43016″ E;NHS3 30°29′36.50″ N,114°21′47.01″ E;NHS4 30°29′33.93″ N,114°21′6.69″ E;NHS5 30°29′16.29″ N,114°20′44.38″ E;NHS6 30°29′51.19″ N,114°20′19.03″ E;NHS7 30°30′6.55″ N,114°20′54.32″ E),北湖(North Lake,BH)(BHS1 30°35′59.25″ N,114°30′52.92″ E;BHS2 30°36′9.62″ N,114°30′47.61″ E;BHS3 30°36′17.16″ N,114°30′51.77″ E;BHS4 30°36′50.09″ N,114°30′43.87″ E;BHS5 30°37′13.51″ N,114°30′16.63″ E),墨水湖(Moshui Lake,MSH)(MSHS1 30°32′35.07″ N,114°12′25.33″ E;MSHS2 30°32′57.57″ N,114°12′45.11″ E;MSHS3 30°32′38.36″ N, 114°13′0.16″ E;MSHS4 30°32′41.23″ N,114°13′35.46″ E;MSHS5 30°32′52.12″ N,114°13′27.77″ E;MSHS6 30°32′16.10″ N,114°13′56.26″ E),西北湖(Northwest Lake,XBH)(XBHS1 30°36′2.13″N,114°15′46.19″ E;XBHS2 30°35′59.95″ N,114°15′44.30″ E;XBHS3 30°35′54.85″ N,114°15′54.85″ E),沙湖(Sha Lake,SH)(SHS1 30°34′21.26″ N, 114°20′33.68″ E;SHS2 30°34′21.22″ N,114°20′32.91″ E;SHS3 30°34′25.93 ″N,114°20′2.51″ E),月湖(Yue Lake,YH)(YHS1 30°33′26.82″ N,114°15′27.756″ E;YHS2 30°33′26.78″ N,114°15′27.58″ E;YHS3 30°33′24.34″ N,114.26 E),莲花湖(Lianhua Lake,LHH)(LHHS1 30°33′11.56″ N,114°16′21.14″ E;LHHS2 30°33′13.86″ N, 114°16′16.22″ E;LHHS3 30°33′8.30″ N,114°16′27.40″ E),鲩子湖(Huanzi Lake,HZH)(HZHS1 30°35′55.82″ N,114°16′38.53″ E;HZHS2 30°35′54.48″ N,114°16′47.62″ E;HZHS3 30°35′53.81″ N,114°16′47.39″ E),梁子湖(Liangzi Lake,LZH)(LZHS1 30°14′44.42″ N,114°27′1.69″ E;LZHS2 30°14′22.21″ N,114°27′23.74″ E;LZHS3 30°14′40.2″ N,114°27′1.66″ E),沉湖(Chen Lake,CH)(CHS1 30°19′13.35″ N,113°49′4.16″ E;CHS2 30°18′54.24″ N,113°49′0.75″ E;CHS3 30°18′45.85″ N,113°49′12.45″ E).
1.2 水样采集与分析

采用气相色谱-三重四联质谱(GC/MS-TQ8050,Shimadzu,Japan)对17种卤代脂肪族DBPs进行分析,包括6种三卤甲烷(THMs)、2种卤代酮(HKs)、9种亚硝胺类物质(NAs).采用高效液相色谱-三重四联质谱(HPLC/MS-TQ8060,Shimadzu,Japan)对21种哈斯芳香族卤化DBPs分析,包括9种卤乙酸(HAAs),12种芳香卤化物(Armotics).具体方法详见文献[15].
1.3 浮游动物样品采集与分析
现场用13#浮游生物网采集浮游动物定性样品,4%甲醛溶液固定.采集1 L水样用于原生动物和轮虫的鉴定与定量计数,水样用鲁哥氏液进行固定保存.用25#浮游生物网过滤20 L表层湖水,滤取物放入样品瓶中,用甲醛溶液固定,为甲壳类(枝角类和桡足类)定量样品.浮游动物定性及定量样品用显微镜(Olympus CX21,Japan)鉴定并计数,鉴定依据《水生生物学》《中国淡水轮虫志》《微型生物监测新技术》《中国动物志节肢动物门甲壳纲淡水枝角类》[16-20].
1.4 数据分析与统计
1.4.1多样性指数计算
采用物种丰富度,Shannon-Wiener多样性指数(H′)、物种均匀性指数(J)对浮游动物群落多样性进行分析评价,通过优势种优势度(Y)确定样本优势种群.利用Past version 2.17[21]计算各样本物种的多样性指数[12].生物优势度Y≥0.02即为优势种[22].
1.4.2统计分析方法
在进行统计学分析前,除pH外其他环境因子及物种矩阵均经过lg(x+1)转换及标准化.在进行环境因子与物种的相关系分析时,所有因子都进行了共线性检测.利用主坐标分析(PCoA)对物种组成进行聚类;利用相似性分析(ANOSIM)对不同类群浮游动物群落结构进行差异显著性检验;利用方差分解(VPA)来划分外界因子对浮游动物群落结构变化的解释比例;利用Mantel test分析了不同类型物种组成与环境因子的相关性.所有统计分析和作图均在R软件包(version 4.0.4,https://mirrors.tuna.tsinghua.edu.cn/CRAN/)环境下完成,用到的程序包有Vegan,reshape2,ggplot2,Rmisc,ggcor,corrplot.
2 结 果
2.1 水环境状况
各湖泊常规理化因子及DBPs情况见表1,TN含量最高点出现在北湖(5.484 mg/L),最低点出现在月湖(0.301 mg/L);TP含量最高点出现在沉湖(0.797 mg/L),最低点出现在鲩子湖(0.030 mg/L);各湖泊常规理化因子含量差别较大,Oneway ANOVA结果显示11个湖泊间理化因子间的差异极其显著(P<0.01).

表1 武汉各湖泊常规理化因子及DBPs状况
所测的5类DBPs中,THMs含量最高点出现在北湖(4.366 μg/L),沉湖未检出;HAAs含量最高点出现在南湖(14.533 μg/L),最低点出现在墨水湖(3.070 μg/L);HKs含量最高点出现在莲花湖的S1位点(0.14 μg/L),其他采样点均未检出;NAs含量最高点出现在北湖(0.024 ng/L)为,莲花湖和南湖未检出;Aarmotics含量最高点出现在南湖(0.054 ng/L),最低点出现在沙湖(0.002 ng/L);Oneway ANOVA结果显示THMs,HAAs,NAs含量在11个湖泊间差异显著(P<0.01),而HKs,Aarmotics含量在11个湖泊间分布差异不显著(P>0.05).
2.2 群落组成
共鉴定浮游动物133种,其中原生动物32属种,占总种数的24.06%;轮虫58属种,占总种数的43.61%;枝角类28属种,占总种数的21.05%;桡足类15属种,占总种数的11.28%.不同采样位点的密度为20.90 ind./L~23 108.50 ind./L,其中梁子湖的密度最低,墨水湖最高.图1展示各湖泊样点浮游动物的群落组成,不同采样点4大类浮游动物相对丰度差异显著(P<0.05).

基于Bray-Curtis距离对所有采样位点浮游动物群落组成数据进行PCoA分析,共聚为4大类群(图2).LHH,LZH,HZH聚为A类群,DH,XBH,YH,NH,BH,SH聚为B类群, CH聚为C类群,MSH聚为D类群.前2轴分别解释了27.86%和14.82%的群落组成变化.ANOSIM结果表明,4个类群的浮游动物组成具有显著差异(P=0.001).

不同类群浮游动物群落特征各异(表2,表3).A类群以甲壳纲为主(55.13%),其组成远高于其他3个类群湖泊,其中无节幼体优势度最高(0.30);B类群以原生动物和轮虫占主要优势;C,D类群均以长肢多肢轮虫Polyarthradolichoptera为主,优势度分别为0.50和0.23.
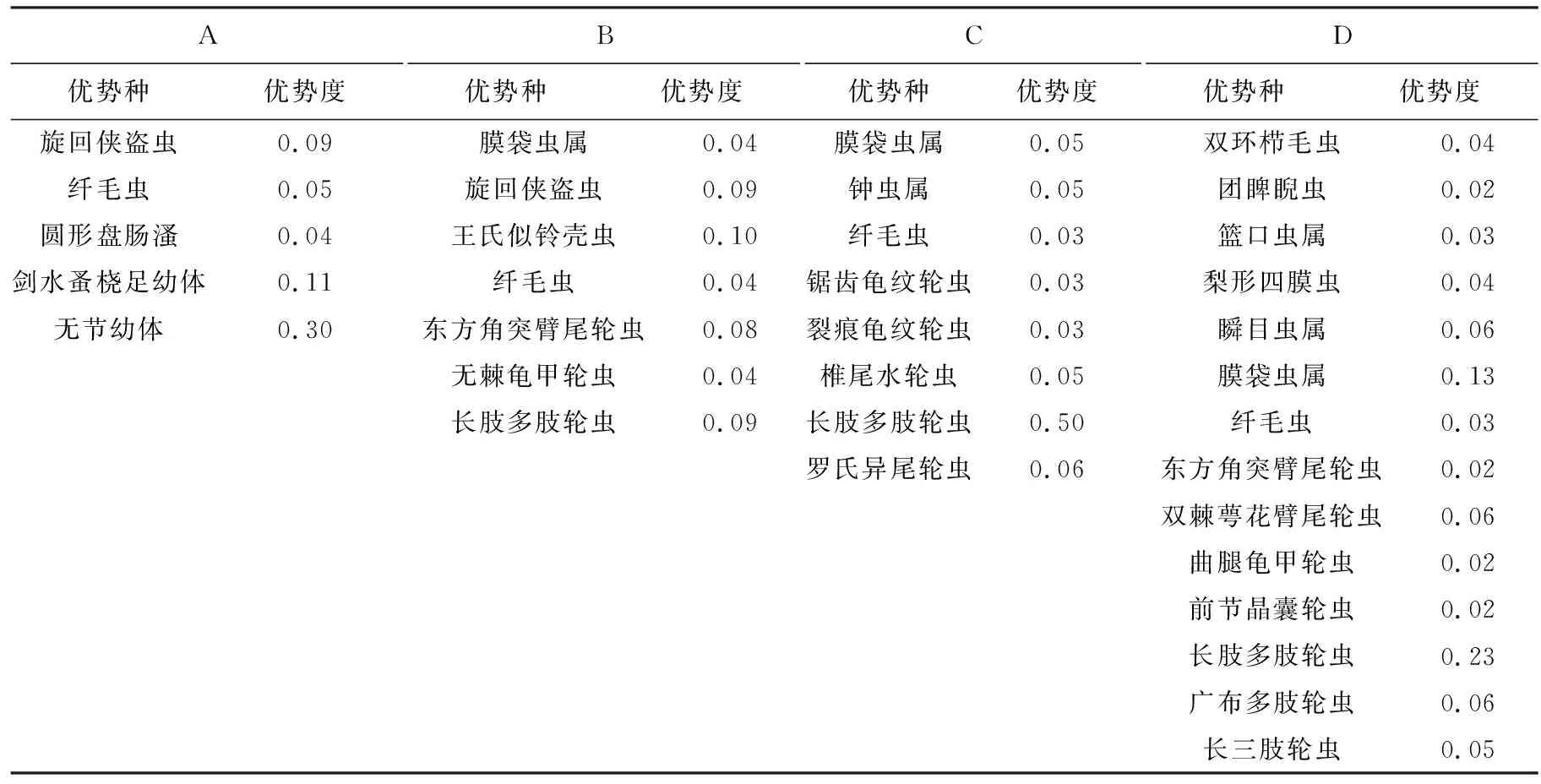
表2 不同类群优势种与优势度

表3 不同类群浮游动物群落特征
2.3 浮游动物与环境因子的关系

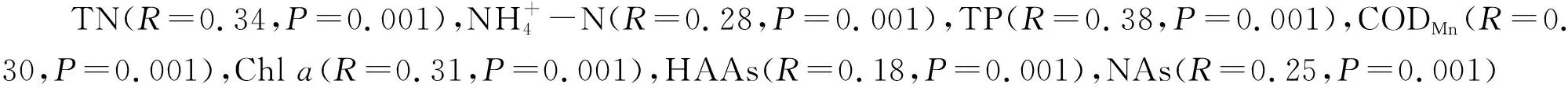

3 讨 论
3.1 浮游动物群落结构
基于浮游动物群落组成对武汉11个湖泊所有采样点的群落进行聚类分析,共划分为4种群落类型.A类群湖泊甲壳纲物种含量较为丰富,B,C,D 3个类群甲壳纲物种丰度急剧下降.这可能是因为甲壳纲动物喜生活在较清洁的水体,当水体污染加剧时,其多样性及丰度会急剧降低,因此常作为水体污染的指示生物.相反,随着富营养化的加剧,原生动物和轮虫的种类、丰度也随水体富营养化程度的加剧而增加[16,23-24].而本研究中B类群以原生动物和轮虫占主要优势,C和D类群以寡营养/β-中污型物种长肢多肢轮虫Polyarthradolichoptera为主要优势种,说明4个类群浮游动物的群落组成与水体营养水平显著相关.
3.2 浮游动物群落与环境因子的关系
浮游动物群落组成分析发现其变化与水体营养水平有关.VPA分析显示,水体常规理化对浮游动物群落组成的解释度为21.3%,在各湖泊中浮游动物的群落组成与氮,磷,CODMn,Chla具有较高的相关性,这是因为水体营养状态和营养盐含量水平会通过影响浮游植物和细菌等其他浮游动物饵料生物的生长来对浮游动物造成影响[25-27].氮、磷营养盐是浮游植物生长所必须的物质,通过影响浮游植物的群落组成及丰度进而直接影响浮游动物的群落组成[7,12].除营养盐外,Chla和CODMn也是影响武汉各湖泊浮游动物群落组成的关键因素.Chla和CODMn分别代表了水体中浮游植物和有机碎屑的含量,作为浮游动物的主要食物来源,对浮游动物的细胞丰度具有较大的影响[28].随有机质含量的增加,武汉各湖泊原生动物及轮虫的优势种类数量变多及丰度变大也证实了这点.因此,营养盐与Chla,CODMn一起对浮游动物群落结构产生了决定性影响.
作为疫情期间水体重要组成部分DBPs对水体中浮游动物的群落组成也有一定影响.VPA分析显示DBPs组成及含量及其与其他因子联合对浮游动物群落组成的解释度分别为2.5%和6.7%.消毒剂具有很强的氧化性,当其达到一定浓度时可破坏水体的氧化还原平衡,也可改变氮、磷、有机物等的降解和归趋途径[3,29].水体有机质组分也可为残留的消毒剂生成DBPs提供环境底物[30],因此其与常规理化的联合解释度较高.DBPs同样危害水生生物的生长、发育和繁殖,打破水生生态系统的平衡,从而降低水体的自净能力[31-32].但当其浓度较低时,浮游生物生长反倒会出现“低促高抑”现象[33].Mantel test显示浮游动物组成与HKs,Armotics具有负相关;原生动物和甲壳类动物群落组成与NAs具有一定的正相关关系,甲壳类动物与NAs的相关性更高.说明尽管武汉湖泊的消毒副产物浓度相对较低,但不同浮游动物类群对DBPs种类及浓度已经呈现明显的响应.
4 结 论
1)浮游动物群落随着营养含量增加,甲壳纲物种丰度急剧下降,原生动物和轮虫的种类、丰度则随之增加.
2)疫情期间营养盐含量与Chla,CODMn浓度是影响浮游动物群落组成的关键因素,但消毒副产物对浮游动物的群落组成的影响不可忽视.

