苯乳酸对荧光假单胞菌基于细胞膜损伤和DNA破坏的双靶位抑菌机制
宁亚维,侯琳琳,李明蕊,杨 正,马梦戈,王志新,王世杰,贾英民
(1.河北科技大学食品与生物学院,河北 石家庄 050018;2.北京工商大学食品与健康学院,北京 100048)
快节奏的现代化生活方式导致市场上冷藏即食类食品数量增多,由此伴随产生的因嗜冷菌污染引起的食品腐败变质与安全问题也日益增多。假单胞菌是一类典型的嗜冷菌,可导致肉制品和乳制品等多种冷藏食品发生腐败变质。如2010年和2011年分别在北京和长沙的肉产品市场中发现“发光猪肉”[1],该猪肉由于荧光假单胞菌污染而产生发光现象。荧光假单胞菌会分泌蛋白酶导致肉产生黏液,极大降低了加工肉制品的品质和安全性[2]。另外,荧光假单胞菌也是乳制品中常见的嗜冷菌[3],分泌的碱性蛋白酶可以分解酪蛋白,导致乳蛋白凝固以及乳清析出,使牛乳产生苦味,造成乳制品品质显著下降[4]。荧光假单胞菌甚至可以在食品加工设备和管道中以生物膜形式存在,增强了嗜冷菌对加热、消毒等传统杀菌方式的耐受能力[5]。荧光假单胞菌除导致食品腐败变质外,还会引起诸如败血症、感染性休克以及血管内凝血等疾病[6]。因此,控制荧光假单胞菌的生长对提高食品安全性以及延长食品货架期具有重要意义。
添加防腐剂是延长食品货架期最为常用的手段之一,目前所用的防腐剂以化学防腐剂为主,然而化学防腐剂存在安全性低、生产过程易于造成环境污染等问题。随着人们对食品安全的日渐重视,生物防腐剂因具有来源天然、安全性高等优势而受到青睐[7]。苯乳酸即2-羟基-3-苯基丙酸,是近年来发现的一种新型天然有机酸类抑菌物质,可由乳酸菌等微生物代谢产生,天然存在于泡菜、酸面团等乳酸菌发酵食品中[8]。苯乳酸具有广谱抑菌性,可以有效抑制食源性腐败菌和致病菌;研究发现苯乳酸还具有激活免疫等生理功能[9],因此苯乳酸在食品防腐方面具有替代苯甲酸的潜在优势[10]。苯乳酸的抑菌机制近年来受到学者们的关注,但相关研究主要集中于食源性致病菌,如,Dieuleveux等[11]研究了苯乳酸对单细胞增生李斯特菌的抑菌机制,提出了细胞壁是苯乳酸的抑菌靶位;Wang Fengting等[12]考察了苯乳酸对粪肠球菌的抑菌机制,提出了细胞膜损伤和胞内成分渗漏有关的抑菌机制;刘韵昕[7]研究了苯乳酸对枯草芽孢杆菌和铜绿假单胞菌的抑菌机理,发现苯乳酸可以破坏菌体细胞壁和细胞膜的完整性,同时干扰或阻断蛋白质、DNA的正常合成。Liu Fang等[13-14]分析了苯乳酸对阴沟肠杆菌的作用方式,发现苯乳酸通过破坏阴沟肠杆菌的胞质膜,从而抑制阴沟肠杆菌的生长。本课题组基于多年来对苯乳酸的研究,发现苯乳酸对革兰氏阴性菌和革兰氏阳性菌具有不同的抑菌机制,如苯乳酸可以破坏单细胞增生李斯特菌细胞膜完整性,但对大肠杆菌的细菌膜仅破坏其渗透性,而对其完整性无显著性损伤[15]。上述各项研究主要集中于苯乳酸对食源性致病菌的抑制方面,且研究结果显示苯乳酸对不同指示菌的作用机制因菌株特性不同而有差异。然而,苯乳酸作为一种处于开发阶段的新型抑菌物质,有必要全面了解其抑菌机制,为进一步工业化应用提供充分的科学依据。因此,本研究通过考察苯乳酸对荧光假单胞菌细胞膜(包括跨膜电位、膜完整性与渗透性、菌体超微结构等方面)、蛋白质及DNA多靶位的抑制作用,阐释苯乳酸对荧光假单胞菌的抑菌机制,以期为冷藏食品中嗜冷菌-荧光假单胞菌的控制以及苯乳酸在食品中的应用提供科学依据。
1 材料与方法
1.1 菌株、材料与试剂
荧光假单胞菌(Pseudomonas fluorescensATCC13525)由河北科技大学食品生物技术与安全实验室保藏。
D-苯乳酸(纯度98%)、钾离子荧光探针(PBFI acetoxymethyl ester,PBFI AM)、碘化丙啶(propidium iodide,PI)探针、DiSC3(5)探针 美国Sigma公司;LIVE/DEADTM探针 美国Thermo Fisher公司;Minibest Bacterial genomic DNA Extraction Kit ver 3.0 大连宝生物有限公司;低分子质量蛋白质Marker、DNA Ladder北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Evolution 220紫外分光光度计 美国Thermo Scientific公司;Accuri C6 plus流式细胞仪 美国Becton Dickinson公司;BX53荧光显微镜 日本奥林巴斯株式会社;F-7000荧光分光光度计、S-4800-I扫描电子显微镜 日本日立公司;170-4405EDU凝胶电泳仪、Gel DocTMXR+凝胶成像系统 美国Bio-Rad公司;脱色摇床TS-2000A 海门市其林贝尔仪器制造有限公司;SpectraMax Plus 384酶标仪 美国分子仪器有限公司。
1.3 方法
1.3.1 最小抑菌浓度的测定
根据Mellegård等[16]的方法并略作修改,采用微量二倍稀释法利用96 孔板来测定苯乳酸对荧光假单胞菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。用新鲜的营养肉汤(nutrient broth,NB)培养基培养荧光假单胞菌至对数期,调整其细菌浓度为106CFU/mL备用。在96 孔板上第1列加200 μL的20 mg/mL苯乳酸溶液,第2~11列加入100 μL的NB培养基,从第1列吸取100 μL的苯乳酸溶液加入到第2列,吸打混匀后取100 μL加到第3列,依次重复至第10列再吸出100 μL弃掉。第11列不加苯乳酸作为阳性对照,第12列加入200 μL的NB培养基作为阴性对照,然后分别在第1~11列中加入100 μL的106CFU/mL菌悬液。在30 ℃的恒温培养箱中培养18~24 h,通过酶标仪测定吸光度,参考阴性对照,以细菌被抑制的最低苯乳酸质量浓度为MIC。
1.3.2 时间-抑菌曲线绘制
将培养至对数期的荧光假单胞菌接种到NB培养基中,调菌液浓度为106CFU/mL。将菌悬液与不同质量浓度的苯乳酸(0(空白对照组)、1/2 MIC、MIC、2 MIC)等体积混合,于30 ℃恒温培养箱中分别培养0、2、4、6、8、12、24 h后取样,并采用稀释涂布平板法测定菌液中的荧光假单胞菌的活菌数。以时间为横坐标,活菌数的对数值为纵坐标来绘制时间-抑菌曲线。
1.3.3 细胞膜跨膜电位的测定
使用荧光探针DiSC3(5)对荧光假单胞菌细胞的膜电位进行测定,根据Sun Zhilan等[17]的方法并略作修改,将培养至对数期的荧光假单胞菌用5 mmol/L Hepes缓冲液(含有10 mmol/L葡萄糖,pH 7.2)清洗重悬,调节菌悬液浓度至2×108CFU/mL。向菌悬液中加入DiSC3(5)探针(终浓度为1 μmol/L),于30 ℃黑暗条件下孵育20 min,然后加入KCl溶液(终浓度为0.1 mol/L)平衡细胞质内外K+浓度。上述含K+的Hepes菌混合液与苯乳酸等体积混合,使苯乳酸终质量浓度为0、1/2 MIC、MIC、2 MIC。分别加入尼日利亚菌素作为阴性对照,加入缬氨霉素作为阳性对照。用F-7000荧光分光光度计分别在激发波长λex=650 nm、发射波长λem=672 nm的条件下测定荧光强度。
1.3.4 细胞膜渗透性的测定
采用钾离子敏感性探针PBFI AM考察钾离子的泄漏情况。根据Herranz等[18]的方法,首先制备荧光假单胞菌对数期的细胞,用含5 mmol/L葡萄糖的Hepes缓冲液清洗重悬,调整菌悬液浓度为2×108CFU/mL。将PBFI AM加入到菌悬液(终浓度为2 μmol/L)中。将上述菌悬液与终质量浓度苯乳酸(0、1/2 MIC、MIC、2 MIC)等体积混合作用0.5 h。采用荧光分光光度计分别在λex=346 nm、λem=505 nm条件下测定荧光强度,进行3 次平行实验。
1.3.5 细胞膜完整性的测定
取对数期的荧光假单胞菌离心,质量分数0.85%生理盐水清洗重悬至菌悬液浓度为2×108CFU/mL,菌悬液与不同质量浓度苯乳酸等体积混合,使苯乳酸终质量浓度分别为0、1/2 MIC、MIC、2 MIC。30 ℃恒温作用0.5 h后用质量分数0.85%生理盐水清洗重悬,加入PI、SYTO-9(终浓度均为1 μmol/L),30 ℃避光孵育20 min后,再用质量分数0.85%生理盐水清洗重悬,用流式细胞仪检测。将上述菌悬液离心后弃掉上清液,取菌体进行显微镜观察。
1.3.6 细胞超微结构观察
取对数期的荧光假单胞菌离心,用质量分数0.85%生理盐水清洗重悬制备为2×108CFU/mL的菌悬液。然后按Kang Shimo等[5]的方法进行制样,菌悬液中加入苯乳酸(0、1/2 MIC、MIC、2 MIC),在30 ℃培养箱中作用1 h后,采用0.2 mol/L的磷酸盐缓冲液清洗3 次,用体积分数2.5%戊二醛溶液固定过夜,经0.2 mol/L的磷酸盐缓冲液清洗3 次后,依次用体积分数30%、50%、70%、85%和90%乙醇溶液脱水,无水乙醇洗脱两次(15 min/次)。乙酸异戊酯置换乙醇两次(20 min/次)自然晾干除去有机溶剂。取菌体喷金后用扫描电子显微镜观察菌体的微观结构。
1.3.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析菌体蛋白质
取对数期的荧光假单胞菌离心,用质量分数0.85%生理盐水清洗重悬制备4×108CFU/mL的菌悬液。参考Lin Lin等[19]的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)方法,将菌悬液加入终质量浓度为0、1/2 MIC、MIC、2 MIC苯乳酸。30 ℃恒温培养箱中静置作用1 h后,离心清洗收集菌体。菌悬液与4×蛋白上样缓冲液混合,至100 ℃沸水中煮沸5 min后离心。取上清液上样进行SDS-PAGE,初始电压为80 V,样品进入分离胶后,将电压调至120 V,直至溴酚蓝电泳至胶底。染色液染色30 min后,再用脱色液脱色直至蛋白条带清晰,使用凝胶成像系统拍照并分析。
1.3.8 基因组DNA分析
收集对数期的荧光假单胞菌,用质量分数0.85%生理盐水清洗、重悬,制备4×108CFU/mL菌悬液。体外DNA作用方法:按照Takara试剂盒方法提取基因组DNA,与苯乳酸等体积混合使其终质量浓度分别为0、1/4 MIC、1/2 MIC、MIC和2 MIC,30 ℃恒温培养箱作用1 h;体内DNA作用方法:菌悬液与不同浓度苯乳酸等体积混合,30 ℃恒温培养箱作用1 h后,按照Takara试剂盒方法提取基因组DNA。用超微量紫外分光光度计测定DNA纯度(OD260nm/OD280nm=1.87)以及DNA质量浓度(40 μg/mL),进行DNA琼脂糖凝胶电泳(100 V、60 min),凝胶成像系统拍照并分析。使用荧光分光光度计在激发波长280 nm、发射波长300~500 nm条件下对体外、体内DNA荧光强度进行检测。
1.4 数据处理与分析
所有实验均重复3 次取其平均值,通过SPSS 19.0软件进行单因素方差分析,P<0.05表示差异显著,采用Origin软件作图。
2 结果与分析
2.1 苯乳酸对荧光假单胞菌的抑菌活性
苯乳酸对荧光假单胞菌的MIC为1.25 mg/mL,显著低于Kang Shimo等[5]研究的乳糖醛酸对荧光假单胞菌的MIC(12.5 mg/mL)。通过时间-抑菌曲线进一步研究苯乳酸对荧光假单胞菌的抑菌效果。由图1可知,空白对照组的荧光假单胞菌生长状况良好,1/2 MIC苯乳酸组荧光假单胞菌数在前4 h轻微下降,但是4 h后随时间延长而增加,12 h后趋于稳定,与空白对照组相差0.56 lg(CFU/mL)。而MIC、2 MIC苯乳酸组在2 h菌落数出现明显下降,6 h后活菌数趋于稳定,作用24 h后活菌数分别降低了1.79、3.94 lg(CFU/mL),2 MIC苯乳酸抑制效果明显优于MIC苯乳酸。实验结果表明1.25 mg/mL苯乳酸可以有效抑制荧光假单胞菌的生长繁殖,并且随苯乳酸质量浓度增大抑制效果增强。这与本课题组研究的MIC(1.25 mg/mL)苯乳酸作用于大肠杆菌24 h后活菌数降低将近1 lg(CFU/mL)的抑菌效果[15]相比,苯乳酸对荧光假单胞菌的抑菌效果更加显著。

图1 苯乳酸对荧光假单胞菌的时间-抑菌曲线Fig.1 Time-inhibition curves of PLA against P.fluoresceins
2.2 苯乳酸对荧光假单胞菌跨膜电位的影响
跨膜电位是指质子通量引起的电化学梯度在细胞膜上产生的电位差[20],DiSC3(5)是一种亲脂性的荧光探针,进入正常细胞后会在细胞脂质层发生自我猝灭。然而当细胞膜去极化时,DiSC3(5)会从细胞膜内释放出来,导致荧光信号增加[21]。缬氨霉素作为脂溶性抗生素可以有效破坏细胞膜上的跨膜电位[22],而尼日利亚菌素对跨膜电位并无作用。如图2所示,随时间的延长,未添加苯乳酸组的DiSC3(5)荧光强度稳定在170左右,1/2 MIC、MIC、2 MIC的苯乳酸作用后终荧光强度分别达到319.9、345.7、371.1,均高于缬氨霉素处理组,随着苯乳酸质量浓度的增加,DiSC3(5)荧光强度增大。结果表明苯乳酸可以使DiSC3(5)荧光强度增加,且增加程度呈剂量依赖性,导致细胞膜去极化。不同有机酸处理的细菌均呈现细胞膜去极化[23]。据报道,在细胞膜去极化后,抗菌物质很容易插入细胞膜,导致细胞膜形成孔隙,从而导致钾离子等必需离子的泄漏[24]。Liu Guorong等[25]研究表明双歧杆菌素A与缬氨霉素的作用效果一致,能使大肠杆菌的胞质膜快速完全去极化。说明苯乳酸与双歧杆菌素A均可以导致跨膜电位消散,使细胞膜去极化。

图2 苯乳酸对荧光假单胞菌跨膜电位的影响Fig.2 Effect of PLA on the transmembrane potential of P.fluoresceins
2.3 苯乳酸对荧光假单胞菌细胞膜渗透性的影响

图3 苯乳酸对荧光假单胞菌钾离子泄露的影响Fig.3 Effect of PLA on potassium ion leakage from P.fluorescens
钾离子通道属于横跨细胞膜的离子选择性孔道,用来调控和产生膜电位。通过膜不渗透性的PBFI AM考察苯乳酸对荧光假单胞菌细胞内钾离子泄漏的影响。如图3所示,经过不同质量浓度苯乳酸作用荧光假单胞菌0.5 h后,钾离子泄露量与对照组相比均高度显著增加(P<0.001)。说明苯乳酸可以增大荧光假单胞菌细胞膜的通透性,导致钾离子的泄露,并且泄漏量与苯乳酸质量浓度呈正相关。这与周倩倩等[26]研究的丁香酚对荧光假单胞菌的作用效果相似,其均会通过破坏细胞膜渗透性,导致钾离子泄露。与2.2节细胞膜电位的变化相对应,苯乳酸破坏膜电势后导致细胞膜去极化,使平衡膜电位的钾离子发生泄漏,进一步验证了苯乳酸通过破坏荧光假单胞菌的跨膜电位,增加细胞膜的渗透性。
2.4 苯乳酸对荧光假单胞菌细胞膜完整性的影响
通过SYTO-9和PI双染法标记细胞,采用荧光显微镜观察分析苯乳酸对菌体细胞膜的损伤情况。SYTO-9能够进入细胞膜完整的细胞内将核酸染色发出绿色荧光。PI可以透过破损细胞膜,而使核酸染色发出红色荧光[27]。当细胞膜受损,PI可进入到细胞,对核酸进行染色,发出红色荧光,SYTO-9也能进入细胞染色,但是PI的沾染能力强于SYTO-9,此时会产生荧光信号的叠加,即红色和绿色的叠加,呈现红色、橙色或黄色[22]。苯乳酸对荧光假单胞菌细胞膜完整性的影响如图4所示,空白对照组呈绿色菌体,说明细胞膜完整;1/2 MIC苯乳酸组呈绿色、黄色和橙黄色,说明部分细胞膜有轻微破损;MIC苯乳酸组呈现橙黄色,说明大部分的细胞膜破损;2 MIC苯乳酸处理组呈现橙红和红色,说明2 MIC苯乳酸对膜的破坏程度明显强于MIC苯乳酸。上述结果表明随着苯乳酸质量浓度增加,荧光假单胞菌细胞膜损伤程度增大。

图4 苯乳酸对荧光假单胞菌细胞膜完整性的荧光显微镜图Fig.4 Fluorescence microscopic images of membrane integrity of PLA-treated P.fluoresceins
为了进一步研究细胞膜完整性的破损程度,采用流式细胞仪结合SYTO-9和PI双染法对细胞膜完整性进行定量研究[28],结果如图5、6所示。苯乳酸处理的荧光假单胞菌细胞膜完整性与空白对照组相比存在高度显著差异(P<0.001)。未经苯乳酸作用的菌体仅有7.2%凋亡的细胞被PI沾染,1/2 MIC、MIC和2 MIC苯乳酸作用于荧光假单胞菌0.5 h后,细胞膜的PI沾染率分别是36.0%、57.6%、86.4%,进一步证实苯乳酸可导致荧光假单胞菌细胞膜完整性受到损伤,且损伤程度与苯乳酸的质量浓度呈正相关。本研究结果与Kang Shimo等[5]研究的荧光假单胞菌细胞膜损伤程度与乳糖醛酸质量浓度呈正相关的结果相同,受试抑菌剂均可以通过剂量依赖的方式破坏细胞膜的完整性。与Liu Fang等[13]通过流式细胞术研究的苯乳酸对阴沟肠杆菌的效果类似,苯乳酸可导致阴沟肠杆菌的细胞膜完整性受损,但该研究所用的苯乳酸剂量较大,为10 mg/mL(相当于本实验中8 MIC)。与本课题组研究的苯乳酸对大肠杆菌细胞膜作用机制[15]不同,苯乳酸能够增加大肠杆菌细胞膜渗透性,但不会破坏细胞膜完整性,而对于荧光假单胞菌,苯乳酸不仅可以增加细胞膜渗透性,还会破坏膜完整性,可能与细胞膜结构和组成差异有关。后续将进一步深入研究苯乳酸对革兰氏阴性菌细胞膜损伤的差异性原因。

图5 苯乳酸对荧光假单胞菌细胞膜完整性的流式细胞图Fig.5 Flow cytometric analysis for of membrane integrity of PLA-treated P.fluoresceins

图6 苯乳酸对荧光假单胞菌膜完整性的影响Fig.6 Effect of PLA on the membrane integrity of P.fluorescens
2.5 苯乳酸对荧光假单胞菌超微结构的影响
通过扫描电子显微镜直观地观察了苯乳酸对荧光假单胞菌细胞外部超微结构的变化,结果如图7所示。空白对照组细胞呈现完整、清晰、饱满并且表面相对光滑的短杆状形态;1/2 MIC苯乳酸处理组大部分细胞仍呈正常的形态,但表面粗糙,细胞内容物溢出发生黏连;MIC、2 MIC苯乳酸处理组菌体呈现严重破裂并引起细胞原生质的外泄。不同质量浓度苯乳酸对菌体破坏程度的结果与时间-抑菌曲线和流式细胞术等研究结果一致,即1/2 MIC苯乳酸处理组菌体表面与对照组差异并不明显,荧光假单胞菌的生长未受到抑制,而MIC、2 MIC苯乳酸处理组菌体严重破裂,生长受到明显抑制。说明MIC、2 MIC苯乳酸处理能够破坏荧光假单胞菌的细胞壁和细胞膜,导致细胞形态改变、局部破裂、原生质泄露,从而抑制荧光假单胞菌的生长繁殖。与酸性电解水对荧光假单胞菌的作用效果[29]不同,酸性电解水作用菌体表面只发生褶皱,细胞黏连,并没有显著破损。与Liu Fang等[13]发现质量分数1%和0.5%苯乳酸可导致阴沟肠杆菌胞内物质泄漏的结果一致。本研究结果表明苯乳酸可以破坏荧光假单胞菌细胞膜完整性和渗透性,导致大分子物质泄漏。

图7 苯乳酸对荧光假单胞菌细胞超微结构扫描电子显微镜图Fig.7 SEM images of the ultrastructure of P.fluoresceins cells in the presence of PLA
2.6 苯乳酸对荧光假单胞菌蛋白质的影响
蛋白质是生命活动的主要承担者,干扰或抑制蛋白质的合成可以达到抑菌作用。因此,通过蛋白质凝胶电泳可研究苯乳酸对荧光假单胞菌中蛋白质的影响,结果如图8所示。与空白对照组相比,1/2 MIC、MIC、2 MIC苯乳酸处理组蛋白条带数量无明显变化,MIC、2 MIC苯乳酸处理组蛋白条带的颜色变浅。结合扫描电子显微镜结果,推测苯乳酸严重破坏了荧光假单胞菌菌体,导致原有菌体蛋白质发生泄漏。上述研究表明苯乳酸进入细菌内部不会改变蛋白质的表达模式,而是通过破坏细胞膜完整性导致蛋白质等大分子物质泄漏。这与刘韵昕[7]研究的苯乳酸可以抑制铜绿假单胞菌蛋白质的表达不同,推测原因可能为菌体自身抵御酸的方式不同。

图8 苯乳酸对荧光假单胞菌细胞蛋白质的影响Fig.8 Effect of PLA on proteins of P.fluoresceins
2.7 苯乳酸对荧光假单胞菌DNA的影响
2.7.1 苯乳酸对荧光假单胞菌体外DNA的影响
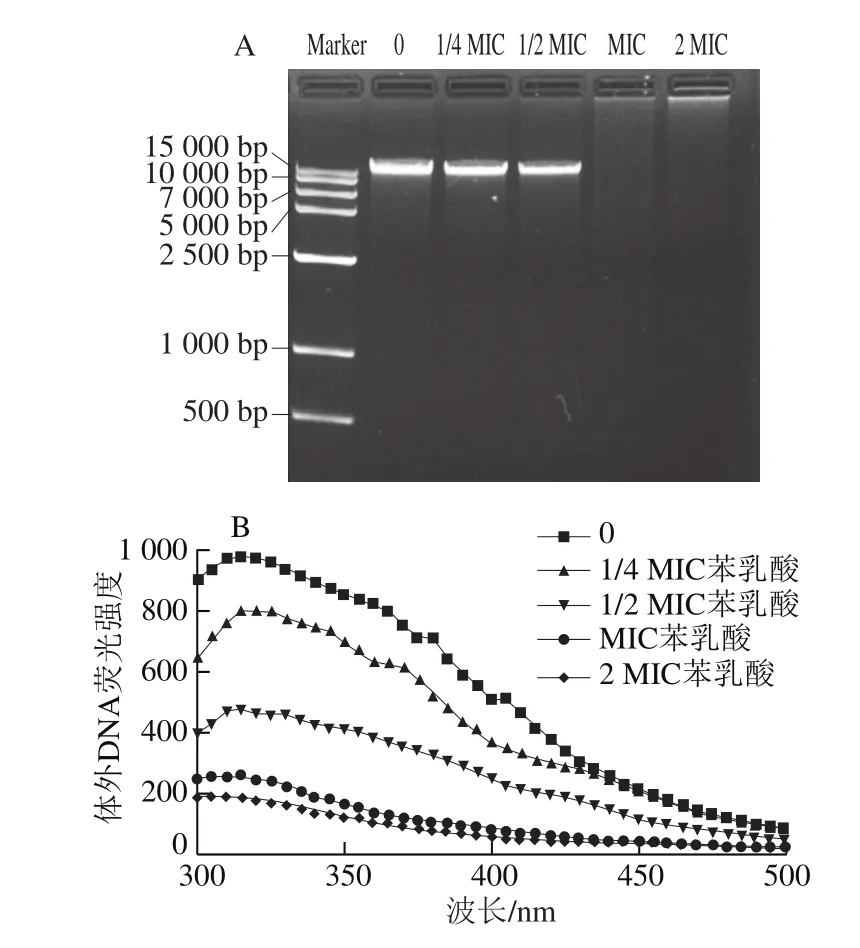
图9 苯乳酸对荧光假单胞菌DNA体外作用的影响Fig.9 Effect of PLA on DNA of P.fluorescens in vitro
DNA是生物体内重要的遗传物质,DNA的破坏会阻碍基因的表达,从而导致正常酶和受体合成的阻滞,使菌体死亡[30],因此本实验考察了苯乳酸对荧光假单胞菌DNA的影响。不同质量浓度的苯乳酸对荧光假单胞菌体外DNA的凝胶电泳结果如图9A所示,空白对照组的DNA条带颜色明亮,随着苯乳酸质量浓度的增加,DNA条带颜色逐渐变暗,且DNA条带位置轻微下移,说明苯乳酸可以导致DNA发生部分降解,分子质量降低。而MIC、2 MIC苯乳酸处理组的条带发生弥散,说明菌体体外DNA严重降解。采用荧光光谱法进一步研究苯乳酸与DNA的相互作用[31],如图9B所示,荧光光谱法与琼脂糖凝胶电泳实验结果一致。在抑菌过程中体外DNA荧光强度随苯乳酸质量浓度升高而降低,MIC、2 MIC苯乳酸作用后的DNA体外荧光强度最低。研究结果与乳糖酸和香豆酸对DNA的影响不同,乳糖酸通过与荧光假单胞菌DNA结合导致荧光猝灭,且猝灭程度与乳糖酸质量浓度无关[5];香豆酸通过插入到志贺氏菌基因组DNA碱基对中,与DNA碱基相互叠加使荧光强度增强[32]。可能由于有机酸结构不同导致与菌体DNA结合方式不同。由此说明苯乳酸除了作用于荧光假单胞菌细胞膜,还会与DNA结合,通过破坏DNA抑制菌体正常的生长繁殖。
2.7.2 苯乳酸对荧光假单胞菌体内DNA的影响
尽管体外研究结果能够说明物质对DNA是否产生破坏作用,但由于受到菌体自身保护等多种作用的复杂影响,体内DNA作用程度通常不同于体外的研究结果。因此,本节考察了不同质量浓度苯乳酸对荧光假单胞菌体内DNA的影响。图10A显示,空白对照组的DNA条带单一且颜色明亮。随苯乳酸质量浓度增加,DNA条带颜色逐渐变浅,2 MIC苯乳酸与DNA结合作用增强,导致更多DNA无法从点样孔迁移出,出现轻微的阻滞现象。结合图10B中荧光假单胞菌体内DNA荧光强度随苯乳酸质量浓度增加而降低,说明经苯乳酸作用后,荧光发生猝灭,体内DNA含量降低。推测苯乳酸可能与DNA结合,破坏DNA构象和结构,导致DNA泄露或者影响DNA正常的合成代谢。这与刘韵昕[7]研究的苯乳酸对铜绿假单胞菌体内DNA的影响大致相同,体内DNA的含量与苯乳酸的质量浓度呈负相关,而且苯乳酸可以与DNA结合阻碍菌体正常的生长繁殖。结合苯乳酸对荧光假单胞菌的体外DNA实验分析,体内DNA猝灭程度明显比体外DNA低,MIC苯乳酸可以使体内DNA发生泄漏,体外DNA严重降解。上述现象可能是由于苯乳酸首先作用于细胞壁、细胞膜,然后进入菌体内部再与DNA发生结合,与DNA结合的苯乳酸质量浓度可能会低于处理所用的质量浓度,同时作用过程会受到菌体自身防御机制等因素复杂影响,因此体内DNA的破坏程度低于体外直接作用的破坏程度。总之,本研究结果表明苯乳酸可以干扰DNA正常的合成代谢从而抑制荧光假单胞菌。此外,课题组前期研究发现苯乳酸可以与大肠杆菌的DNA结合,影响DNA复制、转录和表达,从而抑制菌体生长[15]。本研究进一步明确了DNA是苯乳酸的抑菌作用靶位。

图10 苯乳酸对荧光假单胞菌体内DNA的影响Fig.10 Effect of PLA on DNA of P.fluorescens in vivo
3 结 论
苯乳酸可以通过破坏荧光假单胞菌的细胞膜与DNA发挥抑菌作用,即苯乳酸通过消散荧光假单胞菌的跨膜电位,增加细胞膜渗透性,造成细胞内钾离子显著泄漏;通过破坏细胞膜完整性,引起细胞形态改变,导致内容物泄漏、菌体发生黏连;进入胞内后可以破坏DNA结构,阻碍基因的表达,从而抑制荧光假单胞菌正常的生长繁殖。该抑菌机制的阐明可为冷藏食品中天然安全生物防腐剂的开发提供理论依据。

