运输应激对鱼类生理特性和肌肉品质影响的研究进展
尤孝鹏,汪 兰,2,熊光权,乔 宇,吴文锦,李 新,丁安子,孙卫青,
(1.长江大学生命科学学院,湖北 荆州 434025;2.湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064)
运输作为鱼类生产过程中不可避免的一环,其通常会导致鱼类的生存环境突然改变,进而引发鱼体的应激反应。与正常状态相比,鱼类在发生应激反应时,体内激素的分泌和物质能量代谢等生理生化过程会发生显著变化,这会直接影响鱼体的健康甚至威胁生命,并对其肌肉的品质造成不利影响。目前,大部分有关鱼类应激的研究是以生理特性为主,对肌肉品质的研究较少,而对其机制的研究则更少。本文为从源头上缓解鱼类运输应激并最大程度保证鱼体健康和最佳肉品质提供更可靠的理论参考。
1 鱼类运输和应激
1.1 应激
应激是指机体受到胁迫时所表现出的紧张状态,是机体对抗对自身内环境稳态有威胁的各种刺激的过程,也是一种使机体保持生物学合理状态的自我防御方式[1]。此概念根据观察到的动物在应对如温度胁迫时所发生的非特异性反应提出,这种状态被称为“全身适应综合症”,后又称“应激”[2]。
应激反应通常是由神经、内分泌、免疫系统协调完成的生理活动,可分为4 个层次:恶性应激、良性应激、强应激、弱应激[3]。生物应激反应具有主动性和复杂性的特点,具体表现为4 个方面[4]:1)生物体具有主动修复损伤的机制;2)生物体所具备的适应性增强了对重复或某持续刺激的抵抗性;3)一种应激反应可能会引发机体其他系统的应激;4)应激反应在行为上的特征是减少或避免与应激源的直接接触。根据Selye[5-6]和Tachè[7]等的研究将应激反应过程分为3 个阶段:警觉阶段、抵抗阶段、衰竭阶段。
1.2 引起鱼类运输应激的因素
鱼类的运输应激是指在鱼类运输过程中,禁食、生存环境突然改变或碰撞等因素综合影响下产生的适应性或防御性反应[8]。主要的诱发因素包括氨氮胁迫、拥挤胁迫、温度胁迫、振动胁迫。
1.2.1 氨氮胁迫
运输过程中水体的氨氮主要来源于鱼类的排泄物,氨氮水平是影响运输成活率的重要因素。例如高浓度的氨氮会伤害鱼的鳃丝表皮细胞,引起气体交换功能障碍,并会破坏渗透平衡性,从而导致部分组织病变,降低机体免疫力甚至威胁生命[9]。吴利敏等[10]研究发现急性氨氮胁迫会对淇河鲫幼鱼脑、鳃、肝等组织结构产生较大损伤。
1.2.2 拥挤胁迫
鱼类的生长和运输需要合理的密度,密度过大会造成拥挤胁迫而降低存活率及鱼类福利[11],Mechesso等[12]在对比目鱼的研究中发现拥挤胁迫会使其血浆皮质醇含量显著上升,熊梅等[13]在对草鱼的研究中也得出了相同的结论,并发现拥挤胁迫导致草鱼肌肉硬度和凝聚性显著下降。
1.2.3 温度胁迫
不同鱼类有不同的适宜生长温度范围,例如冷水鱼在运输过程中会由于水温的升高而引起热应激,王晓雯等[14]研究表明急性运输热应激会对西伯利亚鲟幼鱼的肝脏功能产生不利影响,并通过肝脏中热休克蛋白(heat shock protein,HSP)70和HSP90的mRNA大量表达以调节生理平衡,减少热应激对机体的损伤[15],韩邦等[16]在对波纹唇鱼免疫功能的研究中发现热应激会导致其免疫功能显著减弱。
1.2.4 振动胁迫
运输过程中因各种不可控因素而造成的颠簸和水体振动会引发鱼类的应激反应。王文博[17]对鲫鱼的振动胁迫进行了研究,发现受到振动胁迫后的鲫鱼血清皮质醇水平显著高于正常组,Demers等[18]在虹鳟鱼的振动胁迫研究中也得到了相同的结论。
1.3 运输应激对鱼类生理特性的影响
鱼类运输应激属于急性应激,会迫使机体的理化状态改变,破坏内环境稳态并为此付出“生物学代价”[19],造成鱼类免疫力下降,同时机体由于过氧化导致抗氧化酶活力降低,具有抗氧化性的非酶类物质如谷胱甘肽被过度消耗,机体无法及时有效地清除氧自由基,最终造成机体的氧化损伤。上述现象的根本原因是应激状态下鱼体将重置机体内物质能量的分配与利用,致使原来的神经、内分泌、免疫等系统功能发生变化,而这些变化可以由某些特定物质来表征。
鱼类发生应激反应时,下丘脑-垂体-肾间组织(hypothalamic-pituitary-interrenal,HPI)轴的激活和作用是最主要的神经-体液-免疫调节机制[20]。例如HPI轴通过释放皮质类固醇激素提高能量代谢水平,同时血糖和血浆皮质醇浓度升高以应对应激[21]。血液中的血浆作为动物的细胞外液,各组分含量的变化往往能准确显示机体的生理状态。鱼类血液中与应激有关的组分如儿茶酚胺(包括肾上腺素和去甲肾上腺素)、皮质醇以及血糖等浓度的变化能实时有效地反映应激反应的状态[22]。皮质醇作为典型的糖皮质激素,其含量在应激反应初期显著升高,因此被广泛应用于鱼类应激状况的评估[23]。儿茶酚胺的代谢速率较快,不易量化,故应用较少。血糖浓度是应激反应中反映能量代谢变化的主要指标之一,由于糖原分解和糖异生作用加剧,通常导致应激反应过程中血糖浓度升高,反映了应激反应的持续性[24]。
作为分子伴侣的HSPs是参与机体应激反应的细胞内合成的一类蛋白质,可以催化变性蛋白的重新折叠并调节许多信号传导途径,起到修复细胞损伤和应激保护的作用[25]。作为一种广泛存在于真核、原核细胞中且进化上高度保守的蛋白质,其含量的变化可较准确地反映应激反应的进展[26]。HSPs表达量的升高是鱼类应激过程中的典型特征[27-28],如虹鳟鱼在运动疲劳应激时肌肉和心脏中HSP水平显著升高[29]。
综上,通过监测鱼类血液或其他组织器官中的某些特定物质含量的变化,可以判断鱼类是否发生应激反应以及该反应的剧烈程度。除上述例举出的较传统且典型的血浆或内脏组织中的物质外,很多学者还发现了可用于研究鱼类应激的其他特征物,如Bulloch等[30]研究发现鱼黏液中的F2-异前列腺素可作为表征鱼体内氧化应激的生物标志物。
1.4 运输应激对鱼类肌肉品质的影响
运输应激反应对能量的需求量大,处于急性应激状态下的鱼体内糖代谢相关酶活性显著增强,同时肌肉内糖原含量显著降低,血糖浓度升高[31-32]。这表明应激提高了鱼体生命活动,可能引起机体无氧糖酵解、脂质过氧化等反应加剧。这时机体会动员能量代谢相关的理化反应以适应应激,这个过程会积累大量代谢产物,导致肌肉品质劣化[33-34]。pH值是评价肌肉品质的重要指标之一,引起鱼类肌肉pH值降低的原因有很多,如应激过程中乳酸的大量堆积[35]。研究表明运输应激会使鱼类肌肉pH值降低,导致肌肉品质劣化[36]。pH值降低会影响肌肉品质,如其能够引起肌肉剪切力下降,使肉质松散[37],还可能使肌肉的质构特性变差[38],降低肌肉硬度[39]。简而言之,鱼类肌肉品质随pH值的降低而降低[40]。运输应激还会导致鱼类肌肉持水能力下降而形成PSE(pale soft exudative)肉,研究发现运输应激后的大西洋鳕肌肉含水量显著降低[41],这可能是鱼体代谢紊乱以及参与代谢的酶功能异常引起的。运输应激对鱼类肌肉色泽也有一定影响,张玉平等[42]发现异育银鲫在4 h的模拟运输后,肌肉的L*、a*、b*值均降低,体色变暗。此外,鱼类的应激反应还可能造成肌纤维损伤(线粒体膜破损、排列松散、肌节肿胀甚至降解等),以及由于应激过程中物质能量代谢失调而导致肌肉中营养物质的大量损失等不利影响。鱼类的应激反应甚至会通过减少蛋白质合成而导致肌肉萎缩[43]。
1.5 减缓鱼类应激的方法
目前减缓鱼类应激的方法主要包括良种培育、药物缓解、优化养殖环境、规范化操作等[44]。首先,基于不同品种或个体间发生应激反应的强度以及对应激的耐受力存在差异,且这种差异具有遗传性的事实[45],可结合细胞和基因工程等技术通过品系间杂交育种定向选育耐应激的新品系,例如研究人员已对黄鳍鲷和鲈鱼进行了耐盐度选择实验[46];其次,药物缓解鱼类应激是目前养殖生产中应用最广的措施,包括免疫增强剂、麻醉剂和镇静类药物;再者,养殖环境是决定鱼类健康的重要条件,保证良好的水质、合适的背景颜色、水体流速、温度和光照,以及科学的养殖密度和污染物排放尤为关键[47],良好的养殖环境会提高鱼体的耐受力,减缓运输应激;最后,生产实践中需规范化操作,包括制定合理的生产计划、选择最佳养殖模式和工具、科学喂料、定期消毒、适时捕捞等[48]。在进行活鱼运输时,应根据品种和路况的不同,选择最佳运输方式,控制合理的运输密度和水温,必要时可辅以纯氧运输。
2 应激对鱼类生理代谢的影响
2.1 应激对鱼类代谢途径的影响
鱼类的应激是由一系列内在生理调控和外在行为组成的综合反应,除肉眼可见的外在行为外,复杂的生理调控主要包括神经内分泌激素调节、物质能量代谢调节、信号传导、蛋白质修饰以及基因表达调控等,是鱼类在应激状态下产生各种反常行为的根本原因,同时这些理化过程互相交联、共同作用,可构成多个独立而又互相关联的代谢途径(通路)。代谢途径的调控是应激反应研究领域的重点,一条代谢途径代表一个完整的反应体系,是在多酶体系的催化下完成的一个或多个酶促化学反应[49]。应激反应对代谢途径的影响通常表现为后者被激活或被抑制,反过来,某些物质的代谢会直接影响或决定鱼类对某些应激因子的耐受性,通过这些特定物质的含量、活性、存在状态或空间结构等往往可以准确评估鱼类的代谢状态,因此,这些物质可作为鱼类应激反应中的生物标志物。
目前,很多学者已发现并验证了部分与应激反应有关的代谢途径。糖原是机体内重要的功能物质,且正常情况下肝糖原比肌糖原更稳定,郭志雄等[50]研究发现急性低氧应激激活了大规格军曹鱼幼鱼肝脏的糖酵解途径,表现为肝糖原浓度较正常幼鱼低,同时乳酸脱氢酶、丙酮酸激酶和己糖激酶的活力均极显著升高,这表明机体主动激活了无氧代谢相关途径以对抗由于低氧胁迫下机体有氧代谢被抑制而导致的能量供给不足,这可能是机体的一种自我补偿机制。温度是影响鱼类新陈代谢的关键因素,且不同组织对此有不同的反应,Sun Junlong等[51]对鲤鱼的热胁迫进行了研究,发现鲤鱼的呼吸频率与水温呈正相关,且热应激状态下的鲤鱼肌肉中脂蛋白脂肪酶和肝脂肪酶的活力最低,导致甘油三酯水平显著升高,而在肝脏中的变化则恰好相反,这表明鲤鱼的肌肉和肝脏中的脂质代谢途径在发生热应激时可能有不同的对抗机制,鱼类通常会在冬季受低温的影响而减少其活动,若此时水温突然上升则可能引发鱼类的急性热应激。Richard等[52]在缓解金头鲷鱼冬季的热应激途径的研究中,通过对比肝脏的蛋白质组指纹图谱发现,急性热应激引发了肝脏的氧化应激和内质网应激,蛋氨酸循环和苯丙氨酸/酪氨酸分解代谢途径被抑制而导致代谢通量降低,同时抑制了需氧代谢途径,并降低了糖原异生的能力,最终威胁到鱼类的健康。Guillen等[53]在对南极鱼的急性热应激研究中发现,随着水温的升高,肾脏中的苹果酸脱氢酶、葡萄糖6磷酸酶和糖原磷酸化酶的活力增加,同时肝脏中乳酸浓度升高以及脑中的糖原磷酸化酶活力增加,这些特定组织内相关指标的变化表明,在热应激状态下的南极鱼可能是通过激活体内糖酵解、糖异生等途径使机体内的糖原分解作用加强以满足较高的能量需求。Liu Yang等[54]通过将代谢组学和转录组学相结合,分析了细鳞鲑发生热应激时血浆和肝脏代谢的整体变化,结果表明热应激对细鳞鲑造成了长期影响,能够抑制其能量代谢,同时改变其脂质、氨基酸、胆碱和核苷酸的代谢,且显著激活了谷氨酸的代谢,由此认为谷氨酸可能是与热应激相关的重要生物标志物。这些研究都说明应激因子引发了鱼类的适应性或抵御反应,机体内与物质能量代谢、免疫、抗氧化等相关的通路被激活或被抑制,并伴随相关酶和调控因子的活性以及其对应基因的表达量上调或下调,每个理化过程都互相制约、密切相关,而且在同一应激反应中机体的不同组织器官对同一代谢通路的调控可能存在差异。
2.2 应激影响鱼类肌肉品质的途径
肌肉是所有动物的重要组成部分,是动物产品的主要来源,是最大的能量和氨基酸库[55]。动物肌肉品质往往受到很多因素的影响,除养殖过程、养殖环境、食物来源和养殖方式外,由于动物受各种不利环境因子、运输以及屠宰过程的影响而产生的应激反应也会导致其肌肉品质降低、生长缓慢、免疫力降低等情况[56]。目前在应激对动物肌肉品质的影响机理研究中,研究对象较集中于猪、牛、羊、鸡等家禽或其他陆生动物,而鲜有对鱼类研究的相关报道,作为生理学和食品科学研究的交叉,应激对鱼类肌肉品质的影响机理在未来或成热门研究方向。
基因效应是影响肌肉生长发育和品质的根本因素或自身因素[57]。上述已提到应激会影响相关基因的表达,例如鱼类生肌调节因子(myogenetic regulatory factors,MRFs)主要调控动物肌原细胞的分化、肌肉组织的形成,以及生长发育后期肌纤维体积的增大。反过来,在鱼体孵化及后期生长阶段,各种环境因子会对MRFs及相关调控因子的表达产生影响,这在对虹鳟[58]、尼罗罗非鱼[59]和草鱼[60]等品种的研究中已经得到初步验证。因此,基因与环境的共同作用决定了鱼类包括肌肉品质在内的各种性状。
鱼体的健康状态会直接影响应激水平,例如Xie Shiwei等[61]研究发现日粮中的氧化鱼油可通过降低大嘴鲈鱼肝脏中磷脂和脂肪酸的不饱和度引起鱼体的氧化应激,威胁鱼的健康。Wan Xuebin等[62]利用转录组学技术揭示了皮质醇劣化猪肉品质的机制通路(图1),当发生应激后,通过转录组测序筛选出了大量与钙通道和细胞凋亡有关的差异表达基因,如Toll样受体3(Toll-like receptor 3,TLR3)、白介素1受体辅助蛋白(interleukin 1 receptor accessory protein,IL-1RAP)、转化生长因子β1(transforming growth factor beta 1,TGFβ1)、趋化因子2(C-C motif chemokine ligand 2,CCL2)、分泌磷蛋白1、谷胱甘肽过氧化物酶2(glutathione peroxidase 2,GPX2)、CD3抗原(CD3 antigen,epsilon polypeptide,CD3ε)、趋化因子受体5(C-C motif chemokine receptor 5,CCR5)、转录激活因子3(activating transcription factor 3,ATF3)和斯钙素1(stanniocalcin 1,STC1)等,同时由下丘脑-垂体-肾上腺(the hypothalamic-pituitary-adrenal,HPA)轴分泌的糖皮质激素(adreno-cortical hormones,GC)浓度上升,GC通过影响TLR3和IL-1RAP诱导骨骼肌细胞凋亡,从而导致核因子κB(nuclear factor kappa-B,NF-κB)(为TLR3和IL-1RAP下游的转录因子)活化,此外,NF-κB还作用于半胱氨酸蛋白酶-3(caspase-3)、B淋巴细胞瘤-2(B cell leukemia/lymphoma 2,Bcl-2)和凋亡调节因子(Bcl-2 associated X,BAX)诱导细胞凋亡,从而导致肌肉的正常理化特性发生变化,最终导致肌肉品质下降。Fontagné-Dicharry等[63]在膳食氧化鱼油对虹鳟鱼氧化应激和抗氧化防御系统影响的研究中也得到了类似的结论,认为氧化鱼油对虹鳟鱼的生长性能和肝脏抗氧化酶活性没有影响,原因可能是NF-κB活性的降低。类似地,鱼类摄取不同组分和配比的饲料,也会对肌肉产生不同的影响,选择最佳的饲料配方往往能得到更高的经济效益[64]。例如饲喂400 g/kg蛋白水平饲料的草鱼具有最佳生长性能和肥满度,而长期投喂高脂肪高蛋白饲料所引起的代谢应激会导致机体脂代谢紊乱,造成脂肪变性[65]。此外,选择合适的饲料添加剂能提高动物的肌肉品质,Wei Yuting等[66]研究发现在日粮中添加南极磷虾粉显著改善了三倍体虹鳟鱼的生长性能和肌肉色素沉着,但其改善机制和内在原因还有待深究;Wang Tongxin等[67]研究发现大蒜素通过抑制肌肉糖酵解途径和增强抗氧化能力,显著提高了机体免疫力,增强机体对生长环境中应激因子的耐受性并提高肌肉品质。

图1 饲料中添加的皮质醇劣化猪肉品质的分子机制[62]Fig.1 Molecular mechanism of the effect of dietary cortisol on meat quality deterioration[62]
动物屠宰前的称质量、运输、禁食以及屠宰过程中不合理的处理方式等所引起的急性应激,会使动物产生恐惧、受到更多的痛苦,对宰后肌肉品质有较大影响,也是造成PSE肉的主要原因[68-69]。例如腺苷酸活化蛋白激酶(adenosine 5’-monophosphate (AMP)-activated protein kinase,AMPK)是应激研究中关注度较高的一个调控途径,也是影响肌肉纤维类型转化的主要信号转导途径,可调节细胞内的能量水平,当ATP被过度消耗或AMP∶ATP比值升高会激活其活性[70]。动物应激发生时,AMPK通过感知细胞能量代谢状态的变化,并通过影响多个物质代谢的环节以维持能量供求平衡[71](图2[72]),机体AMP∶ATP比值升高即能量水平降低时,机体通过肝脏激酶1和钙调素依赖蛋白激酶作用于AMPKα亚基Thr172以提高AMPK活性,从而抑制能量消耗并刺激能量的生成以改善机体的能量平衡状态。张铭灏[73]在对AMPK途径对肌肉品质影响的研究中也得到了类似的结论,其实验结果显示宰前急性热应激显著降低了宰后肌肉的品质和抗氧化性,AMPK活性的蛋白免疫验证结果显示p-AMPK过表达,即AMPK磷酸化水平升高,表明其活性在急性热应激过程中确实被激活(图3)。在鱼类的研究中也有对AMPK途径的相关报道,如Wang Congcong等[74]研究发现膳食二十二碳六烯酸通过激活AMPK途径而促进钝嘴鲷的白肌增生和肌纤维发育进而改善肌肉的质地和颜色。
鱼类的肌肉品质受多种自身和环境因素的调控,应激反应是其中较为常见且覆盖面较广的一类影响因子。鱼类在应激因子的刺激下产生应激反应时,机体的适应性反应主要是调控各组织器官内某些相关物质的代谢以改变机体所处的生理状态,使鱼体处于疲劳的亚健康状态,最终劣化鱼类的肌肉品质。
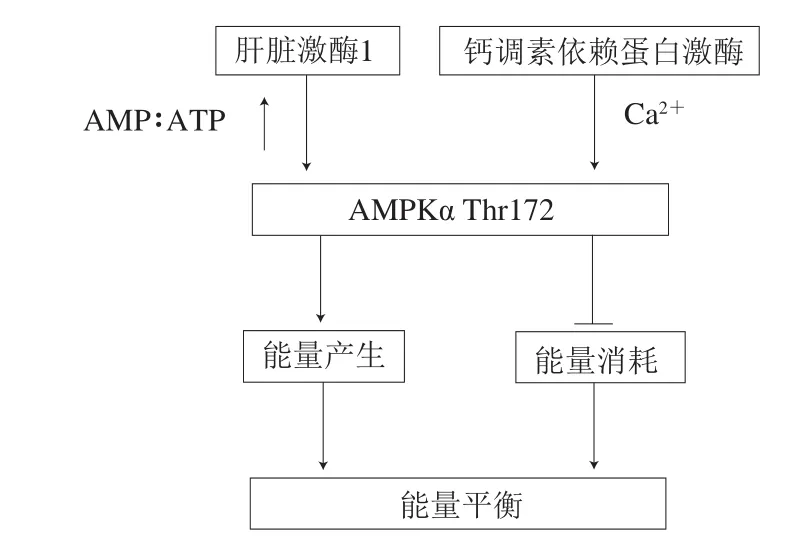
图2 AMPK的结构及能量代谢调控通路[72]Fig.2 Adenosine 5’-monophosphate (AMP)-activated protein kinase structure and energy metabolism control pathway[72]
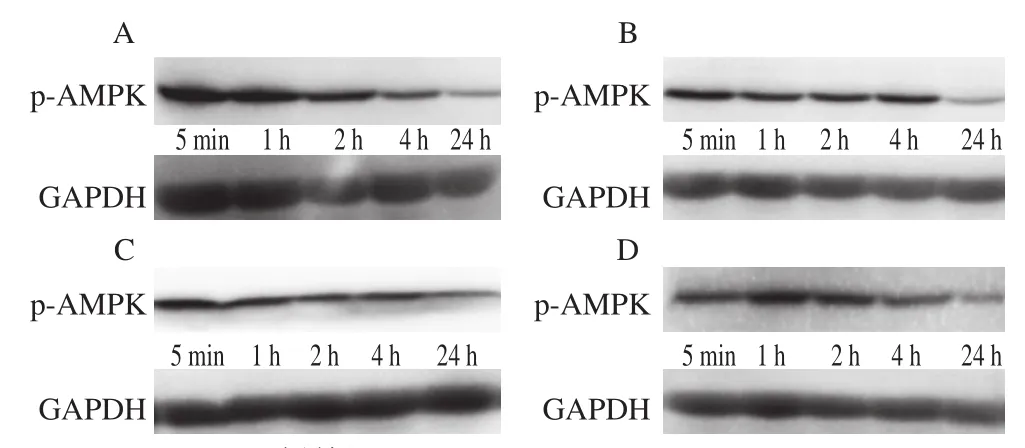
图3 宰前不同程度急性热应激对宰后AMPK活性的影响[73]Fig.3 Effects of different levels of acute heat stress before slaughter on adenosine 5’-monophosphate-activated protein kinase activity in postmortem muscle[73]
2.3 转录组学在鱼类应激研究中的应用
转录组学的概念是由Velculescu等[75]在对酵母基因表达的研究中首次提出。遗传中心法则显示遗传信息以mRNA为“桥梁”从DNA传递到蛋白质,其中全部表达的基因及其转录水平的综合被称为转录组。不同于相对稳定、分析成本较高、针对性不强的基因组,转录组检测结果会随生物发育阶段、生存环境和生理状态等的变化而不同。作为一种功能基因组学研究方法,转录组学主要依赖于微矩阵技术,通过收集并分析不同样本中全部基因的表达调控,同时结合每个基因与美国国家生物技术信息中心中各数据库比对产生的功能注释信息综合分析来解决生物学问题,揭示生物现象的本质[76]。同时,转录组本身也是一种遗传信息,其中的显著差异表达基因可作为遗传标记[77]。对于环境胁迫,转录组数据可以更准确直接地反映生物的生理变化,因此转录组学在目前的鱼类应激研究中被广泛应用[78]。
鱼类在应激状态下的基因表达会发生显著变化以满足物质代谢变化的需求,主要表现为各基因表达水平的变化,将这时的差异表达基因进行功能富集、代谢调控途径富集分析,这对深入了解鱼类的应激反应以及缓解措施的研发具有重要意义[79]。以水产养殖过程中鱼类常发生急性热应激为例,Shi Kunpeng等[80]在对大西洋鲑急性热应激的研究中对其肝脏进行了转录组分析,结果显示大西洋鲑在不同程度急性热应激反应中有22 个共同的差异表达基因,且大多数是分子伴侣,在此过程中,转录激活因子6、钙网蛋白、蛋白二硫异构酶A3、蛋白激酶R样内质网激酶-真核起始因子2-α等基因被上调,这些基因的表达产物几乎都参与内质网应激途径,其他上调基因大多参与调控胰岛素和核苷酸寡聚化域样受体信号通路以消除错误折叠的蛋白质并维持糖和脂质平衡。在这项研究中,转录组学结果揭示了大西洋鲑在急性热应激过程中显著变化的生理调控过程以及与之相关的功能基因表达水平的变化等分子机制,这对该物种急性热应激的后续研究以及缓解途径的研发提供了一定的分子基础。
目前,应用于鱼类应激反应的转录组学研究大多以鱼类疾病与免疫为主,例如Mu Yinnan等[81]通过转录组学研究发现低氧环境胁迫下的大黄鱼脾脏和头肾组织中的差异表达基因大部分与免疫反应相关,且参与调控多种与免疫相关的代谢途径,激活了厌氧ATP生成途径,并抑制了能量的过度消耗等。
3 结 语
动物的应激反应较常见且多式多样,并会显著影响动物肌肉的理化性质,在水产品的销售、运输过程中不可避免会发生,而运输过程中的急性应激反应是影响鱼类健康、决定运输成活率的主要因素,并最终影响鱼类肌肉品质。目前虽然学者们已对鱼类应激反应的各方面做了大量研究,揭示了由应激引起的一些理化指标变化的机制,并且阐明了一些物质对应激反应的调控机制,但是都比较有限,不能很好地联系成一个系统的应激生理调控网络,且少有应激对肌肉品质影响及调控途径相关的研究。未来应加强对鱼类应激和调控机理的研究,并与肌肉品质的变化相结合,挖掘多种调控途径间的内在关联,形成一个完整的应激调控模型,这将有利于寻找或开发出更具针对性的应激缓解物,以保证运输过程中鱼体的健康和获得优质的产品。

