热处理对汉麻乳稳定性的影响及蛋白结构表征
朱秀清,王子玥,李美莹,王 源,李志敏,杨宏哲,张 娜,孙冰玉
(哈尔滨商业大学食品工程学院,黑龙江省普通高校食品科学与工程重点实验室,黑龙江省谷物食品与综合加工重点实验室,黑龙江 哈尔滨 150076)
汉麻,属于大麻科[1],作为一种食物资源有着很长的历史。汉麻籽含有30%(质量分数,下同)的优质油脂和25%的优质蛋白,不溶性纤维含量约占10%~15%[2]。麻仁球蛋白和白蛋白是汉麻籽中的两种主要蛋白质,这两种贮藏蛋白容易消化,并且含有多种必需氨基酸[3]。同时汉麻籽富含VE、矿物质、抗氧化物质和纤维素[4],是一种营养丰富的理想食物来源。近几十年,随着低四氢大麻酚含量(0.3%)的工业大麻的出现,汉麻食品逐渐受到们的欢迎,汉麻食品的商业化程度也不断提高,韩国等国家的部分企业已经开始研发生产汉麻籽油、汉麻乳、汉麻面包等食品产品,利用汉麻提纯蛋白粉、抗氧化肽以及其他高附加值产品。汉麻乳饮料在国外受到热烈的追捧,有较高的营养价值、较低的过敏性,是可能替代豆奶、坚果奶的新兴饮料,将具有广阔的发展空间。
热处理是食品加工中的主要手段[5],在实际应用中热处理是蛋白饮料生产加工的重要工序。目前国内外关于汉麻乳的研究报道还相对较少,陈聪颖等[6]对汉麻乳饮料的浸泡工艺和磨浆工艺进行了研究;周超进[7]对控制汉麻蛋白饮料稳定性的添加剂配方及其贮藏稳定性进行了研究。Wang Qingling等[8]利用高压均质和pH值偏移相结合的方法维持汉麻乳的物理及氧化稳定性。而现阶段关于热处理过程中汉麻乳稳定性及其蛋白变化研究还鲜有报道。本课题组在前期研究中发现,汉麻乳在70 ℃左右就开始发生聚集,表明汉麻蛋白质易发生热聚集,汉麻乳的热加工工艺是生产中亟需解决的瓶颈问题;且汉麻乳加工热处理过程中汉麻乳聚集现象与蛋白变化有极大的相关性,表现出汉麻乳不适于高温长时间加热,同时还发现高温瞬时杀菌基本没有改变前期汉麻乳热处理的稳定状态。
本实验以汉麻乳为研究对象,选取常压加热汉麻乳聚集现象发生前后温度范围(55~95 ℃)进行热处理,采用氮溶解指数数(nitrogen solubility index,NSI)、离心沉淀率、乳化性质特性、乳液表面电位和粒径等指标监测汉麻乳热处理过程中稳定性的变化,通过傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR)表征热处理过程中汉麻乳蛋白二级结构相对含量的变化。针对前期热处理过程中汉麻乳稳定性与蛋白结构的关系展开讨论,阐释汉麻乳热处理过程中稳定性与蛋白结构变化的关系,为汉麻乳前期热加工处理提供理论参考。
1 材料与方法
1.1 材料与试剂
脱壳汉麻籽产自中国云南;大豆油购自九三粮油工业集团有限公司。
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)天津市福晨化学试剂厂;考马斯亮蓝G-250 北京索莱宝科技有限公司;硫酸铜、氢氧化钠、硫酸等化学试剂均为国产分析纯。
1.2 仪器与设备
UV759S型紫外-可见分光光度计 上海市谱光仪器有限公司;TG16-WS离心机 湘仪实验室仪器开发有限公司;PHS-25型pH计 上海仪电科学仪器股份有限公司;HH-S4型恒温水浴锅 巩义市予华仪器有限责任公司;ALPHA 1-2 LD plus型冷冻干燥机 德国CHRIST公司;Spectrum Two FTIR仪 美国PerkinElmer公司;Zetasizer Nano激光粒度分析仪 英国马尔文仪器公司。
1.3 方法
1.3.1 汉麻乳的制备及热处理
取成熟去壳汉麻籽,按料液比1∶5(m/V)进行磨浆,100 目过滤除渣,水浴加热,在一定温度(55、65、75、85、95 ℃)下保持10 min,迅速水浴冷却至室温(25 ℃),备用。未处理样品指25 ℃室温下处理未经加热的汉麻乳样品。
1.3.2 物理稳定性的测定
用离心沉淀率来表征汉麻乳的物理稳定性[9],具体测定参照姜梅[10]的方法并稍作改动。将制备好的汉麻乳样品4 ℃下保存24 h,取30 mL样品于50 mL离心管中,4 000 r/min离心25 min,称其沉淀质量,离心沉淀率按式(1)进行计算。

1.3.3 氮溶解指数的测定
NSI的测定参照郝建敏[11]的方法,并稍作改动。将样品用蒸馏水稀释10 倍,混合均匀后,将稀释液在4 000 r/min下离心15 min,用凯氏定氮法测定上清液中蛋白质含量,上清液中蛋白质含量与样品中总蛋白质含量之比为NSI。
1.3.4 乳化特性的测定
样品的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)参照Pearce等[12]的方法测定,并进行改进。取5 mL大豆油与15 mL汉麻乳混合,用高剪切乳化机在12 800 r/min下乳化2 min后倒入50 mL烧杯中,分别在0、30 min从烧杯底部取样20 μL与5 mL 0.1%的SDS溶液均匀混合,在500 nm波长处测定吸光度。EAI和ESI分别按照公式(2)、(3)计算。

式中:D为稀释倍数(250);ρ为汉麻乳蛋白质量浓度/(g/mL);φ为乳化液中油相体积分数(0.25),A0和A30分别为0 min和30 min时的吸光度;Δt表示时间差(30 min)。
1.3.5 Zeta电位的测定
Zeta电位用激光粒度分析仪测定,具体参照Shun-Tang等[13]的方法,用0.05 mol/L稀盐酸溶液将汉麻乳样品的pH值调整为6.80±0.05,稀释100 倍后,测定相应的Zeta电位。溶剂参数设定:折光系数为1.33,介电常数为78.55,黏度为1.008 7 mPa·s。
1.3.6 粒径测定
用激光粒度分析仪测定汉麻乳蛋白的粒径分布[14]。用去离子水将样品稀释100 倍,分散相的折射率为1.471,分散剂折射率为1.330。
1.3.7 FTIR图谱的测定
汉麻乳在-40 ℃条件下冷冻干燥,准确称量0.002 g冻干样,加入一定量的KBr至0.2 g,用研钵研磨成均匀粉末,压制成薄片[15]。用FTIR仪进行全波段扫描(4 000~400 cm-1),扫描次数为32。
1.4 数据处理分析
所有实验重复3 次,采用Excel软件对数据进行统计分析,结果取平均值,采用SPSS 19.0软件进行单因素方差分析,并用Origin软件绘图。
2 结果与分析
2.1 热处理对汉麻乳稳定性影响
2.1.1 热处理对汉麻乳离心沉淀率的影响
汉麻乳的离心沉淀率可以直接体现出其在热处理过程中的聚集程度。由图1可知,随着热处理温度的升高,汉麻乳的离心沉淀率逐渐增大,即热处理温度越高,汉麻乳粒子聚集程度越高,形成更多的热聚集体。热处理温度从55 ℃加热到65 ℃,汉麻乳离心沉淀率由16.58%略微上升,但当热处理温度达到75 ℃时,热处理汉麻乳离心沉淀率从65 ℃时的18.52%升高到30.06%(P<0.05),热处理温度进一步升高至95 ℃,离心沉淀率达到最大(34%)。邢霁云等[16]在对豆乳的研究中发现,随着热烫温度的提高,豆乳的离心沉淀率呈增加趋势,与本研究中汉麻乳离心沉淀率随热处理温度的变化规律相符合。汉麻乳的热聚集很可能是由于汉麻乳中蛋白分子发生热聚集,65 ℃热处理组汉麻乳中蛋白变性程度较小,进一步加热到75 ℃,汉麻乳体系内大部分蛋白发生了变性,形成了数量较多或结构较大的热聚集体。可见,随热处理温度发生变化,汉麻乳发生了不同程度的热聚集。
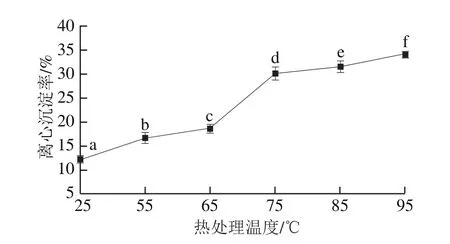
图1 热处理对汉麻乳离心沉淀率的影响Fig.1 Effect of heat treatment on centrifugal precipitation rate of hemp seed milk
2.1.2 热处理对汉麻乳NSI的影响
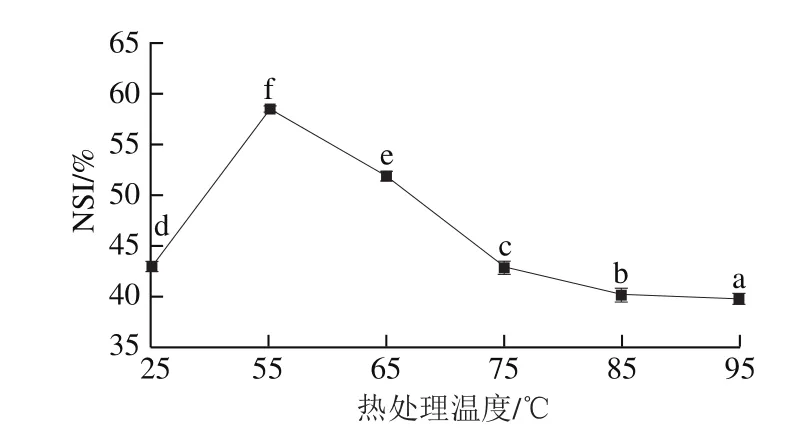
图2 热处理对汉麻乳NSI的影响Fig.2 Effect of heat treatment on NSI of hemp seed milk
NSI是可溶性蛋白占总蛋白的比例,表示蛋白质的溶解特性。从图2中可以看出,55 ℃热处理后汉麻乳的NSI最高,这表明温和热处理一定程度上会促进汉麻蛋白在水中的溶解。一方面,温和热处理使汉麻蛋白结构略微展开,增加了亲水基团暴露;另一方面,Sorgentini等[17]研究发现加热温度较低时,蛋白质易分解产生小分子可溶性物质,增加蛋白质溶解度,但加热温度较高时,蛋白质易发生变性或聚集,溶解度降低。超过55 ℃后,随着热处理温度升高,汉麻乳的NSI由55 ℃时的58.55%逐渐减小到90 ℃时的39.81%,这可能是由于随着加热温度的升高,汉麻乳体系中的蛋白质分子结构去折叠展开,其内部的疏水基团暴露出来,发生疏水性聚集,溶解度降低,此外,热处理温度进一步升高,汉麻乳中蛋白质发生变性,伸展开的蛋白质分子不断发生碰撞,在各种作用力的共同影响下相互交联形成不溶性聚集体,溶解度降低,NSI减小。与陈震东等[18]的研究结果一致。
2.1.3 热处理对汉麻乳Zeta电位的影响
Zeta电位是溶液中带电微粒双电层中剪切面的电势,通常用于对胶体稳定性的评价。Zeta电位绝对值的高低表示分子表面所带正或负电荷数量的多少,Zeta电位的绝对值越高,体系内蛋白质分子表面的电荷数量越多,存在较大的静电斥力,以维持体系处于相对稳定的状态;反之,Zeta电位的绝对值较低时,体系状态不稳定,蛋白分子易发生聚集[19]。由图3可知,随着热处理温度的升高,汉麻乳的Zeta电位绝对值先增大后逐渐减小。热处理温度为65 ℃时,Zeta电位绝对值最大,为20.57 mV。热处理温度低于65 ℃时,随温度升高,汉麻乳Zeta电位绝对值逐渐增加,粒子间的静电斥力增大,体系趋于稳定;随着热处理温度进一步升高,汉麻乳的Zeta电位绝对值逐渐减小,说明此时体系内Zeta电位绝对值减小,分子表面静电荷密度减小,静电相互作用增强,分子通过静电相互作用吸引,形成新的更大体积的聚集体。李红等[20]对不同热处理的大豆乳状液Zeta电位的研究结果与本研究相似,即55~95 ℃热处理的大豆乳状液Zeta电位绝对值随着温度升高逐渐降低,乳状液稳定性降低。

图3 热处理对汉麻乳Zeta电位的影响Fig.3 Effect of heat treatment on zeta potential of hemp seed milk
2.1.4 热处理对汉麻乳平均粒径的影响

图4 热处理对汉麻乳平均粒径的影响Fig.4 Effect of heat treatment on average particle size of hemp seed milk
蛋白质的粒径可反映出蛋白质的聚集程度[21]。如图4所示,加热温度越高,汉麻乳蛋白平均粒径越大。加热温度从55 ℃升高至65 ℃时,汉麻乳蛋白粒径由192.2 nm增加到200.4 nm(P<0.05),75 ℃热处理汉麻乳蛋白的平均粒径达到229.43 nm,显著高于65 ℃(P<0.05),形成大的聚集体,与离心沉淀率的研究结果一致。这可能是由于进一步热处理使维持蛋白体系的作用力遭到破坏,蛋白质部分变性,形成新的小聚集体,且由2.1.1节可知此时汉麻乳离心沉淀率明显增大,热聚集体含量大幅度增加。加热温度为95 ℃时,汉麻乳蛋白平均粒径大幅度提高至304.60 nm,这可能因为高温使汉麻乳蛋白发生变性,二硫键断裂后产生蛋白亚基又重新结合,在疏水作用、静电引力、范德华力等作用下形成更大的网络结构,产生粒径较大的聚集体。汉麻籽蛋白主要由麻仁球蛋白和白蛋白组成,球蛋白相对含量约为65%,汉麻球蛋白的变化决定着汉麻乳体系的变化。齐宝坤等[22]研究发现,热处理后的球蛋白具有更大的平均粒径,且随温度升高蛋白粒径进一步增大,认为较高温度的热处理利于大尺寸聚集体的形成,与本研究所得结果相吻合。
2.1.5 热处理对汉麻乳乳化特性的影响
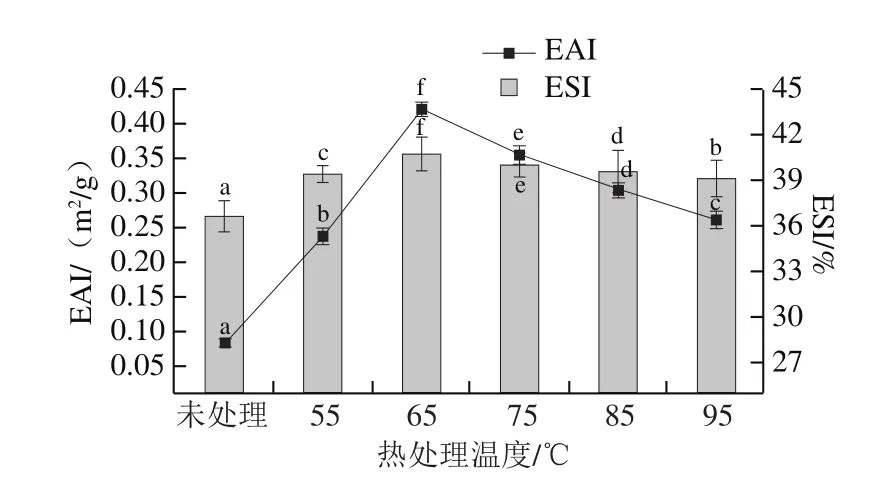
图5 热处理对汉麻乳EAI及ESI的影响Fig.5 Effect of heat treatment on EAI and ESI of hemp seed milk
由图5可知,经过不同温度热处理的汉麻乳EAI呈先增大后减小的趋势,且均高于未处理的汉麻乳。加热温度为65 ℃时,汉麻乳的EAI最高,为0.357 m2/g,可能是由于较低温度的加热过程中,随着α-螺旋的解螺旋、β-转角的打开,蛋白质结构逐渐展开,蛋白质的二级、三级结构舒展,使得链节变得十分柔顺,高的柔顺性有利于界面上分子有序重排[23],从而使得蛋白亲水亲油性增强,更容易分散在乳化界面中,导致EAI提高。此时,汉麻乳乳化性较好,维持体系的液滴以小液滴为主,体系内分子粒径较小。随着加热温度进一步升高,EAI降低,这可能与蛋白变性重新组合形成大聚集体有关。热处理后,汉麻乳的乳化稳定性得到了改善,并且随着加热温度的升高,ESI呈现先升高后降低的趋势,在65 ℃热处理条件下ESI最高(43.74%)。55 ℃热处理时,蛋白质略微伸展,变性程度较低,疏水性基团暴露程度较小,而热处理温度达到65 ℃时,疏水基团暴露更加充分,对维持乳化液体系稳定起到了一定作用。热处理温度达到75 ℃以后,舒展开的蛋白质分子重新排列形成聚集体,不能维持乳化液体系的稳定,出现聚集。
2.2 热处理后汉麻乳蛋白的二级结构表征结果
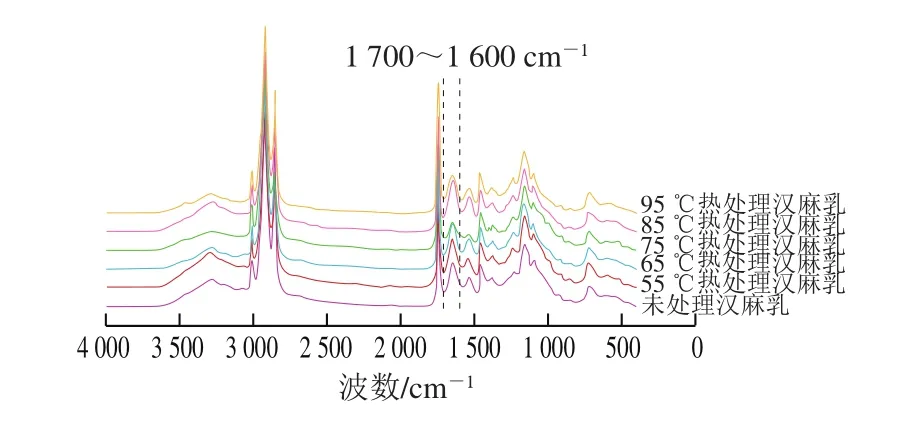
图6 不同热处理条件下汉麻乳蛋白FTIR图Fig.6 FTIR spectra of hemp seed milk protein under different heat treatment conditions
红外光谱可有效分析蛋白质二级结构的构象信息[24],如图6所示,汉麻乳蛋白在酰胺I带(1 700~1 600 cm-1)处具有较强的吸收峰,不同热处理温度下的汉麻乳蛋白在酰胺I带的特征吸收峰存在差异。酰胺I带谱峰与蛋白质二级结构之间存在着一定的对应关系,可据此对蛋白质二级结构进行定性定量分析[25]。采用PeakFit软件对酰胺I带进行分析,首先对酰胺I带进行基线校正、去卷积处理,然后进行二阶导数分峰拟合,酰胺I带中:1 610~1 640 cm-1处为β-折叠特征峰、1 640~1 650 cm-1处为无规卷曲特征峰、1 650~1 660 cm-1处为α-螺旋特征峰、1 661~1 700 cm-1处为β-转角特征峰[26],根据峰面积计算蛋白质二级结构相对含量,结果见表1。
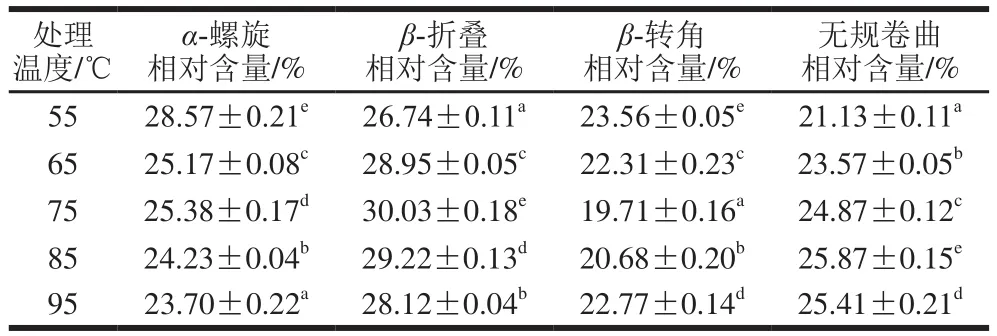
表1 热处理对汉麻乳蛋白二级结构相对含量的影响Table 1 Effect of heat treatment on the relative contents of secondary structures in hemp seed milk protein
由表1可知,随着热处理温度的升高,汉麻乳蛋白α-螺旋结构的相对含量逐渐降低,由28.57%降低到23.70%,无规卷曲结构的相对含量逐渐增大,由21.13%增加至25.41%;β-折叠结构的相对含量先增大后降低,在75 ℃时相对含量最高;β-转角的相对含量先降低后增大,在75 ℃时相对含量最低。热处理过程中,汉麻乳蛋白分子相邻肽键间的氢键遭到破坏,维持α-螺旋的氢键断裂,发生解螺旋,α-螺旋结构的相对含量降低。Chakraborty等[27]的研究也发现热处理过程中蛋白质α-螺旋结构含量降低,β-折叠结构或β-转角结构含量增加。孙佳悦等[28]在牛乳蛋白的研究中发现经热处理后α-螺旋含量显著降低(P<0.05),无规卷曲含量显著升高(P<0.05),热处理程度增强导致部分有序结构向无规卷曲结构转化,蛋白质发生热聚集现象,与本研究结果相吻合。一部分α-螺旋结构展开,蛋白质结构由有序趋向于无序,无规则卷曲结构的相对含量增加;另一部分α-螺旋结构在分子间相互作用下转换为β-折叠结构,β-折叠结构通常存在于蛋白质内部折叠区域[29],在网络结构的形成中有重要作用。随着加热温度的进一步升高,汉麻乳蛋白发生变性,形成热聚集体,由于在热聚集体分子间β-折叠结构易转变为β-转角结构[30],β-折叠结构的相对含量降低,β-转角结构相对含量增大。从汉麻乳蛋白二级结构相对含量的变化可以看出,在热处理过程中,汉麻乳蛋白先发生解螺旋、结构舒展,随着热处理温度进一步升高,在与乳液中脂质及糖类分子共同作用下,热变性的汉麻乳蛋白重新排列、相互交联,形成热聚集体。汉麻乳热聚集体的产生主要是汉麻乳中蛋白的热聚集,热处理过程中蛋白质结构的变化使其粒径、Zeta电位发生变化,导致汉麻乳离心沉淀率、溶解性、乳化活性及乳化稳定性的变化。
3 结 论
热处理过程中,温度对于汉麻乳的稳定性、蛋白结构有一定影响。在热处理温度较低时汉麻乳蛋白结构伸展,进一步加热汉麻乳蛋白发生聚合,在脂肪、多糖等大分子的共同作用下形成结构紧密的大聚集体。加热过程中汉麻蛋白结构的变化导致了汉麻乳体系性质的改变。随热处理温度的升高,汉麻蛋白α-螺旋结构的相对含量逐渐降低,无规卷曲结构的相对含量增加,蛋白质结构先伸展后聚集,汉麻乳蛋白平均粒径逐渐增大,汉麻乳离心沉淀率不断增加、NSI逐渐减小,其乳化活性和乳化稳定性表现出先增大后降低的趋势,在65 ℃时,汉麻乳乳化稳定性最强,体系Zeta电位绝对值最大。研究结果表明热处理条件对汉麻乳稳定性的影响是由于汉麻蛋白结构发生了变化,加工中选取适宜的热处理条件具有非常重要的意义,本研究结果可为汉麻乳热处理加工提供理论参考。

