超声纹理特征在三阴与非三阴性乳腺癌鉴别诊断中的价值
陈晴玉,夏建国,张 俊
0 引 言
乳腺癌是影响我国女性健康最主要的肿瘤之一,其发病率呈上升趋势。三阴性乳腺癌(triple negative breast cancer, TNBC)是一种不表达雌激素受体(estrogen receptor,ER)、黄体酮受体(progesterone receptor,PR)和人表皮生长因子-2(human epidermal growth factor receptor-2,HER-2)的亚型[1]。任何一类受体为阳性者即定为非TNBC。TNBC占全部乳腺癌的10%~27%,复发率最高,预后最差[2]。对于乳腺肿瘤诊断已有多种检查方法,如钼靶、超声、CT及磁共振等。而乳腺超声检查是诊断乳腺癌普遍而重要的手段。目前针对三阴性乳腺癌的超声研究大部分局限于常规超声特征,若能在诊断肿瘤的基础上进一步实现病理分型甚至是分子分型上的判断,则会给临床提供更多有意义的信息。分子亚型的鉴别对乳腺癌诊断治疗以及预后有非常重要的作用[3]。
Mazda是用于二维和三维图像行纹理分析的软件包。它为图像纹理的定量分析提供了一条完整的路径,包括纹理特征的计算、特征选择和提取过程、数据分类算法、各种数据可视化和图像分割工具。该软件被研究人员用于不同的应用领域,并被证明是一种有效和可靠的图像定量分析工具[4-5]。本研究旨对常规二维超声图像应用Mazda软件进行纹理分析,初步探讨乳腺癌二维超声图像的纹理特征是否能在鉴别三阴性乳腺癌与非三阴性乳腺癌中起到一定的作用。
1 资料与方法
1.1一般资料回顾性分析2015年8月至2019年7月我院收治的乳腺癌患者临床资料。其中TNBC患者35例、非 TNBC患者58例。 患者均为女性,年龄36 ~85 岁,平均(57.4±13.7)岁。纳入标准:①初发及单侧单发乳腺癌结节;②术前未接受新辅助化疗。排除标准:①肿块较大,无法显示完全边缘;②超声图像质量差;③免疫组织化学检测HER2扩增状态无法确定。
TNBC 免疫组织化学判定标准:所有标本均经石蜡包埋,SP 法检测 ER、PR 和 HER-2 的表达。 ER、PR 判定:阳性细胞数≤10%为阴性,>10%为阳性;Her-2 判定:-或+为阴性,3+为阳性,2+者需要进一步行荧光原位杂交(FISH)检测Her-2 基因的扩增状态, ER、PR、Her-2 均为阴性才为三阴性。
1.2设备与方法所有患者术前均进行超声检查,均采用迈瑞DC-8彩色多普勒超声诊断仪,L12-3E线阵探头,频率7.5 MHz。用常规方法扫查同时观察声像图特点;选取病灶显示最清晰、最完整的图像。
1.3图像处理与分析将所有患者乳腺超声图像从 PACS 工作站以BMP格式导出。首先用Matlab软件对图像进行同一化处理,以减少超声成像仪的发射能量、亮度、对比度、接收放大、深度增益、噪声、斑点等多项不恒定因素影响。将处理后的图片导入Mazda软件(http://www.eletel.p.lodz.pl/programy/mazda/index.php?action=mazda),用该软件沿肿瘤边缘手动勾画出感兴趣区(region of interest,ROI),并用红色填充。软件可自动生成灰度直方图、灰度共生矩阵、游程矩阵梯度模型、自回归模型、小波转换。ROI由同一名临床经验丰富副主任超声医师完成。观察数据的可重复性,并获取平均值(图1)。
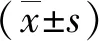
2 结 果
入组乳腺癌患者共93例,统计学分析后生成灰度直方图、灰度共生矩阵、游程矩阵梯度模型、自回归模型、小波转换共308项参数,提取其中5项最优的超声图像纹理特征参数,包括游程矩阵模型中Horzl_GLNU(水平灰度非均匀性)、Vertl_GLNU(垂直灰度非均匀性)、45dgr_GLNU(45°灰度非均匀性)、135dgr_RLNU(135°游程长度非均匀性)、135dr_GLNU(135°灰度非均匀性)。TNBC组各差异纹理参数均高于非TNBC,差异均有统计学意义(P<0.05)。见表1。
ROC曲线分析鉴别TNBC与非TNBC的纹理特征参数的阈值、灵敏度、特异度及AUC值,见表2,图2。其中以Horzl_GLevNonU阈值为268.9068时两组鉴别诊断效能最佳;通过对组间差异有统计学意义的纹理特征参数建立多参数Logistic回归诊断模型对应的灵敏度、特异性及AUC为69.3%。91.4%,0.834,结果优于单参数检测,见表2,图3。

表 1 差异有统计学意义的纹理特征参数比较
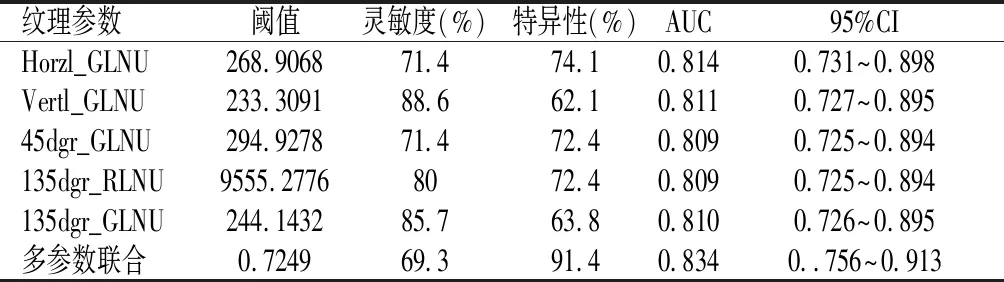
表 2 差异有统计学意义的纹理特征参数的诊断效能
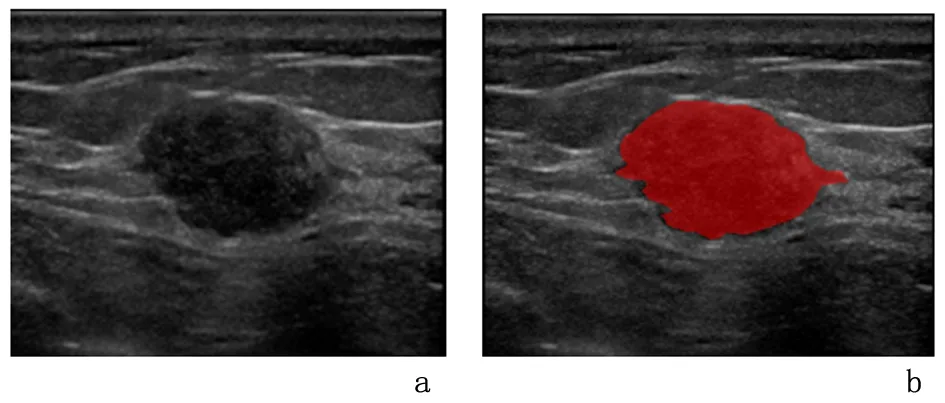
a:利用Matlab软件同一化处理后图像; b:勾画出病灶ROI(红色填充)

游程灰度不均匀度水平、垂直、45dgr、135dgr,游程长度非均匀性135dgr

图 3 纹理特征多参数联合ROC曲线
3 讨 论
对CT、MRI、超声图像进行纹理分析协助诊断是目前的研究热点[6-7]。然而基于超声图像纹理分析对TNBC诊断价值的报道却较少见。TNBC是一种不表达ER、PR、HER-2免疫组织化学标记,具有较强侵袭性的乳腺癌亚型,临床上表现为进展快,易转移、发病年龄早、病死率高,且无靶向药物治疗。术前新辅助化疗可以明显延长患者的生存时间[8]。因此,早期快速准确的诊断至关重要。
既往研究发现因TNBC恶性度高,生长较迅速,导致肿瘤内部生长速度不一,肿瘤微血管密度虽然较高,但分布不均一[9-10]。Mazda软件在对TNBC与非TNBC超声图像纹理特征对比分析中发现,灰度直方图、灰度共生矩阵,游程矩阵梯度模型、自回归模型、小波转换中多项参数具有阳性意义,其中权重参数为游程矩阵模型中Horzl_GLNU、Vertl_GLNU、45dgr_GLNU、135dgr_RLNU、135dgr_GLNU共5项超声图像纹理特征参数。5项参数联合检测曲线下面积达0.834,特异度达91.4%,诊断效能明显优于单参数检测。游程矩阵属于二阶统计参数,GLNU数值较大,说明灰度分布更不均匀;RLNU的数值较大,说明图像纹理粗细更不均匀。本研究发现相对于非TNBC组,TNBC组游程长度矩阵有差异纹理特征参数灰度分布及纹理粗细更加不均匀。这与TNBC肿块内部血供不均一,易造成的细胞坏死以及缺少纤维组织有关,同样提示TNBC肿瘤组织分化程度差,具有更大的异质性,恶性度明显高于非TNBC。Acar等[11]应用PET/CT18F脱氧葡萄糖研究乳腺癌患者纹理特征,发现TNBC癌组GLNU与RLNU的数值也是明显高于非TNBC组,与本文研究结果相似。TNBC的生物学异质性与超声纹理异质性具有一定相关性。既往研究发现不论是在相同的条件下或者在不同的条件下,相同肿块相同部位的超声纹理游程参数值具有可测量性和可重复性。不同肿块的游程矩阵所测值可用以进行相互比较[12-14]。
本研究使用计算机辅助的图像纹理分析方法。该方法最大的优势为无创,低风险;同时不增加经济负担。这种方法作为未来超声图像诊断具有巨大潜力,图像辅助纹理分析可为非浸入性诊断开辟新的道路[2,15]。乳腺肿块超声造影检查及MRI对肿瘤异质性诊断价值亦较高,超声造影显示雌激素受体阴性肿瘤的灌注参数值明显大于雌激素受体阳性肿瘤。超声造影灌注参数对雌激素受体阴性肿瘤具有较好的预测价值[16]。MR增强检查可在术前对乳腺癌的分子亚型进行初步预测[17]。图像辅助纹理分析与常规影像检查相比,可以不依赖诊断医师的个人经验提取人眼无法识别的重要纹理信息,对像素灰度分布情况进行统计学分析,客观反映病灶的异质性,达到疾病的定量诊断、分级、基因表达及预后评估的目的。
本研究的局限性:①为减少机器本身对纹理分析的影响,本研究选择了同一仪器图像,使得样本量相对较少,存在一定选择偏倚;②基于超声纹理特征的回顾性研究无法完全克服操作员对初始检查的依赖;③此处研究局限于TNBC与非TNBC的对比,后期可以从病理亚型进一步对比分析。
综上所述,超声检查具有经济、无辐射等优点,在临床诊断中得到广泛应用。超声成像设备的广泛使用使得医生需要更好的图像处理技术来进行准确的诊断;而纹理分析技术在超声图像检测中能够捕捉到像素的细微变化;本研究显示超声图像纹理分析可为三阴乳腺癌和非三阴乳腺癌的鉴别诊断提供客观依据,其中游程矩阵模型中多参数联合检测诊断效能明显优于单参数检测;乳腺癌超声纹理特征分析为临床诊治提供新的思路和方向。

