参麦注射液通过下调miR-106a保护肾小管上皮细胞NRK-52E缺氧-复氧损伤的分子机制
黄真珍,王培琦,李 冰,李晓媛
0 引 言
肾缺血再灌注(ischemia/reperfusion,I/R)损伤是外伤、手术切除和肾移植过程中的常见问题,长时间的缺血导致不可逆的肾损害[1]。I/R损伤的发病机制涉及细胞内钙超载、氧化应激、微循环障碍等多种病理过程,其中细胞凋亡导致的肾小管上皮细胞功能丧失在肾I/R损伤中起重要作用[2]。因此,如何有效预防肾小管上皮细胞凋亡对防治肾I/R意义重大。参麦注射液是由麦冬提取物和红参提取物组成的重要方剂,具有益气固脱、养阴生津之功效,广泛用于治疗心功能障碍[3]。研究发现,参麦注射液通过调控能量代谢途径能够抑制I/R诱导的异常心肌细胞凋亡在缺血性心肌病中具有保护作用[4-5]。微小RNA(microRNA,miR)-106a为miR-106a-363基因簇的成熟体miRNA,研究显示miR-106a在大鼠肾I/R损伤时表达上调,是评价急性肾损伤的潜在标志物[6]。PI3K/AKT通路参与调控细胞代谢、生长、增殖、凋亡等多种细胞过程,与肾I/R损伤的发生密切相关[7]。本研究通过构建缺氧复氧模型模拟I/R损伤,观察参麦注射液对肾小管上皮细胞NRK-52E增殖、凋亡的影响,并以miR-106a、PI3K/AKT通路为切入点探讨其保护机制,以期为参麦注射液用于肾I/R损伤提供理论依据。
1 材料与方法
1.1实验材料大鼠肾小管上皮细胞NRK-52E购于武汉普诺赛生命科技公司;DMEM培养基、胎牛血清购于美国Hyclone公司;miR-106a模拟物(miR-106a mimics)及其阴性对照(miR-NC)、抑制物(anti-miR-106a)及其阴性对照(anti-NC)、PCR引物由上海生工公司提供;LipofectamineTM2000、放射免疫沉淀测定(radioimmunoprecipitation assay,RIPA)裂解液、Trizol试剂、microRNA逆转录试剂盒购于美国Invitrogen公司;参麦注射液购于杭州正大青春宝药业有限公司;细胞计数试剂盒(Cell Counting Kit 8,CCK-8)试剂盒、购于北京索莱宝生物科技公司;膜联蛋白V-异硫氢光荧光素(Annexin V-FITC)细胞凋亡检测试剂盒购于南京凯基生物技术公司;兔源Ki67抗体、兔源裂解的半胱氨酸天冬氨酸蛋白酶3(Cleaved-caspase-3)抗体、兔源磷酸化的磷脂酰肌醇-3-羟激酶(phosphorylated Phosphatidylinositol-3-hydroxykinase,p-PI3K)、兔源磷酸化的蛋白激酶B(Phosphorylated protein kinase B,p-AKT)、兔源β-actin抗体、羊抗兔二抗购于上海艾博抗生物技术公司。SYBR green master mix购于北京天根生化科技公司。
1.2实验方法
1.2.1细胞转染取2×105个对数期NRK-52E细胞接种6孔板,待细胞融合度达到50%时进行细胞转染。首先取50 pmol的待转染物与适量无血清DMEM培养基混匀,使终体积为25 μL,记为混合物1。取1 μL的LipofectamineTM2000与24 μL无血清DMEM培养基混匀,记为混合物2。静置5 min后,将1与2混合,记为混合物3。室温静置15 min。将混合物3加入到融合度约为50%的NRK-52E细胞,6 h后更换含血清培养基,转染48 h后,收集细胞用于后续实验。
1.2.2体外缺氧-复氧模型制备参考文献[8]方法制备缺氧-复氧模型,将NRK-52E细胞培养瓶至于37℃,含1%O2、5% CO2、94% N2的三气培养箱中培养6 h,模拟缺氧后,再置于37℃、含5% CO2的培养箱中培养24 h终止实验。
1.2.3细胞培养和分组NRK-52E细胞采用含10%胎牛血清的DMEM培养基于37℃、CO2体积分数5 %的培养箱中培养。待细胞融合度达到30%时,加入胰酶消化,按照1∶4比例传代。取第5代细胞进行实验。用含不同浓度(0.1、0.5、2.5 μmol/L)参麦注射液的DMEM培养液培养30 min(37 ℃,5% CO2)后进行体外缺氧-复氧(6 h/24 h)实验;非参麦注射液干预组继续于含10%胎牛血清的DMEM培养基中培养30 min(37℃,5% CO2),CCK-8法检测显示参麦注射液以浓度依赖方式增加NRK-52E细胞活力,后续选择2.5 μmol/L参麦注射液进行实验。实验分为正常对照组、I/R组、参麦+I/R组,缺氧-复氧6 h/24 h时收集细胞用于后续检测。miR-NC、miR-106a mimics、anti-miR-NC、anti-miR-106a转染至NRK-52E细胞后,进行缺氧复氧处理,记为miR-NC+I/R组、miR-106a+I/R组、anti-miR-NC+I/R组、anti-miR-106a+I/R。miR-NC、miR-106a mimics分别转染至NRK-52E细胞中用2.5 μmol/L参麦注射液处理30 min,而后进行缺氧复氧处理,记为参麦+miR-NC+I/R组、参麦+miR-106a+I/R组,缺氧-复氧6 h/24 h时收集细胞用于后续检测。
1.2.4CCK-8法检测细胞活力收集各组细胞,制备单细胞悬液,按照5×103个/孔接种96孔板,贴壁后,每孔添加10 μL的CCK-8试剂,培养箱继续孵育4 h。空白孔调零后,酶标仪检测450 nm处各孔的光密度(A)值。
1.2.5流式细胞术检测细胞凋亡收集各组细胞,用1×上样缓冲液制备浓度为1×105个/mL的单细胞悬液。取500 μL细胞悬液,分加入5 μL的Annexin V-FITC,5 μL的碘化丙啶(propidium iodide,PI)染色,避光孵育15 min混匀,上机检测各组细胞凋亡率。
1.2.6Western blot检测Ki67和Cleaved-caspase-3蛋白表达收集各组细胞,加入RIPA裂解液提取细胞总蛋白。按照二喹啉甲酸试剂盒说明书进行蛋白定量。蛋白样品与上样缓冲液混合变性后,取30 μg上样进行聚丙烯酰胺凝胶电泳,蛋白分离后,采用常规湿法转膜方法将分离的蛋白转移到硝酸纤维素膜,5%脱脂牛奶室温封闭膜1 h,洗膜后加入1∶500稀释的Cleaved-caspase-3一抗、1∶500稀释Ki67一抗的溶液4 ℃封闭过夜;再次洗膜后加入1∶2000稀释的二抗室温孵育膜1 h。洗膜后,进行化学发光显色,凝胶图像处理系统扫描分析各目的条带灰度值。以目的蛋白和内参β-actin灰度值比值表示目的蛋白相对表达水平。
1.2.7实时荧光定量PCR(RT-qPCR)检测miR-106a表达水平使用Trizol试剂提取各组细胞总RNA,microRNA逆转录试剂盒逆转录成cDNA。以cDNA为扩增模板,利用SYBR green master mix配置20 μL反应体系,进行RT-qPCR扩增。反应条件为:95 ℃ 5 min;95 ℃ 15 s, 60 ℃ 1 min,40个循环。以U6为内参,2-ΔΔCt方法分析miR-106a的相对表达水平。miR-106a上游引物5'-GCGGCGGAAAAGTGCTTACAGTG-3',下游引物5'-ATCCAGTGCAGGGTCCGAGG-3';U6上游引物5'-GTGCTCGCTTC GGCAGCACATATAC-3',下游引物5'-AAAAATATGGAACGCTCACGAATTTG-3'。
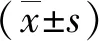
2 结 果
2.1参麦注射液对肾小管上皮细胞NRK-52E凋亡的影响与正常对照组比较,I/R组NRK-52E细胞活力、Ki67蛋白表达显著降低,凋亡率、Cleaved-caspase-3蛋白表达显著升高(P<0.05);与I/R组比较,参麦+I/R组NRK-52E细胞活力、Ki67蛋白表达显著升高,凋亡率、Cleaved-caspase-3蛋白表达显著降低(P<0.05)。见图1,表1。
2.2参麦注射液对miR-106a表达的影响I/R组NRK-52E细胞miR-106a的表达水平(3.27±0.25)较正常对照组(1.00±0.08)和参麦+I/R组(1.53±0.08)显著降低(P<0.05)。
2.3miR-106a对肾小管上皮细胞NRK-52E活性和凋亡的影响与miR-NC+I/R组比较,miR-106a+I/R组NRK-52E细胞miR-106a的表达水平显著升高,细胞活性、Ki67蛋白表达显著降低,细胞凋亡率、Cleaved-caspase-3蛋白表达显著升高(P<0.05);与anti-miR-NC+I/R组比较,anti-miR-106a+I/R组NRK-52E细胞miR-106a的表达水平显著降低,细胞活性、Ki67蛋白表达显著升高,细胞凋亡率、Cleaved-caspase-3蛋白表达显著降低(P<0.05)。见表2,图2。

1:正常对照组; 2:I/R组; 3:参麦+I/R组

表 1 参麦注射液对肾小管上皮细胞NRK-52E活性和凋亡的影响

1:miR-NC+I/R组; 2:miR-106a+I/R组; 3:anti-miR-NC+I/R组; 4:anti-miR-106a+I/R组

表 2 miR-106a对肾小管上皮细胞NRK-52E活性和凋亡的影响
2.4上调miR-106a可以逆转参麦注射液对肾小管上皮细胞NRK-52EI/R损伤的影响与参麦+miR-NC+I/R组比较,参麦+miR-106a+I/R组NRK-52E细胞miR-106a表达显著升高,细胞活性、Ki67蛋白表达显著降低,细胞凋亡率、Cleaved-caspase-3蛋白表达显著升高(P<0.05)。见表3,图3。

表 3 miR-106a逆转参麦注射液对肾小管上皮细胞NRK-52EI/R损伤的影响

1:参麦+miR-NC+I/R组; 2:参麦+miR-106a+I/R组
2.5PI3K/AKT信号通路相关蛋白的表达与正常对照组比较,I/R组NRK-52E细胞p-PI3K、p-AKT蛋白表达水平显著降低(P<0.05);与I/R组比较,参麦+I/R组NRK-52E细胞p-PI3K、p-AKT蛋白表达水平显著升高(P<0.05);与参麦+miR-NC+I/R组比较,参麦+miR-106a+I/R组NRK-52E细胞p-PI3K、p-AKT蛋白表达水平显著降低(P<0.05)。见表4,图4。

1:正常对照组; 2:I/R组; 3:参麦+I/R组; 4:参麦+miR-NC+I/R组; 5:参麦+miR-106a+I/R组

表 4 PI3K/AKT信号通路相关蛋白的表达
3 讨 论
参麦注射液对是国家食品药品监督管理总局批准的一种中药注射剂,具有改善微循环、抗凝、修复保护心肌细胞以及化疗增效减毒作用,广泛应用于休克、扩张型冠心病、慢性肺心病、病毒性心肌炎和癌症的治疗[9-11]。研究显示,参麦和丹参注射液联用能够抑制线粒体通透性转变孔的开放,保护心肌细胞免受缺氧/复氧和过氧化氢诱导的损伤[12]。参麦注射液可抑制p38丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)的活化,提高B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)与Bcl相关X蛋白(Bcl-associated X protein,Bax)的比值阻止细胞凋亡,从而保护肠I/R时所致的肺损伤[13]。本研究利用缺氧复氧诱导的肾小管上皮细胞NRK-52E损伤模型,探讨丹参注射液对肾小管上皮细胞IR损伤的影响机制。缺氧复氧诱导后NRK-52E细胞活力减弱,凋亡增加,Cleaved-caspase-3表达增加,Ki67表达降低。Cleaved-caspase-3是细胞凋亡执行蛋白caspase-3的活化形式,其激活将引起不可逆的细胞凋亡[14]。Ki67是维持细胞增殖的核蛋白,其表达水平是反应细胞增殖能力的重要指标[15]。参麦注射液处理可部分恢复NRK-52E细胞活力和Ki67表达,降低Cleaved-caspase-3表达和细胞凋亡率,说明参麦注射液能够减轻缺氧复氧诱导的NRK-52E细胞损伤。
miR-106a是一种内源性非编码RNA,其通过靶向下游靶mRNA发挥翻译抑制作用,已被证实与多种肾疾病有关。研究显示,肾细胞癌患者中血清中miR-106a水平升高,术后血清miR-106a水平降低,是肾细胞癌诊断潜在分子标志物[16]。脂多糖(lipopolysaccharide,LPS)诱导的肾小管上皮细胞中miR-106a表达上调,抑制miR-106a通过靶向血小板反应蛋白2(hrombospondin 2,THBS2)可减轻LPS诱导的细胞凋亡和炎症反应[17]。本研究发现缺氧复氧诱导后NRK-52E细胞miR-106a表达水平升高,而参麦注射液处理可降低miR-106a表达水平,提示参麦注射液对NRK-52E细胞缺氧复氧损伤的保护作用可能是通过下调miR-106a表达实现的。进一步研究发现下调miR-106a表达可提高细胞活力,抑制细胞凋亡,减轻缺氧复氧诱导NRK-52E细胞损伤,而上调miR-106a表达则降低细胞活力,促进细胞凋亡,加剧缺氧复氧诱导NRK-52E细胞损伤。此外,上调miR-106a还可逆转参麦注射液对缺氧复氧诱导NRK-52E细胞活力和凋亡的影响,这进一步说明参麦注射液对NRK-52E细胞缺氧复氧损伤的保护作用与下调miR-106a表达有关。
有报道称,PI3K/AKT通路激活可抑制炎症因子释放,降低肾组织氧化应激水平,减少肾小管细胞凋亡,是改善肾I/R损伤的潜在靶点[18-19]。本研究发现,缺氧复氧诱导后NRK-52E细胞PI3K/AKT通路受到抑制,而参麦注射液处理可激活PI3K/Akt通路,上调miR-106a可逆转参麦注射液对PI3K/Akt通路的影响,说明参麦注射液可能通过下调miR-106a表达激活PI3K/AKT信号通路进而保护NRK-52E细胞缺氧复氧损伤。
综上所述,参麦注射液可促进肾小管上皮细胞增殖,抑制细胞凋亡,保护缺氧-复氧诱导的细胞损伤,其机制可能与抑制miR-106a表达进而激活PI3K/AKT信号通路有关,这为参麦注射液用于防治肾I/R损伤奠定了理论基础。

