MLN4924导致的成熟脂肪细胞衰老促进乳腺癌细胞的迁移与侵袭
李 雪,隆玉雪,田雨鑫,刘再强,王雪晗,李雪森
0 引 言
国际癌症研究机构发布数据显示2020年乳腺癌新发病率在中国乃至全球女性中位居第一[1]。无论是作为主要的乳腺癌治疗手段还是辅助治疗措施,化疗都在乳腺癌的治疗中占据着重要的位置[2]。Neddylation修饰是将神经前体细胞表达发育性下调因子8(neural precursor cell expressed, developmentally downregulated 8,NEDD8)共价耦联到底物蛋白上的特异性修饰过程,在人乳腺癌中呈中高度活化,并与其不良预后明显相关[3],是一个潜在的抗癌药物靶点[4]。MLN4924是Neddylation过程的高效抑制剂,是一种新型化疗药物,目前已进入多种实体恶性肿瘤和血液癌症的临床试验[5]。最近研究显示,BRCA1野生型和突变型的三阴性乳腺癌对MLN4924显示出高度敏感性[6]。
细胞衰老是一种细胞周期永久停滞的状态,通常与p53-p21、p16-Rb通路相关。除了不可逆的细胞周期停滞,细胞衰老还伴随着基因表达的大量变化,其中白细胞介素-6(interleukin ,IL-6)、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、基质金属蛋白酶(matrix metalloproteinases,MMPs)等细胞因子分泌增加,称为衰老相关分泌表型(senescence-associated secretory phenotype,SASP)[7]。化疗是触发衰老的因素之一,癌症及其治疗可能会加速年轻患者的衰老,在青少年癌症患者中,不少化疗后的癌症幸存者会伴有早衰症状,这表现为与年龄不相符的运动能力丧失、认知功能下降,以及年龄相关的慢性疾病的提早发生[8-9]。MLN4924处理小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)可诱导衰老表型特征,其表现为细胞形态增大、变平以及SA-β-gal阳性染色[10]。
目前化疗药物致细胞衰老的研究大都集中在干细胞、成纤维细胞及癌细胞等可增殖细胞,鲜有关注终末分化的功能性体细胞,例如脂肪细胞、肌细胞等。肥胖与 13 种癌症患病风险增加及更差的预后明显相关[11]。乳腺癌与脂肪细胞的关系非常密切,脂肪细胞在构成乳房组织的细胞中所占比例最大,直接参与了乳腺癌微环境的构成且可通过分泌大量脂肪因子以旁分泌和内分泌的方式影响乳腺癌的进展[12],而衰老的脂肪细胞具有更强的分泌功能,这些被改变的内分泌信号可能会破坏肿瘤微环境局部代谢稳态,在乳腺癌的进程中发挥积极作用。
本研究中,我们发现MLN4924能够导致成熟脂肪细胞的衰老,并进一步研究了衰老的脂肪细胞对乳腺癌细胞增殖、迁移和侵袭的影响。
1 材料与方法
1.1材料成人脂肪间充质干细胞,人脂肪间充质干细胞完全培养基,成脂诱导分化培养基(A液+B液)(赛业生物科技有限公司);高糖DMEM培养基(美国Hyclone公司);胎牛血清(杭州四季青公司);MDA-MB-231,T47D,MCF-7(中国科学院上海细胞库);Transwell小室(美国Corning公司);单克隆抗体Nedd8,p53,p21,p16,Rb(美国CST 公司), E-Cadherin,Vimentin,Fibronectin,MMP2,MMP9,GAPDH(Proteintech公司)。
1.2成人脂肪细胞的分化按照公司所给的标准操作流程将第5-8代的成人脂肪间充质干细胞培养于6孔板中,用于分化和实验。干细胞完全培养基培养至完全融合并继续培养2 d后,加入诱导培养基A液培养72 h,换B液培养24 h,交替6~7个循环。整个诱导过程中,以开始诱导为第0天,第3天开始出现脂滴,第15天90%左右的细胞中都有脂滴出现,随着诱导时间的增加,第25~30天时,脂肪细胞中已无未分化或低分化的干细胞存在,则完全分化成熟,用油红O染液按标准操作流程染色以确定脂肪细胞分化成熟,随后开始加药处理和后续实验。
1.3成熟脂肪细胞的处理将分化成熟的脂肪细胞分为4个组:3天对照组(DMSO处理72 h),3天Mln组(Mln4924处理72 h),6天对照组(DMSO处理72 h,无药培养基中继续维持72 h),6天Mln组(Mln4924处理72 h,无药培养基中继续维持72 h)。具体加药方案:向分化成熟的脂肪细胞中加入2 μmol/L的MLN4924或等量DMSO处理72 h,收集细胞并标记为3天对照组和3天Mln组。或弃去加药培养基并用PBS洗净残留的药物,加无血清高糖DMEM培养基继续培养72 h,收集脂肪细胞并标记为6天对照组和6天Mln组,同时收集脂肪细胞上清,并将此上清作为乳腺癌细胞的条件培养基。用6天对照组和6天Mln组的脂肪细胞条件培养基培养癌细胞48 h,并将处理后的癌细胞标记为对照组和Mln组,以检测其对乳腺癌细胞的影响。所有细胞均置于5% CO2,37 ℃恒温的细胞孵育箱中培养。
1.4荧光定量PCR(qPCR)检测使用Trizol试剂从细胞中提取总RNA,使用逆转录试剂盒(Roche公司)合成cDNA进行qPCR实验。以下是从Universal Probe Library(Roche公司)中匹配引物和荧光探针,所有的引物序列及其探针号(TGF-β-F:5'-actactacgccaaggaggtcac-3',TGF-β-R:5'-tgcttgaacttgtcatagatttcg-3',#31。TNF-F:5'-cagcctcttctccttcctgat-3',TNF-R:5'-gccagagggctgattagaga-3',#29。GAPDH-F:5'-agccacatcgctcagacac-3',GAPDH-R:5'-gcccaatacgaccaaatcc-3',#60 。CCL2-F:5'-agtctctgccgcccttct-3',CCL2-R:5'-gtgactggggcattgattg-3',#40。IL-6-F:5'-gatgagtacaaaagtcctgatca-3',IL-6-R:5'-ctgcagccactggttctgt-3',#40。MMP1-F:5'-gctaacctttgatgctataactacga-3',MMP1-R:5'-tttgtgcgcatgtagaatctg-3',#7。MMP2-F:5'-ccccaaaacggacaaagag-3',MMP2-R:5'-cttcagcacaaacaggttgc-3',#43。)
1.5β-半乳糖苷酶染色(senescence-associatedβ-galactosidase,SA-β-gal染色) 将处理后的的脂肪细胞用固定液固定30 min,PBS洗3遍,加入SA-β-gal 染液,配方参照文献[13],置于37 ℃孵育3 h。随机选择10个视野拍照,绿色细胞为SA-β-gal 染色阳性细胞,Hoechst 33342染核计算总细胞数,并计算阳性细胞率。
1.6Westernblot检测用含有蛋白酶抑制剂的细胞裂解液裂解细胞,用BCA法测定蛋白质浓度。蛋白以40 μg上样量按标准方法进行SDS-PAGE和免疫印迹分析。
1.7细胞增殖实验将MDA-MB-231、T47D、MCF-7培养于添加了10%胎牛血清的DMEM高糖培养基中,按3000个细胞/孔铺至96孔板中,24 h后换成1.2.1中收集的条件培养基培养48 h,加入CCK8置于培养箱中孵育2 h,在450 nm波长测量吸光值。
1.8Transwell迁移和侵袭实验迁移和侵袭实验分别使用不包被和包被Matrigel的8.0 μm膜孔的Transwell小室,在下室中加入750 μL脂肪细胞条件培养基,上室中加入8×105个MDA-MB-231细胞,培养48 h后,用棉签清除上室中的细胞并用结晶紫染色,在显微镜下拍照记录细胞穿过膜的情况。随后用33%的冰乙酸洗脱着色的结晶紫,于570 nm处测吸光值,作为细胞迁移与侵袭的定量结果。
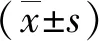
2 结 果
2.1MLN4924导致成熟脂肪细胞衰老与6天对照组相比,6天Mln组脂肪细胞中Cullin-1这一代表性Nedd8修饰蛋白的修饰受到明显抑制,见图1。衰老酶SA-β-gal染色的结果显示,6天Mln组中被染成绿色的脂肪细胞(SA-β-gal阳性细胞率11.71%)明显多于6天对照组(2.98%)(P<0.05),见图2。

1:6天对照组;2:6天Mln组

图 2 镜下观察细胞衰老(SA-β-gal染色 ×400)
2.2MLN4924通过p53-p21途径诱导脂肪细胞衰老Western blot的结果显示,6天Mln组脂肪细胞中p53、p21蛋白的表达明显增加(P<0.01),p16的表达降低(P<0.01),视网膜母细胞瘤(Rb)表达差异无统计学差异(P>0.05),见图3。
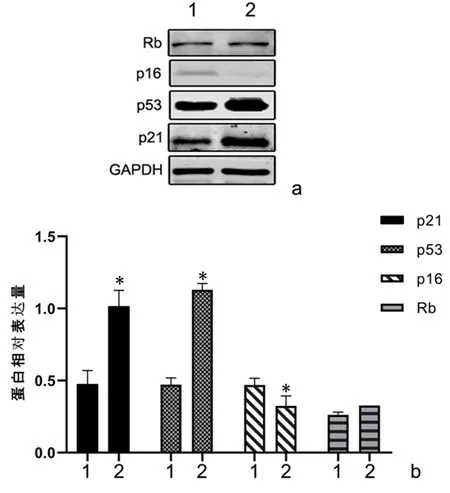
1:6天对照组;2:6天Mln组
2.3衰老的成熟脂肪细胞炎症因子分泌增加不管是3天Mln组还是6天Mln 组,炎症因子IL-6、TGF-β、TNF-α、CCL2及基质金属蛋白酶MMP1、MMP2 mRNA水平皆上调(P<0.05),见表1。ELISA结果也显示,MLN4924处理之后的脂肪细胞分泌到培养基中的炎症因子IL-6和TGF-β明显增加(P<0.05),见表2。

表 1 Mln4924促进成熟脂肪细胞衰老相关炎症因子表达上调

表 2 MLN4924促进成熟脂肪细胞中TGF-β和IL-6分泌增加
2.4衰老的脂肪细胞促进乳腺癌细胞的迁移与侵袭从Transwell迁移和侵袭实验结果中,均可以观察到Mln组被结晶紫染成紫色的细胞数量明显高于对照组,即Mln组穿过膜的MDA-MB-231细胞更多,见图4。结晶紫染色经洗脱后测量吸光度,差异具有统计学意义(P<0.01),见表3。但衰老的脂肪细胞对于乳腺癌细(MDA-MB-231,T47D,MCF-7)的增殖影响无统计学意义(P>0.05),见表4。

a、b:对照组、Mln组的迁移; c、d:Mln组的侵袭

表 3 Transwell结晶紫染色洗脱后的测量值
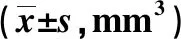
表 4 衰老脂肪细胞对乳腺癌细胞增殖的影响
2.5衰老的脂肪细胞促进乳腺癌细胞的EMT过程在衰老的脂肪细胞中,观察到6天Mln组较6天对照组MMP2和MMP9蛋白表达的显著升高(P<0.01),见图5。在条件培养基培养48 h后的MDA-MB-231细胞中,观察到Mln组的 E-cadherin较对照组明显下调(P<0.01),而Vimentin和Fibronectin上调(P<0.01),见图6。同样条件培养基培养的T47D和MCF-7细胞中,也观察到 E-cadherin的下调,但并未检测到Vimentin和Fibronectin的表达,见图7,可能由于这两种低转移性的乳腺癌细胞间充质特征蛋白表达极低。

1:6天对照组;2:6天Mln组

1:对照组;2:Mln组

1:对照组;2:Mln组
3 讨 论
本研究主要报道了由MLN4924导致的衰老脂肪细胞对乳腺癌细胞的促迁移和侵袭作用。
关于化疗药物致衰老的研究已经有很多相关报道,在乳腺癌患者中使用蒽环类药物和烷化剂治疗,会以p16INK4a依赖、端粒不依赖的方式持久地导致细胞衰老[14]。在p16-3MR小鼠模型中,使用多柔比星(Doxorubicin)可以诱导其皮肤、肺、肝等各个组织的衰老[15]。新型化疗药物MLN4924作为Neddylation修饰通路中的NEDD8活化酶(NEDD8-activating enzyme,NAE)抑制剂,可以特异性阻断NEDD8与Cullin底物蛋白的共价耦联,导致Cullin-RING泛素连接酶 功能失活,诱导DNA损伤、细胞周期阻滞、细胞凋亡或衰老,从而发挥其抗肿瘤效应[3]。临床前实验表明,MLN4924不管是单独使用还是联合其他化疗药物使用都显示出明显的抗肿瘤效果及良好的安全性、耐受性[16-18]。目前MLN4924等化疗药物致衰老的研究大都集中在可增殖细胞,例如MLN4924可以导致人肺癌细胞(H1299),人神经胶质瘤细胞(U87)及MEF细胞的衰老[19],但这些化疗药物在成熟的脂肪细胞中是否导致衰老,目前尚未有文章报道。本研究用MLN4924处理诱导成熟的脂肪细胞观察到了与其他细胞相似的衰老表型,包括SA-β-gal阳性细胞增多,p53,p21蛋白的上调以及SASP相关因子分泌增加。衰老通常由p53-p21和p16-Rb肿瘤抑制通路启动和维持,在我们的研究中发现MLN4924导致的衰老脂肪细胞中p53-p21蛋白水平上调,而p16-Rb蛋白水平没有发生变化。MLN4924作为NAE的抑制剂,会导致NEDD8-E3连接酶失活,使得其底物蛋白的p21,p53发生累积[20-21]。这与我们在脂肪细胞中观察到的结果是一致的。
脂肪细胞在乳腺癌进展中扮演着重要角色,临床数据显示肥胖的绝经后妇女患乳腺癌的几率更高,并且与乳腺癌的临床预后相关[22]。脂肪细胞可通过分泌脂肪因子以旁分泌和内分泌的形式影响乳腺癌。脂肪因子目前已知有600多种不同类型,其中最著名的是IL-6、TNF-α、瘦素、脂联素和肝细胞生长因子。乳腺癌细胞有这些脂肪因子的受体,脂肪因子通过这些受体在细胞中产生作用[11]。IL-6可以促进脂肪细胞和乳腺癌细胞中芳香化酶的表达和雌激素的合成,激活MAPK通路,诱导乳腺癌细胞迁移。高水平的IL-6与更差的乳腺癌预后呈正相关[11]。TNF-α通过增加脂肪组织中芳香化酶和IL-6的表达来增加雌激素的合成[23],并通过ERK1的激活在乳腺癌细胞系中诱导IL-6的合成[24]。MMP-2和IL-6的高表达是乳腺癌细胞中瘦素促进EMT发生的必要条件[25]。在我们的研究中也观察到MLN4924处理后的脂肪细胞中TNF-α和IL-6的高表达,除此之外,衰老的脂肪细胞中TGF-β、CCL2、MMP1、MMP2、MMP9的表达也明显上调。MMPs是一类EMT的启动分子,它通过蛋白水解降解细胞外基质,从而促进肿瘤细胞的迁移与侵袭。抑制MMP-2和MMP-9可以减少视网膜母细胞瘤体外模型中的细胞迁移和血管生成[26]。这些衰老脂肪细胞促肿瘤细胞因子的高表达,可以解释我们观察到的乳腺癌细胞迁移和侵袭的增加。
在我们的实验中,为了共培养观察衰老脂肪细胞对乳腺癌细胞增殖、迁移和侵袭的影响,我们在培养脂肪细胞72 h后,将培养基更换为不含药的新鲜培养基以收集乳腺癌细胞条件培养基。不管是Mln处理72 h还是Mln处理72 h后更换无药培养基继续培养72 h,Mln组IL-6、TGF-β、CCL2、MMP1、MMP2等炎症因子的表达都明显高于对照组,表明Mln处理后的脂肪细胞引起的衰老相关炎症因子表达上调的现象是稳定存在的。此外,在条件培养基培养后的MDA-MB-231、T47D、MCF-7中,我们观察到了E-cadherin表达的下调及MDA-MB-231中Vimentin、Fibronectin表达的上调,进一步从分子层面证明Mln组促乳腺癌迁移和侵袭作用。但实验中我们并未观察到条件培养基对这3种乳腺癌细胞的促增殖作用,说明Mln条件培养基处理组的MDA-MB-231穿过膜的细胞数量显著多于对照是由于癌细胞迁移和侵袭能力增强引起的而与穿过膜的细胞增殖差异无关。在我们实验中观察到的衰老细胞促肿瘤迁移和侵袭的现象与Campisi等[15]的研究是一致的,在p16-3MR小鼠脂肪垫中注射MMTV-PyMT细胞,然后手术切除肿瘤并联合使用多柔比星和衰老细胞清除剂ABT-263治疗或化疗后使用更昔洛伟选择性去除p16Ink4a阳性衰老细胞的小鼠显示出延迟的肿瘤复发和转移。因此,在MLN4924的临床实验和研究中,联合衰老细胞清除剂的使用也是一个值得思考的方向。
总之,我们的研究表明MLN4924通过p53-p21途径导致成熟脂肪细胞的衰老,衰老的脂肪细胞可能通过上调的炎症因子的表达和分泌促进乳腺癌细胞的EMT过程,并增强其迁移与侵袭能力。

