自噬在肠大部分切除术后残余肠管黏膜损伤中的作用
蔡忠良,梁 磊,王晨阳
0 引 言
短肠综合征(short bowel syndrome, SBS)主要是由于肠大部切除术(massive bowel resection, MBR)引起的营养吸收不良,残余肠管不足以维持机体的营养需求导致患者体重持续下降[1]。该病患者往往需要长期依赖肠外营养得以生存,而导管相关的脓毒血症和肠外营养相关的肝损伤等严重并发症是患者死亡的主要原因。残余肠管经过一段时间的代偿后,肠道吸收面积和能力增加,伴随着肠道微绒毛高度增加以及隐窝细胞的增殖加快,此过程称之为肠适应[2]。残余肠管的肠适应过程仍是目前决定SBS患者营养和吸收不良的主要决定性因素,因此对残余肠管功能恢复的研究有可能为SBS患者提供新的治疗思路及靶点。
不同于细胞凋亡,自噬是进化而来以维持细胞内稳态的一种保守现象。大多数情况下,自噬抑制凋亡启动,程序性地保护细胞存活,然而在特定情况下,过度表达的自噬可启动类似于细胞凋亡和坏死的Ⅱ类程序性细胞死亡[3-4]。目前,关于MBR残余肠管中的自噬现象仍知之甚少,本研究的主要目的是探讨自噬在MBR后早期残余肠管黏膜损伤形成过程的作用及可能机制。
1 材料与方法
1.1实验动物雄性Sprague-Dawley大鼠30只,体质量为300~350 g,购自东部战区总医院比较医学科,动物许可证号:[SYXK(军)2017-0037]。动物饲养严格按照SPF级动物饲养标准执行,饲养于12 h白昼/黑夜交替的恒温室,自由进食进水。实验处理前,大鼠适应性喂养1周以上。本实验经东部战区总医院动物实验伦理委员批准(批准号:2019JLHGKJDWLS-110),并按照国家实验动物相关准则实施。
1.2研究方法
1.2.1动物分组实验动物随机分为2组:假手术组及MBR组,在实验过程中死亡的动物不纳入研究,每组12只。
1.2.2动物模型建立SBS动物模型均参照之前的实验研究实施[5]。动物术前常规禁食16 h,使用戊巴比妥钠(40 mg/kg, 腹腔注射)实施麻醉。手术行腹部正中纵行切口,进腹后确认屈氏韧带以及回盲部的位置并做好标记。MBR组:切除约80%小肠肠管,保留大约10 cm末端回肠和5 cm近端空肠,残余肠管在显微镜下行端端吻合重建。假手术组:在距屈氏韧带20 cm 处横断肠管后用7-0缝合线在显微镜下行端端吻合。在关腹前注射10 mL温等渗盐水用于术后的液体复苏,术后常规禁食24 h,待术后第2天开始正常进食进水。根据实验的要求在不同的时间点进行取材,动物在麻醉下采用颈椎脱臼法处死,处死后开始取材,每个大鼠均取固定位置的空肠和回肠组织。
1.2.3组织病理学评分通过HE染色评估MBR后的黏膜损伤情况。肠道组织经过固定、处理并制成石蜡切片,切片依次用苏木精和伊红染液染色。经各级浓度乙醇脱水并封固后镜下观察并拍照分析结果。肠道黏膜损伤使用Chius′评分,分值越高提示损伤程度越严重[6]。
1.2.4WesternblotWestern blot测定自噬相关蛋白(LC3、P62)的表达变化,分别在术后8、16、24、72 h取材[7]。肠组织加入裂解液并经1200 r/min,离心半径7.45 cm、离心5 min后,提取蛋白,蛋白经SDS-PAGE电泳后转移至PVDF膜上。转移完成后加入一抗并在4℃下缓慢摇动孵育过夜,所需抗体如下:LC3 (1∶1000, Thermo Scientific),ATG5 (1∶500, Santa Cruz), BECN-1(1∶400, Santa Cruz), P62 (1∶500, Santa Cruz),β-actin (1∶2500, Santa Cruz)。二抗孵育后,经化学发光、显影以及定影,使用凝胶图象分析:将胶片进行拍照,并用凝胶图象处理软件分析蛋白表达差异。
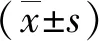
2 结 果
2.1MBR大鼠生存率分析MBR大鼠术后16 h出现死亡,随时间延长,死亡动物逐渐增多,至72 h死亡率达50%,术后88 h死亡率为100%。见图1。

图 1 MBR大鼠的生存分析
2.2MBR后大鼠残余肠管肠黏膜损伤的评估肠道黏膜损伤评估的结果显示,与假手术组肠道黏膜损伤chius′评分(1.33±0.26)比较,MBR组(2.83±0.29)明显升高(P< 0.05)。MBR组肠道主要病理改变为:绒毛表被上皮细胞变性,间质严重水肿,多数固有层充血。见图2。

a:假手术组; b:MBR组
2.3MBR后自噬相关蛋白的表达与假手术组相比,MBR组自噬重要分子LC3的表达明显升高,P62的表达明显降低(P<0.05)。MBR组术后8 h LC3的表达开始升高,到达16 h处于高峰期,术后24和72 h表达逐渐下降并趋于稳定,但仍高于假手术组(P<0.05)。MBR组P62表达在术后8 h开始降低,在术后16 h处于最低值,而后在术后24、72 h逐渐上升,高于假手术组(P<0.05)。见图3。
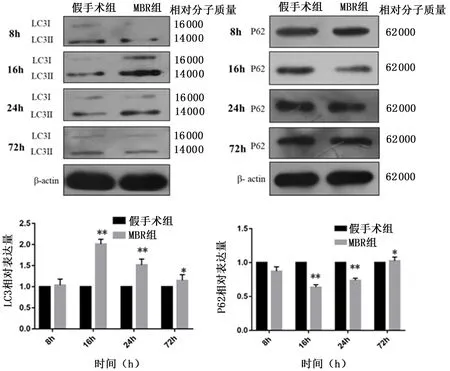
与假手术组比较,*P<0.05、**P<0.01
3 讨 论
本实验成功建立稳定的MBR动物模型,结果表明在体内MBR后残余肠管黏膜损伤加重,且自噬流的表达明显增高,首次证实自噬现象存在于MBR后残余肠管肠上皮细胞中。
目前公认的SBS分期主要包括急性期、适应期以及稳定期。急性期通常持续3~4周,主要表现为与手术相关的肠液大量丢失和代谢紊乱,引起机体脱水、水电解质紊乱以及急性肾衰竭等。在术后1~2年通常进入适应期,此时主要通过手术以及药物等多种手段加速肠适应进程,如治疗失败则转归为慢性肠功能衰竭。稳定期的患者靠特殊饮食、肠内营养以及药物治疗实现肠道自持[8],如已转归失败则需依靠终生肠外营养或者小肠移植[9]。本实验主要研究MBR后早期肠道黏膜损伤中自噬的动态变化,我们也观察到大多数动物在术后会出现腹泻等急性期的症状。
自噬的检测方法多样,其中重要的方法之一就是对自噬流的监测,LC3和P62是监测自噬流的重要分子,LC3Ⅰ型向Ⅱ型转化率以及Ⅱ型的分子数量被认为是自噬评价的指标。P62可以与LC3直接作用,主要功能在于将泛素化的蛋白带到溶酶体内进行降解,对不同时间点以及多种分子进行监测才可以反映自噬流的整体表达变化[10-11]。我们的研究即对LC3和P62在MBR后不同时间点进行监测,结果表明首先MBR术后总体自噬流的表达是升高的,但是在术后不同的时间点表达有所差异,到术后16 h表达处于峰值,此时自噬处于一个过表达的状态,术后24 h以后自噬的表达逐渐下降并趋于稳定。
自噬参与肠道疾病病理生理过程中的作用众说纷纭,有研究表明在新生儿坏死性小肠结肠炎中自噬过度表达,抑制自噬可对肠坏死起保护作用[12],然而也有研究证实在体内通过诱导自噬的表达可以减轻各种诱因引起的肠道炎症,包括肠道缺血再灌注损伤以及严重烧伤引起的肠道黏膜损伤[13-15]。自噬在MBR后急性期肠道黏膜损伤的表达是动态变化的,可理解为MBR后肠上皮细胞营养物质吸收匮乏,同时手术对机体也是很大的创伤,有证据表明MBR可直接导致肝损害,与长期肠外营养无关[16]。在双重压力刺激下,肠上皮细胞的自噬现象被诱发,然而随着术后时间的延长,肠道黏膜自我修复,肠上皮细胞的自噬也逐渐趋于稳定。
本研究不足之处,动物模型建立的总体存活时间相对较短,因此本研究主要局限于MBR后早期的自噬现象研究,对自噬参与MBR后残余肠管黏膜修复的具体信号通路还需要进一步的体内外实验研究。
综上所述,截止投稿,本研究首次证实了自噬参与MBR后早期肠道黏膜损伤形成的病理生理过程,为后续研究自噬在MBR后肠康复治疗中的作用提供了一定的理论基础。

