miR-605对非小细胞肺癌细胞放射敏感性的影响*
周东亚,张海兵,耿晓如,章杭,胡阳阳,周雷*,王小龙,张璇
(1.南京中医药大学沭阳附属医院 肿瘤科, 江苏 南京 223600; 2.锦州医科大学附属第一医院 肿瘤科, 辽宁 锦州 121000)
近年,肺癌的发病率和死亡率都升高,并成为了中国乃至世界范围死亡率最高的恶性肿瘤[1]。非小细胞肺癌(non-small-cell lung cancer,NSCLC)的发病率在肺癌中超过80%[2]。除了外科手术外,放射疗法也是肺癌最重要的治疗方法之一[3-5],但长时间的放射会使癌症细胞产生辐射抗性,致使放疗效果减弱[6-7]。因此,寻找一定的靶点以提高NSCLC癌细胞的放射敏感性,提高放疗效果有重要意义。MicroRNA(miRNA)是长度为19~25个核苷酸的单链RNA,可与靶基因信使RNA(mRNA)序列的3′-非翻译区(3′-untranslated region ,UTR)互补结合,并在转录后调节靶基因的表达[8]。证据表明,miRNA在包括NSCLC在内的癌症中有重要作用[9-10],并且相关研究也指出miRNA可能成为NSCLC治疗中的生物标志物[6, 11]。据报道,miR-605对肺腺癌有特异性,能通过抑制肺癌细胞系中的MDM2来增强p53的反式激活,从而抑制肺癌细胞的增殖[12-13],推测micro-605的表达变化是调控小细胞肺癌细胞放射敏感性的上游调控因子,但miR-605与NSCLC细胞放射敏感性的关系还未见报道。本研究以NSCLC细胞A549为对象探索下调miR-605靶向调控肿瘤坏死因子α诱导蛋白3(tumor necrosis factor alpha-induced protein 3,TNFAIP3),以提高非小细胞肺癌细胞放射敏感性的机制。
1 材料与方法
1.1 材料与仪器
人肺腺癌细胞A549(中科院上海生命科学研究所),miR-605minic和miR-605 inhibitor(广州锐博生物技术有限公司),qTR-PCR试剂盒(美国TaqMan公司),细胞克隆法试剂盒(美国Sigma公司),凋亡试剂盒(美国BD公司),一抗、二抗(美国CST公司),萤光素酶报告基因试剂盒(美国Promega公司),流式细胞仪(美国Beckman Coulter公司),6MV X线直线加速器(德国西门子公司),酶标仪(美国Gibco公司)。
1.2 方法
1.2.1细胞培养及转染分组 本研究共分为miR-605模拟物组(miR-605 mimic)、miR-605抑制剂组(miR-605 inhibitor)和空白对照组(NULL),转染miR-605的A549细胞模拟物,购自于上海GenePharma有限公司。将细胞以1×104细胞/孔的密度接种到6孔板中,TNFAIP3 cDNA克隆到表达载体pcDNA3.1(Invitrogen)中构建TNFAIP3的过表达载体,用RNAiMax和Lipofectamine 3000 with Plus Reagent(Thermo Fisher Scientific)瞬时转染细胞,通过qRT-PCR测定转染效率。
1.2.2miR-605表达检测 采用qRT-PCR方法检测,将miR-605模拟物、miR-605抑制剂、空白对照转染进A549细胞后miR-605的表达。按照试剂盒的说明进行qPCR定量相应细胞miR-605的含量,并以GAPDH作为内对照,引物序列如下:GAPDH上游序列为CCCATGTTCGTCATGGGTGT,下游序列为CCCATTCCCCAGCTCTCATA;miR-605 上游序列为UAAAUCCCAUGGUGCCUUCUCC,下游序列为AGAAGGCACUAUGAGAUUUAGA。
1.2.3细胞克隆法检测细胞活力 照射后的细胞经胰蛋白酶消化后进行细胞精确计数,选择合适的稀释倍数稀释后,以每个培养皿约100个细胞的浓度将细胞种植于培养皿中,于二氧化碳培养箱中37 ℃培养7 d。用1%甲基蓝对所培养的细胞染色,统计细胞数>50 的克隆数。细胞存活分数(survival fraction,SF)计算公式:SF(%)=(Sx/S0)×100%,Sx为受照细胞克隆形成率,S0为对照细胞克隆形成率。
1.2.4细胞凋亡水平实验 照射后各处理组接种5 000个细胞/孔接种在96孔板中,在培养箱中培养48 h后,以6 Gy的剂量进行照射。24 h后以1 000 r/min离心2次、每次离心5 min,PBS洗涤,按试剂盒说明进行AV/PI抗体孵育,20 min后分析miR-605模拟物、miR-605抑制剂、NULL组中A549细胞凋亡率。
1.2.5Western Blot实验 收集相应细胞,蛋白裂解液中裂解30 min,在4 ℃用12 000 r/min离心15 min。使用10%十二烷基硫酸钠-聚丙烯酰胺凝(SDS-PAGE)电泳分离等量的蛋白质,在4 ℃、300 mA恒流转膜(PVDF膜),将膜在室温下、5%脱脂牛奶中封闭1 h,在4 ℃下用TNFAIP3及β-actin一抗过夜孵育并显像分析。
1.2.6miRNA靶标的分析及荧光素酶报告基因检测 使用TargetScan算法对MiRNA靶标进行了分析[12]。将各组细胞在培养箱中培养48 h后,使用Lipofectamine 2000转染试剂将0.5 μg TNFAIP3 3′-UTR报告质粒(pRL-TNFAIP3)转染进各组经miR-605修饰的细胞中。48 h后,使用双荧光素酶报告基因检测试剂盒检测荧光素酶活性采用Lipofectamine 2000将含有WT或MT TNFAIP3 3′-UTR的报告载体与miR-605 mimic或NULL共转染到A549细胞中。转染48 h后,采用双荧光素酶测定系统(Promega)测量荧光素酶活性。
1.3 统计学分析
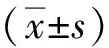
2 结果
2.1 miR-605表达
与空白对照组比较,转染进miR-605模拟物后,miR-605表达(3.29±0.13)升高;转染进miR-605抑制剂后,miR-605表达降低,差异有统计学意义(P<0.05),表明转染体系有效。见图1。
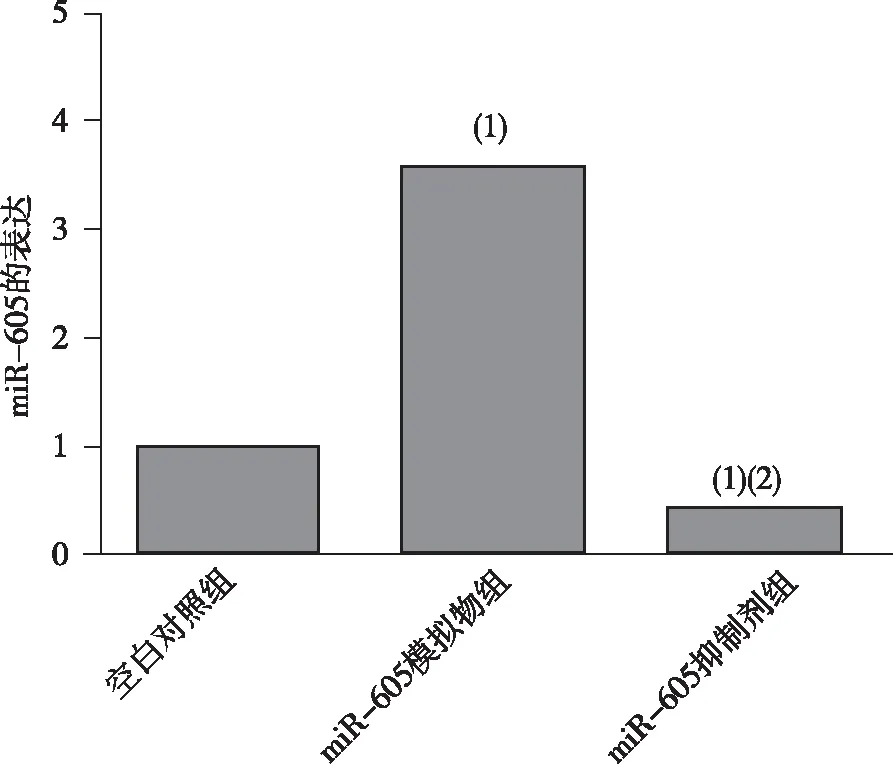
注:(1)与空白对照组比较,P<0.05;(2)与miR-605模拟物组比较,P<0.05。
2.2 细胞活力水平
与空白对照组比较,miR-605模拟物组的细胞活力升高,差异有统计学意义(P<0.05);与miR-605模拟物组比较,miR-605抑制剂组的细胞活力降低差异有统计学意义(P<0.05)。见图2。
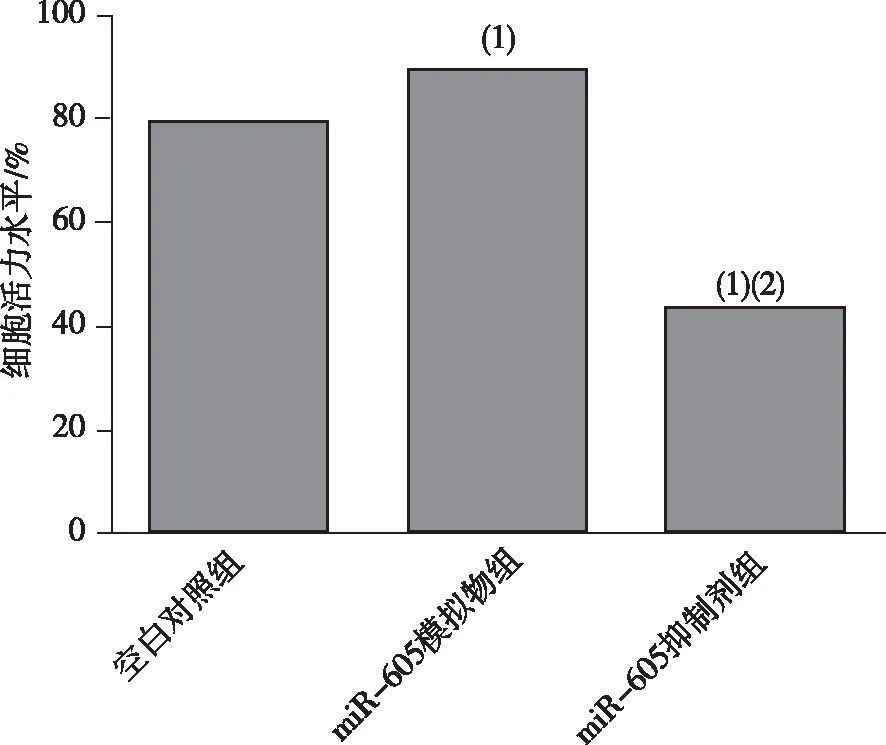
注:(1)与空白对照组比较,P<0.05;(2)与miR-605模拟物组比较,P<0.05。
2.3 细胞凋亡水平
照射后,与空白对照组比较,miR-605模拟物组的细胞凋亡水平降低,差异有统计学意义(P<0.05);与miR-605模拟物组比较,miR-605抑制剂组的细胞凋亡升高,差异有统计学意义(P<0.05)。见图3。
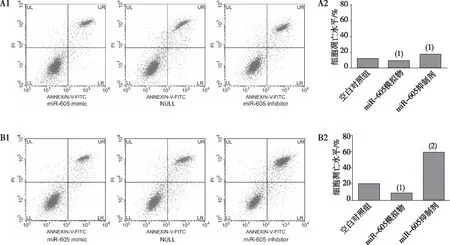
注:A1为细胞照射前凋亡水平,A2为细胞凋亡水平定量结果,B1为细胞照射后凋亡水平,B2为细胞凋亡水平定量结果;(1)与空白对照组比较,P<0.05;(2)与miR-605模拟物组比较,P<0.05。
2.4 TNFAIP3的蛋白表达
照射后,与空白对照组比较,miR-605模拟物组TNFAIP3的蛋白表达降低差异有统计学意义(P<0.05);与miR-605模拟物组比较,miR-605抑制剂组TNFAIP3的蛋白表达升高,差异有统计学意义(P<0.05)。见图4。
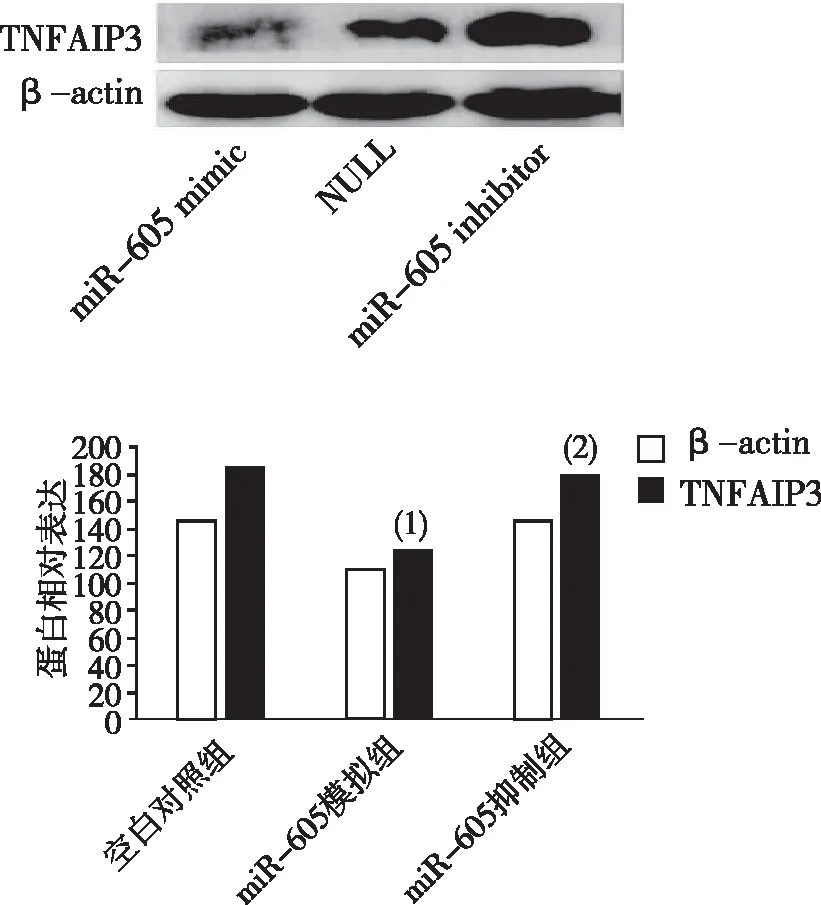
注:(1)与空白对照组比较,P<0.05;(2)与miR-605模拟物组比较,P<0.05。
2.5 靶点和A549细胞TNFAIP3 3′-UTR的相对荧光素酶活性
miR-605模拟物能抑制TNFAIP3 3′-UTR报告基因的荧光素酶活性,差异有统计学意义(P<0.05);miR-605抑制剂能提高TNFAIP3 3′-UTR报告基因的荧光素酶活性,差异有统计学意义(P<0.05)。见图5。
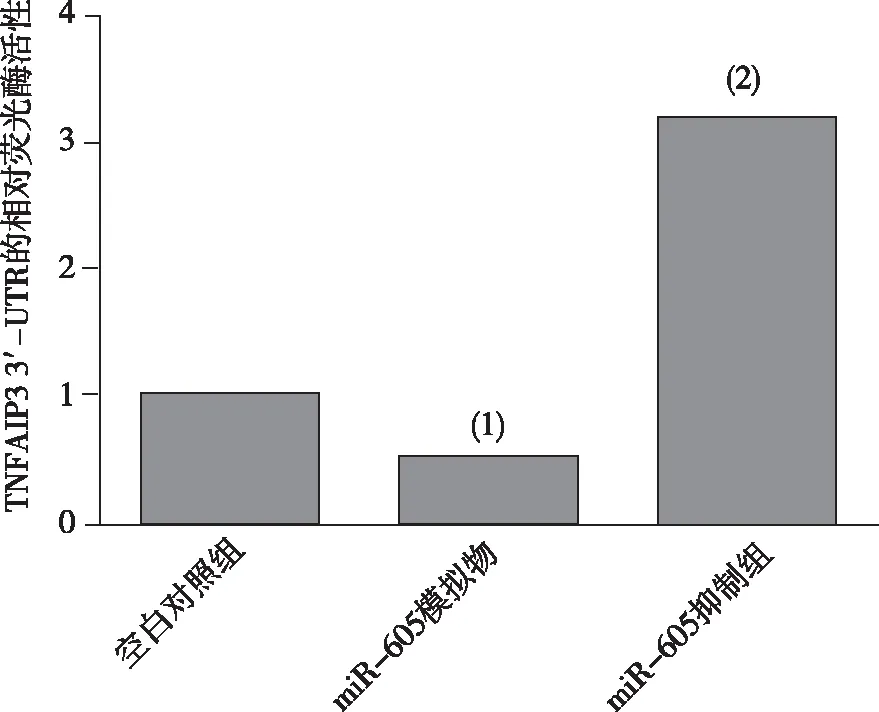
注:(1)与空白对照组比较,P<0.05;(2)与miR-605模拟物组比较,P<0.05。
2.6 TNFAIP3 3′-UTR转染组细胞活力
照射后(6 Gy),与空白对照组比较,pcDNA′TNFAIP3转染组的细胞活力水平降低,差异有统计学意义(P<0.05)。见图6。
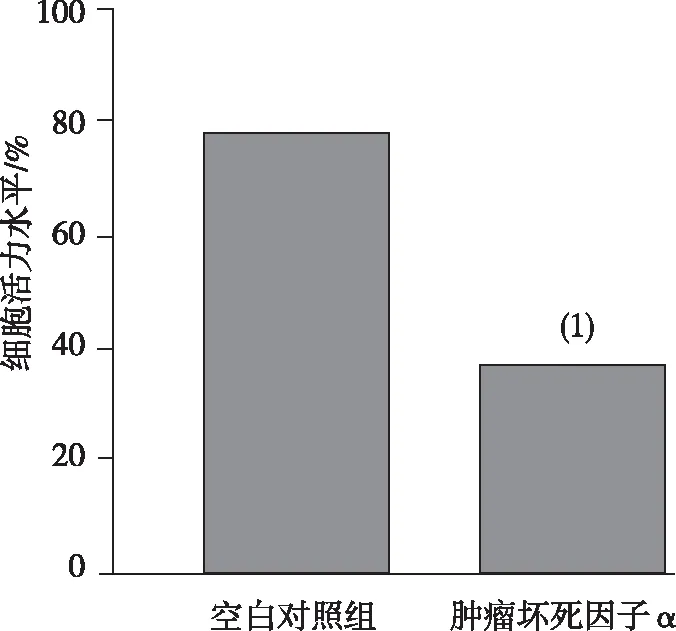
注:(1)与空白对照组比较,P<0.05。
3 讨论
在许多癌症中,miRNA表达存在异常。目前相关研究已指出10个miRNA是NSCLC的潜在标志物,可作为致癌基因或抑癌基因,例如 miRNA-133a能充当NSCLC的抑制因子和独立的预后生物诊断标志物[14];miRNA-758可通过负调控HMGB抑制NSCLC的增殖,侵袭,迁移和促凋亡[15];也有相关研究指出miRNA同癌细胞的放射敏感性相关[6,16-17]。另外,有研究指出,miR-605通过靶向EN2促进了前列腺癌细胞的增殖和迁移[18];miR-605通过靶向抑制PSMD10/Gankyrin金银抑制了肝内胆管癌细胞的进程[19];并且还有研究指出miR-605通过直接靶向Forkhead Box P1抑制非小细胞肺癌细胞的增殖[20]。然而,miR-605对NSCLC放射敏感性的影响及相关机制仍不清楚。因此,本研究首先通过细胞克隆法实验及细胞凋亡实验检测了miR-605 对A549细胞放射敏感性的影响,结果说明抑制miR-605在A549细胞中的表达有利于提高该细胞的放射敏感性,而提高miR-605在A549细胞中的表达会有利于产生辐射抗性。TNFAIP3与非酒精性肝炎有关,能通过导肝ASK1的失活改善非酒精性肝炎[21],而这一结果仍未有相关文献的报道。在免疫学领域,有研究指出TNFAIP3能通过限制MTOR、促进自噬来提高CD4 T细胞的活力[22]。本研究通过Western blot实验发现了miR-605下调后,靶向上调了A549细胞中的TNFAIP3蛋白来增强其放射敏感性。TNFAIP3基因的高表达水平与非小细胞肺癌发生发展密切相关,并且与肝癌的转移复发存在相关性,提示TNFAIP3可能成为协助非小细胞肺癌诊断,判断预后及疗效评价的指标[23-25]。笔者分析,miRNA表达抑制可增加经γ射线照射(2.5G)的细胞的死亡,说明miRNA有促进细胞存活及抗凋亡的功能。miRNA可通过不同水平的多种信号通路来调节电离辐射引起的细胞损伤。电离辐射可以激活多种信号通路损伤细胞,如MTOR信号途径。miR-605的靶基因TNFAIP3对MTOR信号途径有负调节作用,沉默miR-605,增TNFAIP3的表达,可减少对DNA双链损伤的修复,进而增加放射敏感性。
综上所述,下调miR-605后,非小细胞肺癌放射敏感性的增强可能是通过靶向上调TNFAIP3实现的,然而由于放射增敏的分子机制十分复杂,其是否通过其他通路产生作用仍不清楚,本研究将对此不断探索。

