CD133+原代胃癌细胞生长、迁移和侵袭能力的检测*
程薇,陈学书,谢渊,周建奖,袁航,贾岑岑,王琴容,赵艳**
(1.贵州医科大学 地方病与少数民族性疾病教育部重点实验室 & 贵州省医学分子生物学重点实验室,贵州 贵阳 550004;2.贵州省肿瘤医院 检验科,贵州 贵阳 550001;3.襄阳市第一人民医院 病理科,湖北 襄阳 441000)
胃癌(gastric cancer,GC)是全球最常见的恶性肿瘤之一,其胃癌的发病率和死亡率分别居恶性肿瘤的第5位和第2位[1]。近年来提出的“肿瘤干细胞学说”为胃癌的发病机制研究及治疗开辟了新的途径[2]。肿瘤干细胞(cancer stem cells,CSCs)是具有不受限制的自我更新和分化能力的肿瘤细胞,与肿瘤的耐药、侵袭、转移和复发有关[3]。利用CSCs与正常干细胞具有相似的表面标志,通过流式细胞和磁珠分选技术能从胃癌组织中分离CSCs[4]。目前在人类白血病、乳腺癌、神经系统肿瘤、结肠癌和肝癌等肿瘤中成功分离出CSCs[5-8]。分离胃癌中CSCs最常用的标志物有分化抗原簇蛋白24(cluster of differentiation protein 24,CD24)、分化抗原簇蛋白44(cluster of differentiation protein 44,CD44)和分化抗原簇蛋白133(cluster of differentiation protein 33,CD133)[9],但CD133的研究相对较少。CD133是一个由5个跨膜结构域和2个胞外区组成的120 kDa单链糖蛋白,是许多实体癌如脑肿瘤、结肠癌、肺癌及肝癌等最重要的CSCs标记之一[10-13]。有研究表明胃癌干细胞高表达CD133,且与胃癌组织浸润深度及淋巴结转移相关[14]。近期研究也发现CD133参与了多种癌细胞中信号传导途径的激活,如转化生长因子β1(transforming growth factor β1,TGF-β1)介导细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路的激活[15]。本研究从临床胃癌组织中分离纯化原代胃癌细胞,利用磁珠分选技术分选人CD133+胃癌细胞,探讨其生长、迁移、侵袭及体内成瘤能力,为进一步探讨胃癌干细胞在胃癌中的作用及分子机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞和动物来源 人原代胃癌细胞由课题组前期分离鉴定,保存于液氮罐中;4只雄性无胸腺裸鼠(nude mice,BALB/C)裸鼠购自贵州医科大学动物中心[SYXK(黔)2018-001],体质量14~15 g,4~6周,饲养于学校动物房无特定病原体(specefic pathogen free,SPF)级无菌室。实验获学校实验动物伦理委员会批准(No2000784)。
1.1.2主要试剂及仪器 胎牛血清、RPMI 1640培养基、双抗、胰蛋白酶和磷酸盐缓冲液购自美国Gibco公司,CD133免疫磁珠分选试剂盒购自德国Miltenyi公司,小鼠单克隆CD133抗体和羊抗鼠荧光二抗购自美国Proteintech公司,Transwell小室和Matrigel基质胶购自美国Corning公司,多聚甲醛购自国药集团化学试剂有限公司,结晶紫购自上海生工生物工程有限公司。倒置显微镜购自日本Olympus公司,正置荧光显微镜购自日本Nikon。
1.2 方法
1.2.1免疫磁珠分选人CD133+原代胃癌细胞 复苏细胞,常规培养。细胞铺满培养瓶底部后消化细胞,用缓冲液将细胞制备成1×107个/mL的单细胞悬液,加鼠抗人CD133单克隆抗体10 μL,4 ℃孵育15 min;加缓冲液2 mL洗涤细胞,1 000 r/min离心8 min,弃上清;加缓冲液400 μL重悬细胞,加Anti-Biotin MicroBeads 25 μL充分混合,4 ℃孵育20 min;加缓冲液10 mL洗涤细胞,1 000 r/min离心5 min,吸上清液于缓冲液1 000 μL中重悬细胞;将细胞悬液移入分离柱中并使分离柱置于磁力架上,室温孵育10 min;缓慢流出分离柱的细胞悬液为CD133-组;从磁力架上取下分离柱,将缓冲液加入分离柱中,将柱塞推入柱中,冲洗下的磁性标记的细胞为CD133+组。为了增加CD133+胃癌细胞的纯度,再次使用新分离柱重复磁选步骤。
1.2.2免疫荧光检测CD133的表达 将分选后的CD133-和CD133+原代胃癌细胞分别接种于有细胞爬片的12孔板中,常规培养后取出爬片并用PBS洗涤,4 %多聚甲醛固定30 min后PBS洗3次、用0.3%Triton X-100通透30 min,PBS洗涤;BSA室温封闭30 min,鼠抗CD133单克隆抗体4 ℃孵育过夜,次日PBS洗3次,滴加羊抗鼠荧光二抗,避光孵育2 h,PBS洗3次,DAPI染核15 min,PBS洗3次,滴加抗荧光衰弱封片剂10 μL,荧光显微镜下观察CD133的表达情况。
1.2.3细胞克隆形成实验 制备细胞悬液,在6孔细胞培养板中以1 000个/孔的密度接种细胞,盖上盖子,轻轻混匀后放入37 ℃的5%CO2细胞培养箱中培养。每2 d观察1次,待细胞形成肉眼可见的克隆时,取出6孔细胞培养板,PBS缓冲液冲洗,多聚甲醛固定后用结晶紫染色。随机选3个视野,用IMAGE J计数每个视野的细胞克隆数。
1.2.4细胞划痕实验 制备细胞悬液,在6孔板中以1×105/mL密度接种细胞后放入细胞培养箱,待细胞长满后用移液器枪头紧贴直尺,垂直于6孔板水平线划痕,PBS清洗未贴壁的细胞后加入无血清培养基,放入细胞培养箱中培养;分别在0、24、48及72 h用倒置显微镜观察、并拍照,计算伤口愈合百分比[伤口愈合百分比(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度]。
1.2.5Transwell侵袭实验 将50 mg/L的基质胶(Matrigel)与RPMI 1640培养基以1 ∶8稀释,取稀释液100 μL滴加于Transwell小室底部膜的上室,细胞培养箱中凝固1 h,制备细胞悬液;以5×104/mL细胞密度接种于Transwell小室的上室,Transwell小室的下室加完全培养基100 μL,放细胞培养箱中培养48 h,固定,结晶紫染色后拍照。随机选3个视野,用IMAGE J计数每个视野的穿膜细胞数。
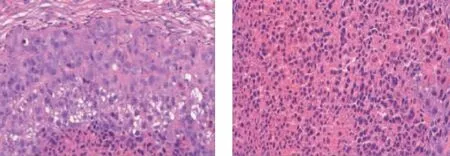
1.2.6裸鼠皮下成瘤实验、瘤组织学观察及CD133、Ki67表达 取4只裸鼠均分为 CD133+组和CD133-组,分别接种相应的原代胃癌细胞,接种细胞量均为1×106个/只、接种于裸鼠腋窝中后部;观察裸鼠移植后的反应、成瘤时间,并用卡尺测量瘤体的长度(L)和宽度(W),计算瘤体体积[瘤体体积(V)=(L×W)2×0.5]、并绘制瘤体生长曲线;接种第32天麻醉处死裸鼠,取瘤组织块多聚甲醛固定、切片、HE染色观察两组瘤体组织切片,采用免疫组织化学检测CD133、Ki67的表达。
1.3 统计学分析
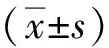
2 结果
2.1 原代胃癌细胞中CD133表达
磁珠分选后,用免疫荧光检测CD133+组和CD133-组的CD133表达,结果显示,CD133主要在CD133+原代胃癌细胞的细胞膜及胞质中表达,提示成功分选到了CD133+原代胃癌细胞。CD133-组原代胃癌细胞平均光密度低于CD133+组,差异有统计学意义(P<0.01)。见图1。
2.2 原代胃癌细胞的体外增殖能力
成功获得CD133+原代胃癌细胞后,用克隆形成实验检测细胞的体外增殖能力。结果如图2所示,CD133+原代胃癌细胞形成的克隆数高于CD133-原代胃癌细胞形成克隆数,差异有统计学意义(P<0.001)。
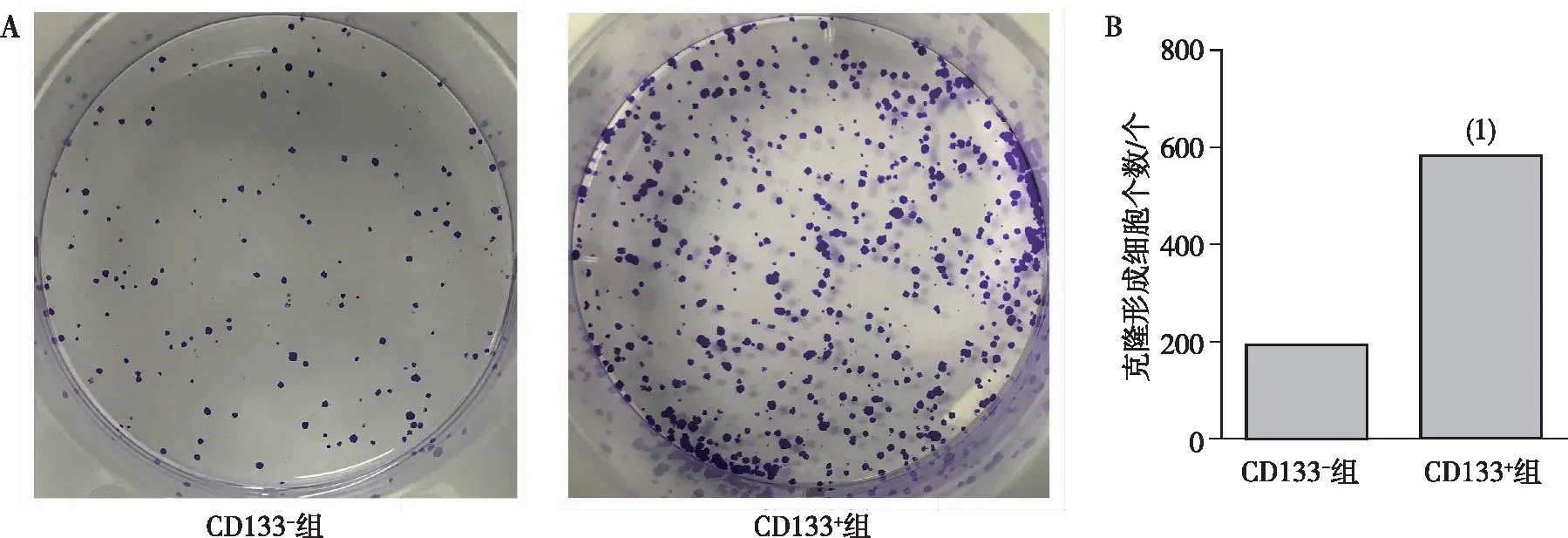
注:A为克隆形成后的结晶紫染色结果,B为细胞克隆数量的定量结果;(1)与CD133-组比较,P<0.001。
2.3 原代胃癌细胞的体外迁移能力
细胞划痕实验结果如图3所示,CD133+原代胃癌细胞伤口愈合率(76.5±1.4)%,显著高于CD133-原代胃癌细胞(39.8±2.0)%,P<0.001,提示CD133+原代胃癌细胞有更强的迁移能力。
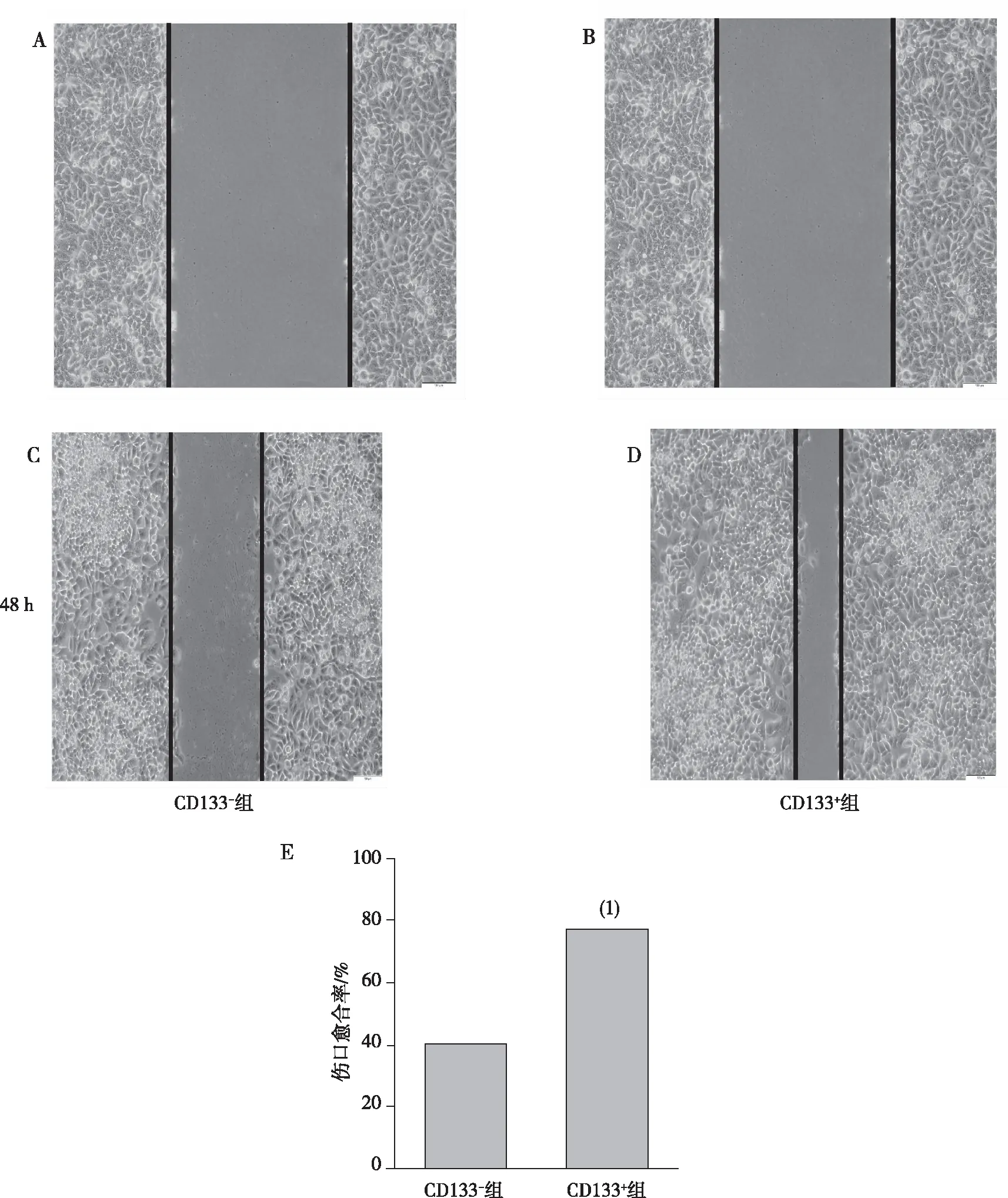
注:A、B分别为CD133-组和CD133+组0 h时细胞划痕结果(划痕实验,×100),C、D分别为CD133-组和CD133+组48 h时细胞划痕结果(划痕实验,×100),E为细胞迁移宽度的定量表达;(1)与CD133-组比较,P<0.001。
2.4 原代胃癌细胞的体外侵袭能力
Transwell侵袭实验结果如图4显示,CD133+组侵入Transwell下室面的细胞数(624±37)/视野显著高于CD133-组(281±31)/视野,(P<0.001)。
2.5 原代胃癌细胞的体内成瘤能力
将CD133+和CD133-的原代胃癌细胞种植到裸鼠皮下,结果显示CD133+接种组2只裸鼠分别于第12天和第20天开始成瘤,CD133-接种组1只裸鼠于第26天开始成瘤、1只不成瘤(图5);HE染色结果观察到2组裸鼠肿瘤组织的形态结构(图6);免疫组织化学染色显示,CD133+接种组裸鼠原代胃癌细胞中CD133+和Ki67的表达明显高于CD133-接种组,提示裸鼠体内CD133+胃癌细胞成瘤能力高于CD133-胃癌细胞,差异有统计学意义(P<0.01,图7)。
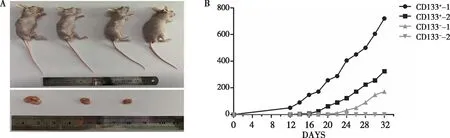
注:A为处死的裸鼠和取出瘤体,B为肿瘤体积生长曲线。
CD133+接种组 CD133-接种组
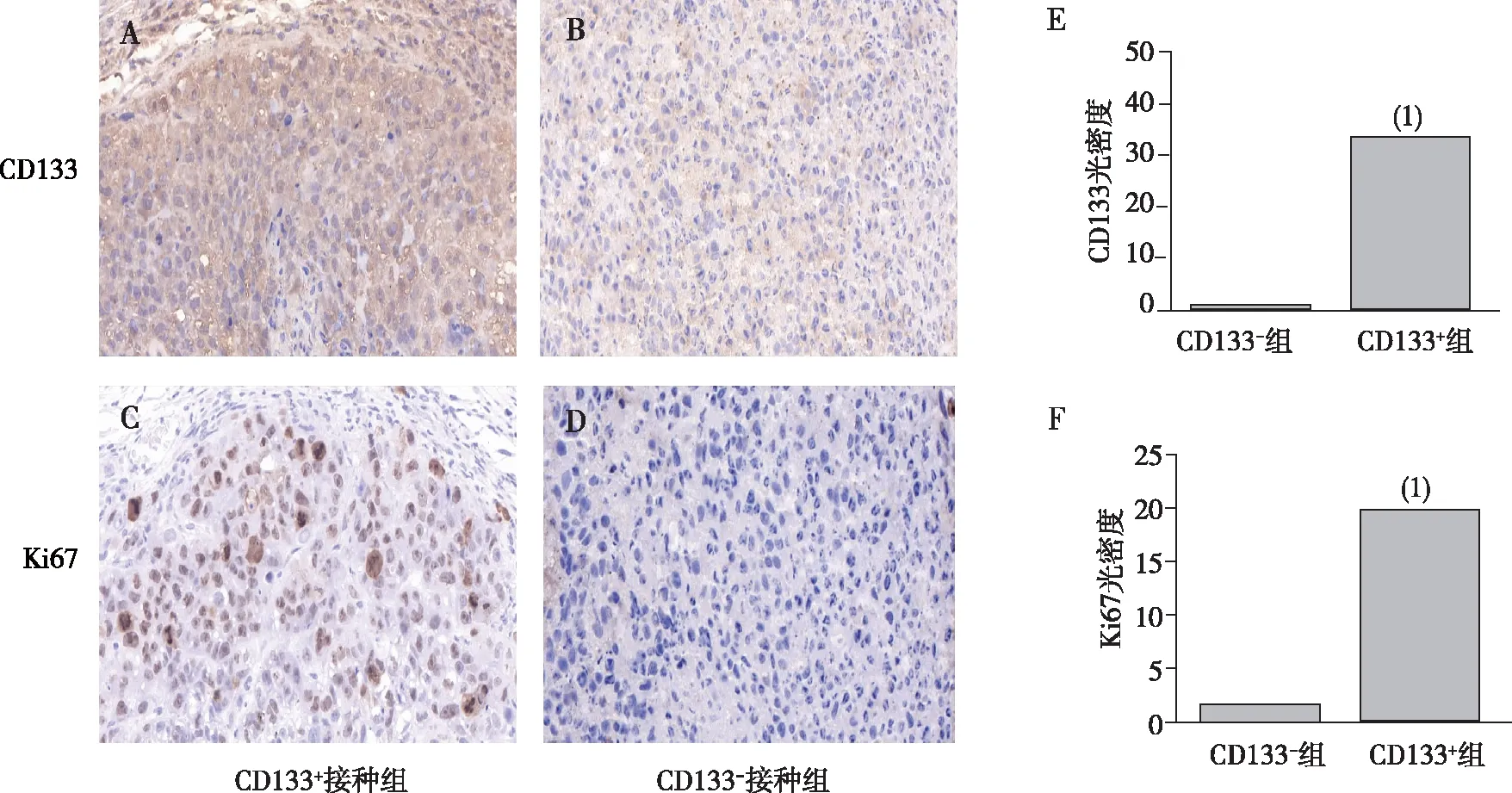
注:A、B分别为CD133+和CD133-接种组裸鼠CD133的表达,C、D分别为CD133+和CD133-接种组裸鼠Ki67的表达,E、F分别为CD133、Ki67表达的定量结果;(1)与CD133-接种组比较,P<0.01。
3 讨论
肿瘤干细胞被认为是各种实体瘤的生长、侵袭、转移及复发的重要原因[3]。细胞表面标志物的表达已被用于从不同肿瘤中分离肿瘤干细胞,例如CD44、CD24、CD29及CD133等[16]。发现CD133+/CD166+人类胃癌细胞系BGC-823和SGC-7901具有癌症干细胞特性[17];也有研究表明,胃癌中CD133的过表达与其临床病理特征密切相关,且CD133阳性患者比CD133阴性患者耐药性和复发率更高,且5年生存率更低[18-19]。此外,研究表明,CD133 miRNA结合位点可能是胃癌遗传易感性的潜在生物标志物和胃癌患者生存的预测指标[20];朱优龙等[21]研究显示CD133可能通过调节强效P-糖蛋白(P-glycoprotein,P-gP)和B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达促进胃癌的化疗耐药;在胃癌化疗耐药产生中,CD133+细胞可通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/丝氨酸苏氨酸蛋白激酶(serine/threonine protein kinase,Akt)通路起作用[22];但也有学者认为CD133和CD44细胞表面标记不能识别原发性人胃肿瘤中的肿瘤干细胞[23]。尽管关于CD133与胃癌的基础和临床研究多种多样,但有关CD133的现有文献尚未阐明其在肿瘤干细胞中的生物学功能。
本研究通过免疫磁珠成功从手术切除的胃癌组织中分离到人CD133+胃癌细胞,并在体外传代培养,经免疫荧光证实人CD133+胃癌细胞中高表达CD133,且主要在细胞膜及胞质中表达;随后用克隆形成实验、划痕实验及Transwell侵袭实验检测发现CD133+胃癌细胞比CD133-细胞具有更强的体外增殖、迁移和侵袭能力,提示CD133+胃癌细胞可能具有干细胞的特性,这与其他研究者在其它肿瘤的研究结果一致[24-27]。为了探究CD133+胃癌细胞在体内形成肿瘤的能力,继续将CD133+和CD133-胃癌细胞种植于裸鼠皮下,发现CD133+胃癌细胞比CD133-胃癌细胞的成瘤时间早、增长速度快,且CD133-胃癌细胞有不成瘤的现象,然而目前无文献报道CD133-胃癌细胞有不成瘤的现象,可能是与分离出的原代胃癌细胞与其他细胞株的差异导致;免疫组织化学进一步证实CD133+的移植瘤组织中CD133和Ki67高表达。因此,本研究证明了从人原代胃癌细胞中分离出来的CD133+胃癌细胞具有肿瘤干细胞的特征,可能与胃癌细胞的侵袭和转移相关。也有研究者用RNA干扰技术下调胃癌细胞株KATO Ⅲ中CD133的表达,发现降低了胃癌细胞的增殖、侵袭、克隆球形成、耐药以及裸鼠体内成瘤的能力[28]。由于肿瘤干细胞的定义仍有争议,其产生和发展的机制尚不清楚,因此进一步研究肿瘤干细胞的微环境和信号通路以及与胃癌发生、复发、转移和耐药性的关系极为重要。
综上所述,本研究成功分离获得人CD133+和CD133-原代胃癌细胞,与人CD133-原代细胞相比,CD133+人原代胃癌细胞具有更强的体外增殖、迁移和侵袭能力及体内成瘤能力,为进一步研究奠定了良好的基础。

