HLA-DRB1等位基因和抗HLA-DRB1抗体在尿毒症患者中的分布特征
郭旭丽,朱 权,王慧鹏,谢 敏,罗奇志*
(1. 河北工程大学医学院免疫学教研室,邯郸 056038;2. 中南大学基础医学院免疫学教研室,长沙 410008)
人类白细胞抗原(human leukocyte antigen,HLA)分为HLA-I、HLA-II、HLA-III 三个区域,与免疫系统密切相关,其中HLA-II 区域编码的HLA-DR抗原是与移植排斥有关的最重要的抗原[1-3],是导致移植后发生排斥反应的最主要因素,也是引发同种异基因排斥反应的主要抗原[4]。尿毒症是终末期肾病的表现形式,肾移植是目前唯一根治尿毒症的手段[5]。晚期尿毒症患者进行肾移植前需检测供受者HLA 的基因型别,通过选择更多的HLA等位基因匹配的供者来尽可能地降低排斥反应。有些患者由于接触过同种HLA 抗原(输血、妊娠、再移植等),体内预先产生了相应的抗HLA 抗体[6],即群体反应性抗体(population reactive antibody,PRA),一旦接触到相应抗原就会损伤供者的组织器官,因此必须在术前加以检测,从而避免可能发生的移植排斥反应。
根据移植体液免疫理论,造成器官移植受者对移植物排斥的原因是机体对HLA 抗原存在致敏效应[7]。该效应在移植受者中普遍存在,尤其是在再移植受者中更为多见。研究发现,几乎所有的等待肾脏再移植的受者体内都存在抗HLA 抗体[8],该类抗体与相应抗原的反应性以及交叉反应现象是几十年来研究的焦点。HLA 分子上的氨基酸序列在很大程度上有助于了解抗原抗体反应的本质,然而解析抗体与HLA 抗原上的特异表位之间的反应则能够更准确地描述抗原抗体反应的本质。有些表位是独有的,仅在一种抗原上出现;有些表位则能出现在多个抗原中[9]。例如:HLA-DQ 分子β 链上第56 位氨基酸为亮氨酸(L)时,就可确定为HLADQB1 分子,表明该表位为独特表位,而表位82LR(第82位与第83位氨基酸分别为亮氨酸与精氨酸)在HLA-A2、B57、B58 等HLA 分子中都有出现,甚至有些表位能同时出现在HLA-A、B、C 分子中。近些年,基于重组HLA 单抗原包被的悬液芯片技术在确定抗HLA 抗体的特异性方面有着很大的作用[10],通过该项技术还能确定表位的分布特征。
供受者间的HLA 绝大部分表位匹配时,即使基因型不匹配,也不会引发过强的排斥反应。但是传统的HLA 配型未能充分考虑表位匹配的问题,而表位的重要性远高于当前针对移植受者体内抗体特异性的研究。国际上已有大量有关移植受者表位匹配的报道,如Duquesnoy[11]报道了一项基于HLA表位匹配的器官移植案例;Wiebe 等[12]提出,表位匹配能最大化地降低供者特异性抗体的产生,并提高移植治疗的效果;Walton 等[13]研究表明,表位匹配程度与慢性移植肺功能紊乱程度呈负相关。
HLA-DR基因是引发移植排斥反应最重要的位点,同时在对肾移植受者进行HLA 配型时,我们发现HLA-DRB1基因座位与尿毒症发病及肾移植排斥有一定的关联。目前学术界对HLA-DRB1基因与尿毒症及肾移植之间的关系尚未阐明,其影响移植肾存活的机制还未明确。为了在移植前更好地对尿毒症患者进行HLA 表型检测,利于其配型,我们对尿毒症患者的HLA-DRB1基因进行检测,对因尿毒症而进行了肾移植的患者进行抗HLA-DRB1抗体的筛查,以期了解HLA-DRB1等位基因的分布特征和肾移植后HLA-DRB1 抗体的分布特征,探索基于表位的新型配型理论。本研究将为深入了解HLA-DRB1基因与尿毒症的关系奠定基础,对阐明HLA-DRB1基因在尿毒症及肾移植中的作用提供试验依据。
1 材料与方法
1.1 研究材料
连续收集2014 年至2019 年就诊于湘雅医院、湘雅二医院与湘雅三医院的358 例因尿毒症进行肾移植的患者(所有研究对象无其他重大疾病,相互之间无亲缘关系)的血样本,同时收集3 664 例健康志愿者的血标本。所有研究对象均采集3 mL 静脉血,分离出血清,并从外周血样本中提取DNA。所有研究对象或家属均签署知情同意书。
1.2 HLA-DRB1 的基因分型
用HLA-II 类分型试剂盒(Immucor,Peachtree Corners,GA,美国)对所有患者的HLA-DRB1进行基因分型。从样品中提取DNA,最终质量浓度为15~20 ng/μL。将2.0 μL DNA 与0.2 μL Taq 酶、11.8 μL ddH2O 和6.0 μL 探针混合物混合至总体积为20 μL。接着,启动聚合酶链反应(polymerase chain reaction,PCR)扩增系统:95℃ 5 min,1 个循环;95℃ 30 s,60℃ 45 s,72℃ 45 s,8 个循环;95℃ 30 s,63℃ 45 s,72℃ 45 s,32 个循环;72℃15 min,1 个循环。使用2.5 μL PCR 产物和7.5 μL探针混合物混合,97℃反应5 min,接着47℃反应30 min,最后56℃反应30 min 进行DNA 杂交。56℃反应5 min 后加入稀释液和藻红蛋白-链霉亲和素混合物(体积比为200∶1),置于Lumiex 仪器中进行检测。
1.3 抗HLA-DRB1 抗体的检测
按说明书要求,用单抗原流式细胞术对抗HLADRB1的免疫球蛋白G(immunoglobulin G,IgG)抗体进行检测。将15 μL 患者血液标本与45 μL 含10%绵羊血清的磷酸盐缓冲溶液(phosphate buffered solution,PBS)混合,然后添加Luminex检测磁珠(Lambda,Themo,CA,USA)。阳性对照组为正常血清和磁珠(含10%绵羊血清),阴性对照组为质控血清和磁珠(含10%绵羊血清)。加入磁珠后,充分摇匀混合物,室温静置30 min,然后用PBST(含0.05%吐温20的PBS)洗涤4次,每次均以900g离心2 min,弃去上清液后加入60 μL 藻红蛋白标记的绵羊抗人IgG 并混合,置于Luminex仪器中读出平均荧光强度(mean fluorescence intensity,MFI)值。
1.4 稳定表达HLA-DRB1*01/*13/*14细胞株的构建
将人HLA-DRB1*01/*13/*14基因序列全长经过PCR 扩增后分别克隆到pEGFP-N1 载体中,分别获得载有HLA-DRB1*01/*13/*14基因全长序列的重组质粒。测序验证后分别转染至HMy2.C1R细胞中[不表达HLA-A、B,仅表达少量的HLACw4(ATCC,Rockville MD,USA)],在含500 μg/mL G418 的RPMI-1640 完全培养基中培养,成功转染的细胞呈绿色荧光。再经细胞流式分选培养获得稳定表达HLA-DRB1*01/*13/*14的细胞株。
1.5 抗体吸附试验
分别收集稳定表达HLA-DRB1*01/*13/*14 的细胞1.0×107个,并用pH 7.4 的PBS 洗涤3 次。将50 μL 含有与细胞表面HLA-DRB1 抗原对应抗体的血清(MFI >5 000)分别与稳定表达HLA-DRB1 抗原的细胞混合,37℃反应1 h,然后离心收集血清。用Luminex 悬液分析系统对吸收后的血清进行MFI值检测,并与吸收前进行比较。
1.6 统计方法
计算出研究对象的HLA-DRB1等位基因频率,并与健康志愿者比较;计算出抗HLA-DRB1 抗体的分布频率特征,以百分率表示;将各个抗体的MFI值取平均数并进行平均MFI 值的比较。用SPSS 20.0 软件进行统计学分析,计数资料以百分数表示,基因频率的比较采用卡方检验,以P<0.05 为有显著差异。
2 结果与分析
2.1 抗HLA-DRB1 抗体频率在性别之间的比较
在358 名尿毒症患者中,有35 名患者(10 名男性和25 名女性)具有抗HLA-DRB1 抗体,其余患者(173 例男性和150 例女性)没有抗HLA-DRB1 抗体。其中女性患者中抗HLA-DRB1抗体的频率高于男性,Student’st检验结果表明差异显著(P<0.05)。
2.2 尿毒症患者和健康对照组之间HLA-DRB1等位基因频率的比较
为了确定HLA-DRB1是否与尿毒症相关,本研究通过聚合酶链反应-序列特异性寡核苷酸(polymerase chain reaction-sequence specific oligonucleotide,PCR-SSO)方法对358 名尿毒症患者和3 664 名健康对照者的HLA-DRB1基因进行分型,并对基因频率进行统计。结果显示,尿毒症患者组HLA-DRB1*13等位基因的频率显著低于健康对照组(4.33% vs. 13.37%,P<0.001),相比之下,尿毒症患者组HLA-DRB1*14等位基因的频率显著高于健康对照组(12.01% vs. 4.12%,P<0.001)。即尿毒症患者的HLA-DRB1*13等位基因频率较低,而HLA-DRB1*14等位基因频率较高;在健康对照者中,HLA-DRB1*13等位基因的频率高,而HLA-DRB1*14等位基因的频率低(表1)。这些结果表明:在基因频率上,HLA-DRB1*13与尿毒症患病率呈负相关,可能对个体具有保护作用;HLADRB1*14与尿毒症患病率呈正相关,可能是尿毒症的易感因素。
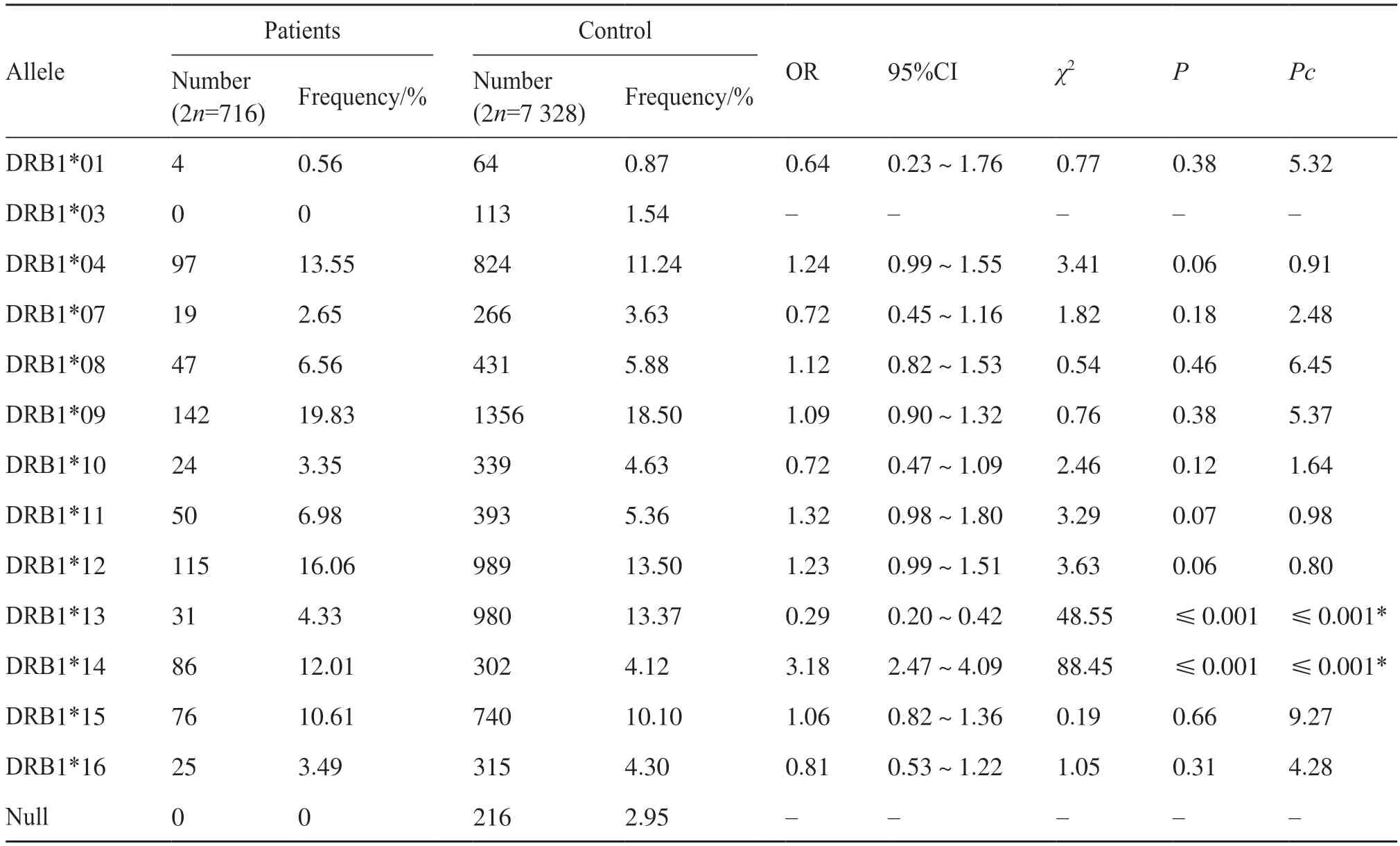
表1 358例尿毒症和3 664健康对照者HLA-DRB1等位基因的频率分布Tab. 1 Frequency distribution of HLA-DRB1 alleles in 358 patients with uremia and 3 664 health controls
2.3 HLA-DRB1*13/*14 基因型尿毒症患者放疗后肾脏移植的存活率
为了分析HLA-DRB1*13/*14等位基因对尿毒症患者生存的影响,我们对携带这两种HLA-DRB1基因的尿毒症患者进行了生存分析。 由图1 可知,HLA-DRB1*13基因型患者的生存率显著高于HLA-DRB1*14基因型患者的生存率,而没有HLADRB1*13/*14基因型的尿毒症患者在肾移植后的移植肾的存活率介于HLA-DRB1*13和HLA-DRB1*14基因型的尿毒症患者的存活率之间。
2.4 肾移植后尿毒症患者体内抗HLA-DRB1抗体的产生情况

图1 尿毒症患者移植后的肾脏的存活率Fig. 1 Survival rate of transplanted kidneys after kidney transplant in uremia patients
本研究对358 位因尿毒症进行肾移植的患者进行抗HLA-DRB1 类抗体的检测,其中120 例为抗HLA-DRB1 类抗体阳性。结果统计如表2 所示,抗HLA-DRB1*01/*13/*14 抗体的频率显著低于其他一些HLA-DRB1 类抗体(P<0.05),差异具有统计学意义。

表2 肾移植后尿毒症患者体内抗HLA-DRB1抗体产生情况Tab. 2 Anti-HLA-DRB1 antibody producing situation in uremic patient after renal transplantation
2.5 HLA-DRB1 抗原的表型分析
为了探究肾移植后尿毒症患者体内抗HLADRB1*01/*13/*14 抗体的频率显著低于其他抗HLA-DRB1 抗体的原因,我们用HLA Matchmaker(www.epitopes.net/)对HLA-DRB1基因序列进行了分析,结果显示,HLA-DRB1*01/*13/*14等位基因的编码产物具有共同的表位77T(图2),而其他HLA-DRB1 抗原没有,故尿毒症患者中抗HLA-DRB1*01/*13/*14 抗体的水平显著低于其他抗HLA-DRB1 抗体可能是由存在的共同表位77T所致。
2.6 验证HLA-DRB1*01/*13/*14具有共同表位
为了明确HLA-DRB1*01/*13/*14 蛋白具有共同表位,我们利用吸附试验进行验证。结果发现,用表达HLA-DRB1*01 的细胞与含有抗HLADRB1*01/*13/*14 抗体的血清共同孵育后,再次对抗HLA-DRB1 抗体进行检测时,三种抗体的MFI 值显著降低(P<0.01),差异具有统计学意义。用表达HLA-DRB1*13/*14 的细胞与含有这三种抗HLADRB1 类抗体的血清孵育后也得到与上述HLADRB1*01 抗原试验相似的结果(图3),说明HLADRB1*01/*13/*14具有共同表位。
为了进一步了解表位的特征,我们通过免疫多态性数据库-国际免疫遗传学数据库(www.ebi.ac.uk/ipd/imgt/hla/align.html)找到了相应的氨基酸序列(仅100 个氨基酸)。表3 为相应的氨基酸信息。三种HLA-DRB1 抗原的第77 位为苏氨酸(T),这与HLAMatchmaker的分析结果一致。

表3 HLA-DRB1*01:01、HLA-DRB1*13:01和HLA-DRB1*14:01分子的氨基酸信息Tab. 3 Information of the amino acids of HLA-DRB1*01:01,HLA-DRB1*13:01 and HLA-DRB1*14:01 molecules

图2 HLA-DRB1*01/*13/*14分子共同表位77T的结构图Fig. 2 The structure of common epitope 77T in HLA-DRB1*01/*13/*14 molecules
3 讨论
肾移植是治疗终末期肾病的最有效方法,通过替换失去功能的肾能达到根治效果。然而移植排斥反应的存在限制了治疗的效果。HLA 不匹配是造成移植排斥的主要因素,而表位不匹配则是HLA不匹配的主要原因。我们发现,HLA-DRB1*14与尿毒症患病率呈正相关,并且它可能是尿毒症的易感因素。尿毒症患者中抗HLA-DRB1*13/ *14 抗体的频率显著低于其他抗HLA-DRB1 抗体,推测其根本原因是:1)HLA-DRB1*13是保护性基因,即使错配也难以诱导抗体;2)HLA-DRB1*14在健康人群中的频率较低,在尿毒症患者中的频率较高,因而不能轻易产生相应的抗体。
为了进一步研究HLA-DRB1*13/ *14 的特征,我们用HLA Matchmaker 数据库搜索每个等位基因携带的表位,在比较后筛选出通用表位77T。有研究显示,HLA-DRB1*01/*13/*14 蛋白存在第77 位的苏氨酸(T)的表位,这与我们的试验结果相符合[14]。
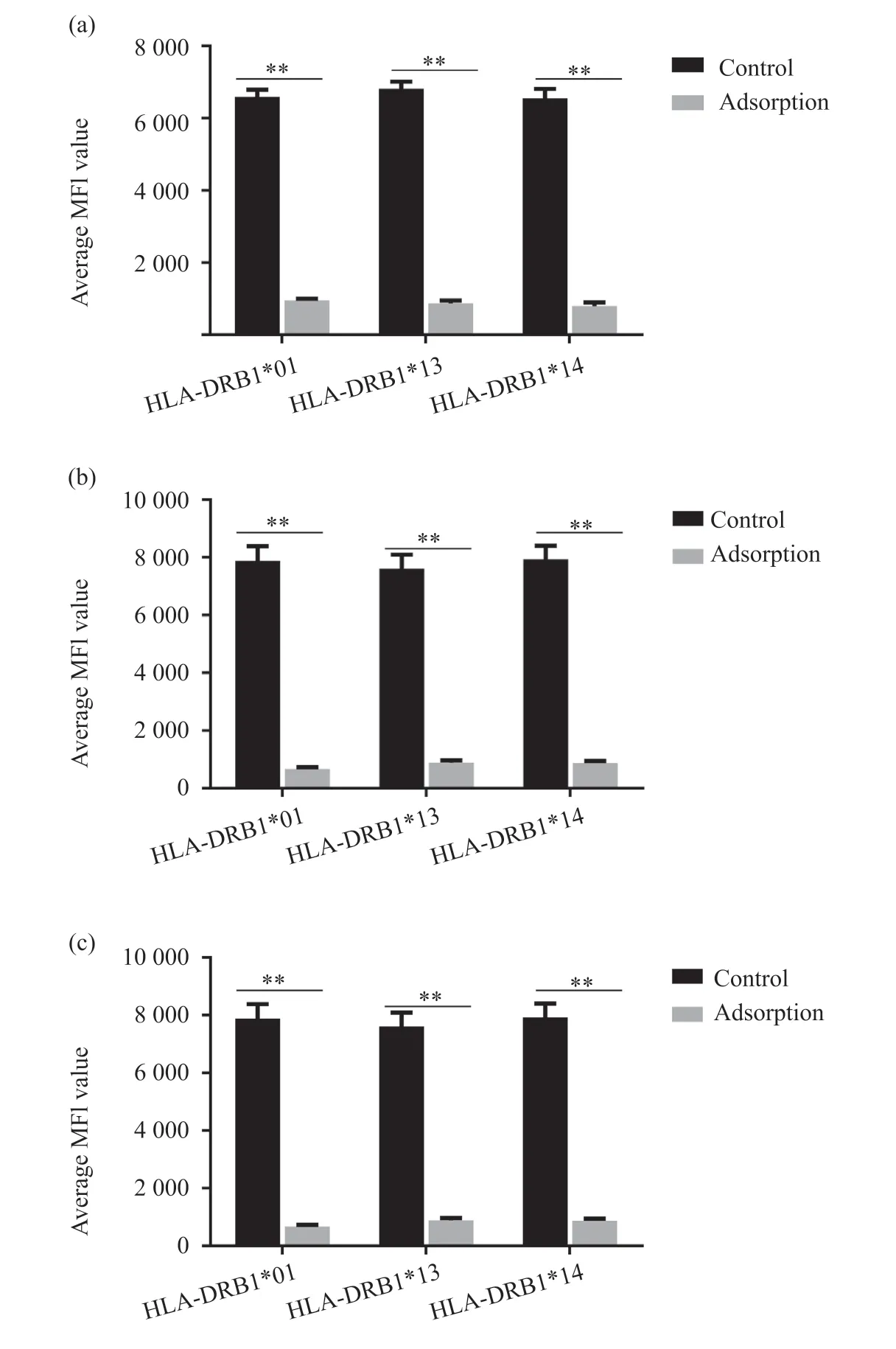
图3 稳定表达HLA-DRB1的细胞对抗体的吸附Fig. 3 Adsorption of antibodies by cells stably expressing HLA-DRB1
长期的临床研究表明,HLA 的匹配程度与肾移植的效果密切相关[15-17]。从理论上讲,完全匹配可以确保几乎没有移植排斥的风险。Terasaki 等[18]发现,与HLA-A、B 和DR 这6 个等位基因都错配的肾移植受者的10 年生存率比这6 个位点完全匹配的受者降低了30%,半衰期缩短了大约12 年。但也有与之相反的结果,如HLA-DR17 位点为纯合子时更能诱发移植排斥反应,而错配或杂合子却不容易引起移植排斥反应[19]。因此当肾移植受者带有HLADR17等位基因时,应选择不含该位点的供者,从而降低排斥反应发生的可能性。这与我们发现的HLA-DRB1*13有类似之处,即尿毒症患者进行肾移植时,虽然HLA-DRB1*13的错配可能性大,但却不易产生抗HLA-DRB1*13 的抗体。同时回顾性研究中发现,某些存在多个HLA 抗原错配的移植亦能取得较好的效果[20-21]。这些现象提示我们,传统的基于HLA等位基因分型的方法在预测移植排斥中的能力明显低于基于表位的分型方法,表位匹配比传统的等位基因匹配更能预防排斥反应的发生。
供受者之间HLA 匹配程度是肾移植后影响移植物存活的重要因素,随着HLA-I/II 类抗原错配程度的增高,发生急性排斥反应以及移植物失功的风险也在上升。即使在广泛使用免疫抑制剂的时代,HLA 匹配仍然是全世界范围内选择供肾的主要标准。对HLA-A、B、DR 位点的血清学分型是常用的判断移植抗原错配的方法,同时也是评估预测潜在的具有免疫兼容性的供受者的标准。我们用HLA Matchmaker 软件筛选了可能的表位,并通过数据库查询了其氨基酸序列,证实了HLADRB1*01/*13/*14这几种抗原中含有同一种表位。
肾移植是挽救终末期肾脏病患者的最佳手段。有效控制移植排斥反应,延长移植肾存活时间是肾移植中亟待解决的问题。本研究提供的数据可能支持进一步研究和开发有关移植肾排斥反应的新理论,也为以后阐明HLA-DRB1*13/*14 如何对个体具有保护或易感效应及其机制提供了参考。

