肺炎支原体的病原生物学研究进展
刘 瑶,廖国阳*
(1. 昆明医科大学,昆明 650550;2. 中国医学科学院北京协和医学院医学生物学研究所,昆明 650118)
肺炎支原体(Mycoplasma pneumoniae,MP)是一种能够引起呼吸道感染的人类病原体[1]。据报道,支原体科支原体属基因组是由普通革兰氏阳性菌祖先经过减少基因组的方式进化而来的[2]。在自然界中已经鉴定出200 多种支原体,但只有少数几种被证实可导致人类疾病,其中最重要的是MP。据统计,MP 可导致所有年龄段人群中高达40%的社区获得性肺炎(community-acquired pneumonias,CAP),并可引起地区性流行[3],在所有人群中普遍易感,其中对老人、儿童及免疫力低下人群危害更为严重。MP 感染不仅能引起发热、干咳等临床症状,还可引发多种并发症[4],造成机体多系统损伤[5],如哮喘、慢性阻塞性肺疾病等[6]。与其他种类的呼吸道病原体不同的是,尽管付出了巨大的努力,但肺炎支原体的疫苗仍无法获得[7]。
1 病原学特征
MP 呈单个纺锤形细胞,长1.0~2.0 μm,宽0.1~0.2 μm,二分裂方式繁殖,一般1~6 h分裂1代,可通过0.22 μm 的微孔滤膜,反复传代后,显微镜下观察菌落呈油煎蛋状(图1)[8]。MP 的基因组片断大小为816 394 bp,含730 个编码基因,约为大肠杆菌的1/6。MP 的基因组包含大量重复区域,称为RepMP,约75%的RepMP与MPN141(P1)和MPN142(P40/P90)具有同源性。根据P1 蛋白上RepMP2/3和RepMP4重复序列的不同,MP 可分成M129型(I型)和FH 型(Ⅱ型)[9]。RepMP与MPN141或MPN142之间的同源重组可在P1 或P40/P90 的抗原区域内产生变异,是MP 逃避免疫宿主系统监视的重要策略[10]。MP 的基因组小,生物合成能力有限,不能自主合成固醇类物质。其分离培养对培养基的营养成分要求较高,常以牛心消化液为基础培养基,加入酵母粉及动物血清混合制备。MP 对pH较为敏感,最适pH 为7.5~8.0,低于7.0 易死亡,且耐冷,在-70℃或液氮中菌株可被长期保存,在4℃保存不宜超过3 d。自然环境下,MP 需依赖宿主细胞提供营养生存,脱离宿主会迅速死亡,对于干燥的敏感性证实其只能通过飞沫传播[8]。
2 致病机制
MP 的运动性和传染性由免疫显性蛋白P1 和P40/P90 形成的被称为“Nap”的跨膜黏附复合物所介导[11]。目前研究表明,MP 的致病机制主要是感染后对宿主细胞的直接作用及引起机体的免疫病理损伤。
2.1 细胞黏附机制和分子机理
MP 对呼吸道细胞的黏附是其致病的主要原因,其与宿主上皮组织之间的紧密联系是导致疾病的前提,通常缺乏黏附能力的MP 也缺乏致病力。MP 的黏附作用是由其顶端极化的黏附细胞器结构介导的(图2)[12]。MP 的黏附作用和滑行运动由主要抗原蛋白P1 决定,其在呼吸道黏膜上的黏附和运动可被抗P1 抗体阻止[13]。P1 是与宿主细胞的唾液酸寡糖受体结合的主要抗原[14]。随着研究的深入,Krause 等[15]还证实了MP 的黏附功能也需要其他辅助蛋白[高分子量(high molecular weight,HMW)、P40、P65 蛋白等]及分子伴侣蛋白(TopJ、Lon 蛋白等)的参与。P1 被认为是MP 细胞中免疫力最强的蛋白质之一,在感染患者的免疫反应、诊断以及流行病学研究中起着重要作用[16]。P30 蛋白的作用与P1 蛋白相似,缺失会导致MP 的黏附功能丧失[8]。P40/P90 由MPN142基因编码的130 kD的蛋白水解切割得到的两个多肽组成[17]。研究显示,尽管P1 和P40/P90 大小不同,但两种蛋白的紧密关系表明二者具有最近的共同系统发生祖先[18]。除Nap 成分以外的蛋白质,P30、P41、P65、HMW1、HMW2 和PrpC/PrkC 对于MP 在上皮细胞表面的黏附作用和滑行运动也十分重要。研究显示,P41 和P24 对细胞生长和发育过程中附着细胞器装配的正确时机和位置至关重要。若缺少P41,滑行过程中黏附细胞器会与自身胞体发生分离[19]。HMW 蛋白能维持和稳定黏附细胞器的正常结构,保证P1、P30 蛋白的聚集、活化和黏附等过程正常进行。P90蛋白与P40 蛋白能将P1 蛋白锚定于黏附细胞器的细胞骨架上。
图1 肺炎支原体的显微镜照片Fig. 1 Microscopic view of Mycoplasma pneumoniae
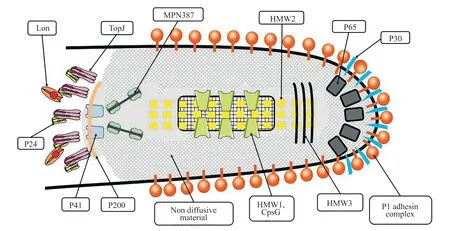
图2 黏附细胞器的结构模式图Fig. 2 Structure of attachment organelle
除黏附损伤外,MP 感染产生的过氧化物会造成机体损伤。在远源生物丝状支原体丝状亚种SC型(Mycoplasma mycoidessubsp.mycoidessmall colony,MmmSC)的研究中已经阐明了致病性与过氧化物形成之间的相关性[20]。MP 代谢甘油会导致过氧化物的产生[21],这表明相同的代谢途径可能导致肺炎支原体疾病的发生。此外,MP 产生的超氧阴离子可抑制宿主细胞中的过氧化氢酶,从而减少过氧化物的酶促分解,使宿主细胞更容易受到氧化损伤[22]。也有研究表明,MP 可通过对宿主细胞乳铁蛋白的吸收,在细胞代谢中使铁呈局部酸性的微环境,引入铁络合物产生高反应性羟基自由基,从而产生局部伤害,其中铁代谢还包括过氧化氢和超氧阴离子[23]。除了直接的氧化损伤外,MP 产生的过氧化氢还可能激活酪氨酸激酶依赖性信号通路,从而导致免疫系统异常激活[24]。
2.2 MP 与宿主细胞相互作用和免疫损伤
MP 能掠夺宿主细胞的营养成分进行复制和融合,并分泌细胞毒素,产生过氧化氢及超氧化物等,造成细胞病理损伤,或引起宿主细胞凋亡。研究发现,在不适于MP 生长的培养液中共同培养Hela 细胞和MP,MP 可进行增殖,而Hela细胞则发生病变,提示MP 可通过掠夺Hela 细胞的营养成分生长[25]。MP 可进入人肝细胞内复制生长[26],从而对肝脏组织造成伤害。MP 的MPN372基因编码的毒素蛋白称为社区获得性呼吸窘迫综合征毒素(community acquired respiratory distress syndrome toxin,CARDS TX),与MP 致病力密切相关,且该蛋白具有较强的免疫原性。细胞毒性包括对呼吸道上皮细胞的直接损伤作用[27],破坏呼吸道黏膜的完整性,使宿主细胞空泡化。宿主细胞死亡后释放胞内物质,引发炎症破坏组织内稳态,产生过度免疫反应[28]。MP的脂质相关膜蛋白(lipid-related membrane proteins,LAMPs)可通过TLR-1/2 或TLR-1/2/6 信号通路活化核转录因子-κB(nuclear transcription factor-κB,NF-κB)[29]。在发酵支原体中已证实LAMPs 可刺激TLR-2/6,活化NK-κB,最终导致细胞凋亡,因此推测MP 能导致宿主细胞凋亡或与此相关[30]。
MP 感染相关最常见的免疫现象是周围神经系统的损伤。研究显示,约有5%~15%的格林-巴利综合征病例与MP 感染相关[31]。MP 感染也与脑炎、急性脱髓鞘性脑脊髓炎和视神经炎的发生相关[32]。在一项针对近2 000 名脑炎患者的研究中,MP 被视为最重要的感染因子[33],大约5%的病例显示出急性MP 感染的证据,其中大多数为儿童。MP 感染宿主细胞后可介导吞噬细胞产生多种细胞因子介导非特异性免疫反应[34]。被MP 感染的人肺泡II 型肺细胞显示,白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子-a(tumor necrosis factor,TNF-a)和IL-1β mRNA 的产生增加[35],这表明MP 对人呼吸道上皮细胞的黏附会导致细胞因子的产生及淋巴细胞和其他炎性细胞的募集,并且这些细胞因子随后会调节炎性浸润的进展。由于受到局部损伤,被MP 寄生的哺乳动物细胞可表现出多种细胞病变,如使宿主细胞失去纤毛、出现空泡状,降低宿主细胞耗氧量、葡萄糖利用率、氨基酸吸收和大分子合成,最终导致宿主细胞死亡。这些局部损伤的临床表现为如持续性咳嗽等的急性呼吸道症状。MP 被证实可直接激活免疫系统的细胞产生细胞因子。Kristen等[36]证明,在共培养试验中,MP 可诱导肥大细胞产生IL-4,这主要取决于靶细胞膜和P1 黏附素上唾液酸残基的存在。MP 感染后能直接激活和诱导宿主免疫细胞产生细胞因子。Yang 等[37]的研究证实MP ATCC-15531 菌株可直接诱导A549 和U937 细胞产生IL-1β。机体感染MP 后,可产生相应组织的自身抗体,形成免疫复合物激活补体,产生大量中性粒细胞趋化因子,募集白细胞引起溶酶体释放出水解酶,导致破坏性病变及多系统损伤[38]。MP 感染会引起机体T 细胞亚群紊乱,Th1 型细胞免疫应答在MP 感染引起的病理损伤中起着重要作用[39]。MP 细胞膜上的糖脂类抗原可诱导体液免疫应答,CARDS TX 使小鼠产生特异性的IgE,使得哮喘加剧[40]。
MP 感染除诱发机体产生一系列特异性和非特异性免疫反应外,也会造成某些自身免疫反应,导致机体损伤。由于MP 和人体存在共同抗原,故其会引发机体自身免疫应答,导致多系统免疫损伤和肺外并发症[41]。此外,P1 蛋白的抗原多态性降低了特异性抗体的作用,黏附结构能抵抗纤毛的清除作用,MP 具有的免疫抑制作用和共同抗原的存在使其能逃避宿主的免疫监视,不被吞噬细胞识别摄取[42]。部分肺炎支原体肺炎(Mycoplasma pneumoniaepneumonia,MPP)患者的T 淋巴细胞功能暂时性抑制和对肺炎链球菌等合并感染与此相关。小鼠感染MP 后,其吞噬细胞活性和IgG 水平下降,提示MP 具有一定的免疫抑制作用[43]。
3 诊断与治疗
MP 感染的诊断方法包括MP 分离培养法、血清学抗体检测法、抗原检测法和核酸检测法等[44]。MP 感染的病例活检显示,MP 患者有黏膜表面的上皮内膜溃疡、支气管和细支气管的纤毛上皮溃疡、支气管和支气管壁水肿等症状[45],可作为MP 的临床诊断依据。但MP 感染各组织器官及肺部病变特征不具典型性,因此难以根据临床症状对MPP 进行确诊[45]。早期MPP 临床诊断常采用冷凝素测定法。该方法将疑似患有MPP 患者的血液收集于含抗凝剂试管中,冰浴30 s 后倾斜试管检查凝集现象,但在鉴别诊断中,EB 病毒(epstein-barr virus,EBv)、立克次氏菌、流感病毒和腺病毒等感染也可诱导冷凝集素的产生[46],因此该方法仅可作为MP 感染的参考。血清学检测是目前国内外最常用的MP 感染诊断方法。培养法是检验MP 的最佳方法和金标准,但其培养要求高、条件苛刻、耗时长,多数临检单位未能建立完整的检测体系,常用于回顾性诊断与研究,临床价值有限。核酸检测法有较好的特异性和灵敏性,可用于MP 感染的早期临床诊断。Razin等[47]对各种基于分子手段的MP 诊断方法进行了概述。Waites 等[48]对MP 临床诊断和药敏试验的最新方法进行了总结。但由于许多医院设备不全,缺乏质控标准,使MP 临床确诊仍具挑战性[49]。
目前临床上针对MPP 的治疗主要是抗生素治疗、纤维支气管镜、免疫抑制剂等治疗方法[50]。其中主要以大环内酯类抗生素治疗为主,对于急性患者可通过免疫抑制剂控制炎症反应,纤维支气管镜治疗能有效检查肺部局部病变情况。若大环内酯类抗生素治疗无效果,需综合考虑多种致病因素,进行MP 的耐药性检测,从而选择敏感的药物进行针对性治疗[51]。目前我国抗大环内酯类抗生素的MP 耐药菌耐药率高达90%以上,耐药形势十分严峻[52]。因此,MP 疫苗研制是防治MP 感染的有效方案。
4 疫苗研究现状
早期研究结果显示,常规方法制备的MP 灭活疫苗对人体具有一定的保护作用。甲醛灭活的MP 疫苗辅以明矾佐剂注射后可降低肺炎和呼吸道感染的发生率[53]。但也有研究显示,人类[54]和小鼠[55]中存在接种MP 疫苗后再次感染加剧病情的情况。陈枫[56]的研究显示,传代减毒株疫苗具有一定的保护效果,且通过鼻内免疫的效果要优于皮下免疫接种,提示黏膜免疫提供的免疫保护在抵御MP 感染中发挥重要作用。
P1 和P30 抗原是目前MP 基因工程亚单位疫苗的研究热点。P1 蛋白是MP 表面抗原中目前被认为最具潜力的疫苗候选抗原。研究显示,P1 蛋白编码基因C'端编码的蛋白具有较强的免疫原性,但相较于全菌体,其免疫原性低[57]。Vizarraga 等[18]在最新的研究中阐明了MP 中蛋白P1、P40/P90 以及与唾液酸化寡糖结合的P40/P90 复合物这些免疫优势蛋白的抗原结构,其中对P1 的不同片段的血清学测试发现,IgG 抗体对保守区的识别偏好高于可变区,表明选择这些保守区域进行疫苗设计是进行长期免疫的系统策略。值得注意的是,其结果还表明,来自P1 的C 末端结构域仅包含一个无序环,且没有遗传变异性。此外,P1 的全长细胞外区域被所有血清强烈识别,而与IgG 或IgM 的比例无关,这也证实了P1 的免疫优势。这些结果表明,C 末端结构域可能是一个相对较弱或难以接近的抗原区域,说明该区域能够有效产生特异性较强的抑制MP 黏附的IgG 抗体,提示该结构域的免疫原性具较高的研究意义。
有研究显示,即便MP 疫苗在佐剂的作用下具有良好的免疫原性,刺激机体产生的抗体也并不能为机体提供有效保护。另外在注射疫苗完成免疫后,再次感染MP 时,往往会出现免疫激化的现象,从而导致机体损伤[58]。这些都是目前MP 疫苗研发过程中亟待解决的问题。
5 总结与展望
当前国内外虽然对MP 的研究较为深入,但针对支原体的病原学研究相对较少。关于支原体分离和鉴定标准的制定、菌种库的建立、精准检测方法的实施等的研究对于MP 感染的诊断十分重要。MP 在所有人群中普遍易感,并可导致儿童重症肺炎和老年组人群的慢性阻塞性肺炎(chronic obstructive pulmonary disease,COPD),从而危及生命,缩短人均预期寿命。尤其是对于MP 耐药菌株或多重耐药菌的感染,其临床治疗非常困难。因此目前急需建立针对MP 感染的早期快速诊断方法。另外,针对其他动物感染的支原体早已有商业化的疫苗上市,并且得到了广泛的使用,因此,应加强人用新型治疗性药物和安全有效的人用MP 疫苗的研发。综上所述,进一步深入MP 基础研究、建立快速可靠的检测方法、加强MP 疫苗的研发对于MP 的预防控制及治疗刻不容缓。

