甘薯基因组BBX转录因子基因鉴定与逆境胁迫表达分析
毕楚韵 ,黄小芳 ,黄伟群 ,刘江洪 ,胡韵卓 ,黄碧芳 ,林世强 ,*,陈选阳 ,5*
(1.福建农林大学作物生物技术福建省高校重点实验室,福州 350002;2.福建农林大学农学院,福州 350002;3.福建省种子总站,福州 350003;4.福建农林大学生命科学学院,福州 350002;5.福建农林大学教育部作物遗传育种与综合利用重点实验室,福州 350002)
植物转录因子在植物的生长发育和响应环境变化等生理生化过程中发挥重要作用,通常根据其蛋白结构的特征分为各个家族。Plant TFDB数据库(plant transcription factor database,Plant TFDB)[1]目前已收录包括ZFP、WRKY、MYB、TCP等60多种植物转录因子家族。锌指蛋白(zinc-finger protein,ZFP)是植物中一类数量较多的转录因子家族[2],其主要特征是含有手指状的结构域,且能与锌离子结合。植物锌指蛋白通常含有1~4 个锌指结构[3]。BBX(B-Box)是锌指结构蛋白家族的一个亚家族[4],含有1~2个B-box保守结构域,根据氨基酸序列的特征分为B-box 1(B1)和 B-box 2(B2)。除了 B-box 结构域,一些 BBX 蛋白还拥有 CCT(CO,CO-like,TOC1)结构域。CCT结构域最早被发现于CO(CONSTANS)蛋白的C端,具有核定位功能[5]。随后在CONSTANS类基因和TOC1基因编码的蛋白中也存在且保守,故以该3个基因的首字母命名CCT结构域[6]。BBX转录因子根据序列所含结构域的情况,分为5种类型:Ⅰ/Ⅱ类型(B1+B2+CCT)、Ⅲ类型(B1+CCT)、Ⅳ类型(B1+B2)和Ⅴ类型(B1)[7]。
近年来BBX转录因子在植物中的功能研究越来越多,包括BBX家族在生物或非生物胁迫、光形态建成、植物成花和避荫响应等过程中的作用。Liu H.等的研究显示[8],植株超表达水稻OsCOL9基因后对稻瘟病的抗性增强,敲除基因后则对稻瘟病易感。拟南芥AtBBX18受热胁迫诱导表达,超表达情况下使植株的耐热性下降,对耐热呈负调控作用[9]。植物中由光信号介导的生理过程很多,具有非常重要的作用。拟南芥的BBX转录因子AtBBX25突变体植株在蓝光、红光和远红光下抑制胚轴的生长,影响植物光形态的建成[10]。HY5基因是促进光建成的调控因子,AtBBX21和AtBBX22互作可作用于HY5基因的启动子,促进其表达[11-12]。拟南芥CO(CONSTANS)是第一个被鉴定为BBX转录因子家族的蛋白,它能通过CCT结构域直接与开花基因FT(FLOWERING LOCUS T)的启动子区域结合,激活其转录并开启植物开花机制[13]。植物生长过程中在光照不足的情况下,如植物间的生长密度过高,相互遮蔽导致植物产生避荫响应,会促使植物竞争性生长,根据C.D.Crocco等的研究,AtBBX24对避荫响应具有促进作用[14]。
甘薯(Ipomoea batatas)是我国重要的粮食作物,含有丰富的营养物质,具有提高人体免疫力、抗衰老等保健功能[15]。本研究利用生物信息学的分析方法,对甘薯全基因组进行BBX转录因子家族成员的挖掘和鉴定,并分析其系统进化关系、染色体定位、基因相似度、保守结构域和保守基序。利用SRA数据库中的转录组数据,分别研究甘薯苗期蔓割病真菌胁迫和块根储藏期冷胁迫下的基因差异表达情况,为研究甘薯BBX转录因子基因的分子机制建立基础。
1 材料和方法
1.1 甘薯全基因组基因注释和BBX基因鉴定
从NCBI下载得到甘薯栽培种“泰中6号”全基因组数据[16],根据黄小芳等[17]的方法得到甘薯全基因组蛋白质序列。从Pfam数据库网站下载B-Box保守结构域的HMM模型(PF00643),在甘薯全基因组蛋白序列内检索。通过CDD(conserved domain database)[18]和 InterProScan(http://www.ebi.a-c.uk/interpro/)进行保守结构域预测,删除没有B-Box结构域的蛋白。用得到的甘薯蛋白序列制作新的HMM模型,并重新检索和筛选。使用AUGUSTUS[19]对结构域缺失的蛋白进行预测和校对。最终得到24个甘薯BBX蛋白。
1.2 染色体定位和基因相似度分析
建立甘薯BBX基因库,使用Blastn进行检索,得到序列相似度高的基因对。计算每条序列的长度并根据Gu Z.等[20]的定义进行筛选,即两条基因序列的相似度高于75%且相似片段长度大于较长那条基因的75%。使用Circos绘图。
1.3 保守序列分析
通过Clustal Omega软件对24个甘薯BBX转录因子的蛋白序列进行比对,手动调节并分别截取出长度为47个氨基酸的B-box1(B1)保守结构域片段、长度为44个氨基酸的B-box2(B2)保守结构域片段和长度为43个氨基酸的CCT保守结构域片段,遵循Clustal X的配色规则制图并分析。
1.4 系统进化树构建
使用 MEGA X,以 NJ(Neighbor-Joining)算法构建甘薯BBX蛋白全长序列、B-Box 1保守结构域氨基酸序列、B-Box 2保守结构域氨基酸序列和CCT保守结构域氨基酸序列的系统进化树。
1.5 保守基序分析
使用MEME寻找甘薯BBX转录因子中的保守基序,设定个数为15。
1.6 基因的抗逆表达模式分析
利用蔓割病真菌胁迫实验得到的转录组数据[21]和Ji C.Y.等[22]甘薯储藏期冷胁迫下的转录组数据,经过Hisat2软件进行比对,并用DESeq2处理后,通过Pheatmap绘制热图。
2 结果与分析
2.1 甘薯BBX转录因子的鉴定和系统进化分析
从甘薯全基因组中筛选并鉴定到24个BBX转录因子。为了进一步了解甘薯BBX蛋白在进化上的关系,我们利用MEGA X,使用NJ方法(bootstrap:1 000)构建BBX蛋白全长序列的系统进化树(图1)。从图中看出,甘薯BBX蛋白大多以类型划分在同一进化树区域内。甘薯BBX转录因子的Ⅲ类型(红色圆圈)与Ⅴ类型(绿色圆圈)的蛋白亲缘关系较近,无法单独归为进化树的一个分支,但能在进化树关系上与其他3种类型区分,这样的情况与水稻(Oryza sativa L.ssp.japonica)[23]和茶树(Camellia sinensis(L.)O.Ktze.)[24]BBX转录因子的进化树相似。Ⅰ类型BBX蛋白(紫色圆圈)与Ⅱ类型蛋白(黄色圆圈)拥有2个B-Box保守结构和1个CCT结构域,进化关系较近,聚类在不同的进化树分支内。其中CM008339.1-snap.761蛋白只含有2个B-Box保守结构域,属于Ⅳ类型BBX蛋白(蓝色圆圈),出现在Ⅰ类型和Ⅱ类型BBX蛋白中,原因是CM008339.1-snap.761与CM008339.1-snap.758编码的氨基酸序列相似度高。

图1 甘薯BBX转录因子全长序列进化树Figure 1 Phylogenetic tree of full-length BBX transcription factors in I.batatas
为了分析甘薯BBX转录因子中B-Box 1、BBox 2和CCT保守结构域在进化上的关系,分别截取其氨基酸序列构建进化树(图2)。从图中可以看出,Ⅰ类型BBX蛋白与Ⅱ类型BBX蛋白的B-Box 1结构域、B-Box 2结构域和CCT结构域在进化关系上,均属于同一进化树分支,聚类在不同的小分支内。Ⅲ类型(B1+CCT)的BBX蛋白CM008337.1-snap.10049和CM008337.1-snap.11563,在B-Box1与CCT结构域进化树中,属于同一进化树分支,区别于Ⅰ和Ⅱ类型的BBX蛋白。
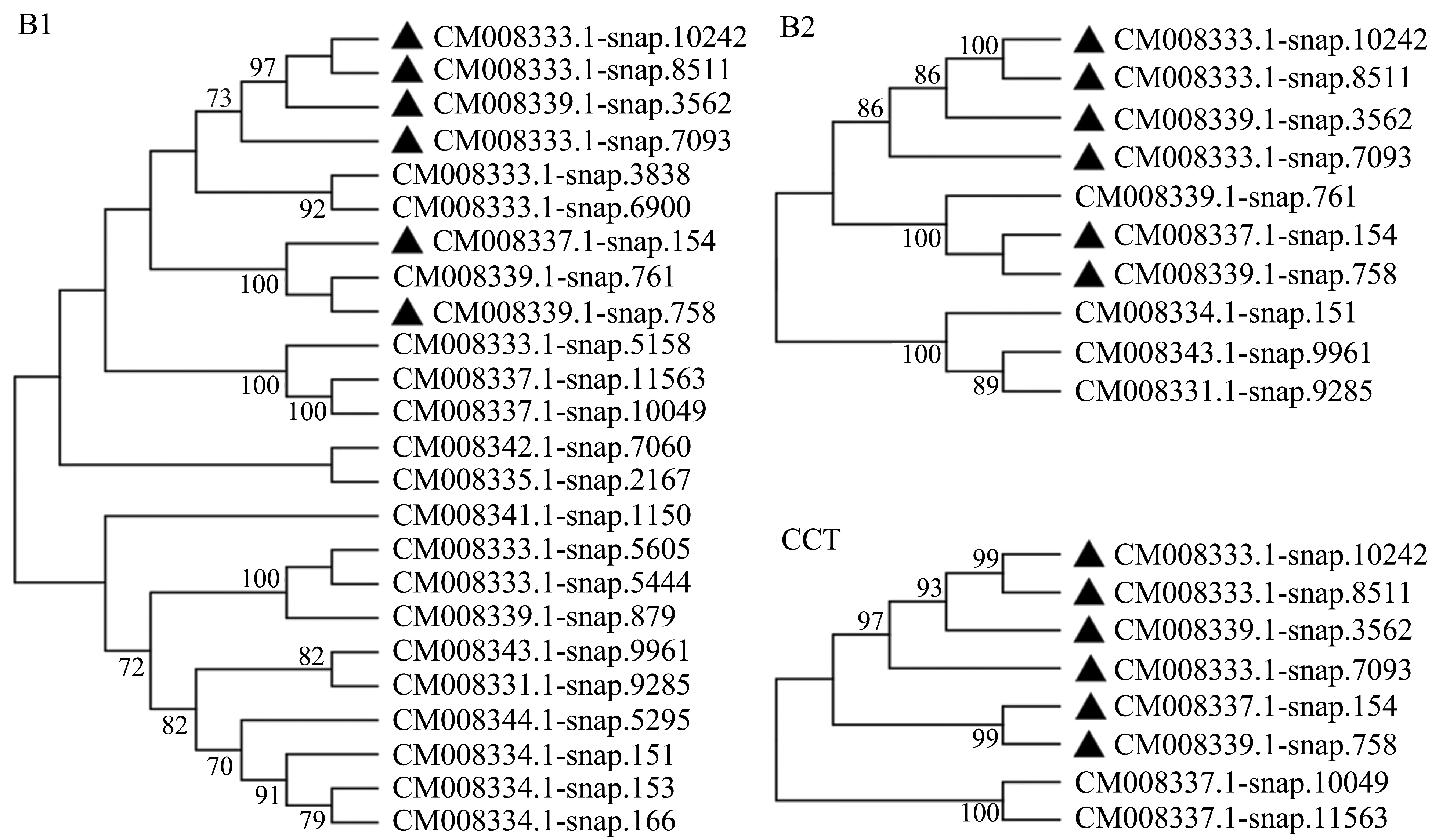
图2 甘薯BBX转录因子保守结构域进化树Figure 2 Phylogenetic tree of conservative domains of BBX transcription factors in I.batatas
2.2 甘薯BBX转录因子的染色体定位和基因相似度
从甘薯全基因组中鉴定并筛选到24个BBX基因,这些基因不均匀分布在甘薯的15条染色体上(图3)。第3号染色体上的BBX基因最多,共8个,占全部BBX基因数量的三分之一;9号次之,有4个。基因可根据在染色体上基因之间的距离分为单个基因和基因簇两种情况,基因簇由在同一范围的两个或两个以上的基因构成。甘薯染色体中有2条染色体上分布有基因簇,分别为第4号染色和第9号染色体。第4条染色体上的基因簇由CM008334.1-snap.151、CM008334.1-snap.153 和CM008334.1-snap.166组成,它们之间的距离分别为2 955 bp和64 623 bp。第9号染色体的基因簇由CM008339.1-snap.761和CM008339.1-snap.879组成,基因之间的距离为392 867 bp。在基因的进化过程中,会发生基因复制的现象,这是基因增加的一种方式[18]。在甘薯24个BBX基因中,存在5对相似度较高的基因。在同一条染色体内的相似基因有4对,分别为3号染色体上的CM008333.1-snap.5444和CM008333.1-snap.5605、CM008333.1-snap.8511 和 CM008333.1-snap.10242;7号染色体上的CM008337.1-snap.10049和CM008337.1-snap.11563;9号染色体上的CM008339.1-snap.758和CM008339.1-snap.761。1对在7号染色体和9号染色体间,基因分别为CM008337.1-snap.154和 CM008339.1-snap.761。

图3 甘薯BBX基因染色体定位及基因相似度分析Figure 3 Analysis of chromosomal localization and gene similarity of BBX genes in I.batatas
2.3 BBX转录因子的保守结构域序列分析
BBX转录因子可以根据保守结构域分为Ⅰ~Ⅴ类。Ⅰ类和Ⅱ类的BBX转录因子有2个B-Box保守结构域和1个CCT结构域。Ⅲ类BBX蛋白有1个B-Box结构域和1个CCT结构域,Ⅳ类BBX蛋白有2个B-Box结构域,Ⅴ类只有1个BBX结构域。甘薯BBX蛋白Ⅰ~Ⅴ类的个数分别为2、4、2、4和12。Ⅴ类BBX蛋白最多,占全部的50%。甘薯BBX蛋白的长度跨度较大,最短的为CM008344.1-snap.5295(65个氨基酸),最长的为CM008339.1-snap.3562(785个氨基酸)。在甘薯BBX蛋白的N端截取长度为47个氨基酸的B-Box 1结构域。比对结果显示(图4),大部分的甘薯BBX蛋白包含较为完整的B-Box 1结构域且保守性较高,除了CM008333.1-snap.10242缺失15个氨基酸。从图中可以看出,BBox 1结构域的锌指形式为C-X2-C-X8-C-X7-C-X2-C-X4-H-X8-H。在长度为38个氨基酸的锌指结构域中有12个氨基酸位点为疏水性氨基酸(图中显示为蓝色),占锌指结构域的32%。

图4 甘薯BBX转录因子B-Box 1保守结构域分析Figure 4 B-Box 1 conservative domains of BBX transcription factors in I.batatas
B-Box 2结构域位于B-Box 1之后,长度约44个氨基酸。根据图5所示,甘薯BBX转录因子的BBox 2保守结构域的形式为C-X2-C-X8-C-X7-CX2-C-X4-H-X8-H。结构域中半胱氨酸(C)以及疏水性的氨基酸保守性较高,其他位点的氨基酸差异较大。
甘薯的BBX蛋白中共有8个蛋白有CCT保守结构域,截取40~43个氨基酸进行比对分析(图6)。从图中可以看出,甘薯BBX转录因子的CCT保守结构域较为保守,带正电荷的氨基酸较多(图中呈红色),包括精氨酸(R)和赖氨酸(K),占 CCT结构域氨基酸的40%,其次较多的为疏水性氨基酸位点(图中呈蓝色),占CCT结构域氨基酸的23%。
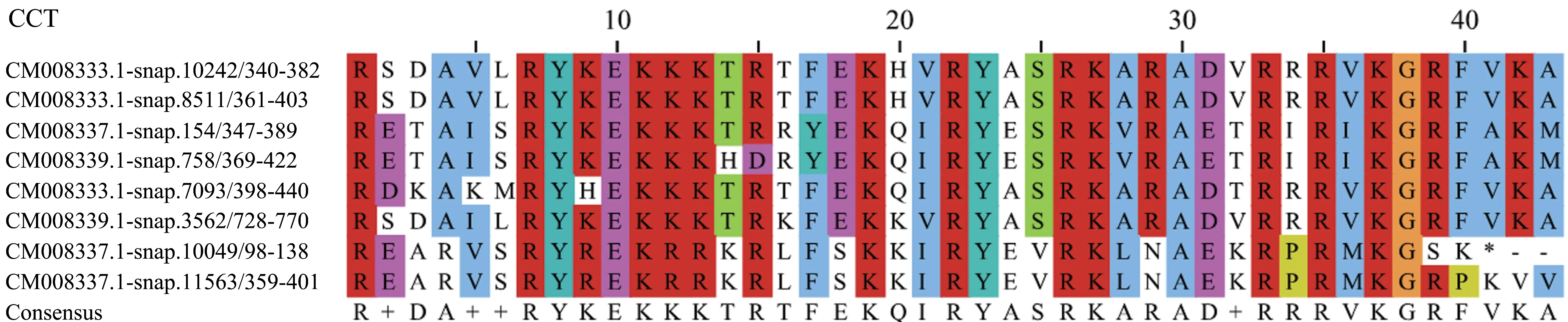
图6 甘薯BBX转录因子CCT保守结构域分析Figure 6 CCT conservative domains of BBX transcription factors in I.batatas
2.4 甘薯BBX转录因子保守基序分析
将甘薯BBX转录因子按照所含保守结构域进行分类,并以序列的长度从短到长排序,经过MEME软件检索后共检索到15个保守基序(Motif),得到甘薯BBX转录因子保守基序分布图(图7)。含有B1+B2+CCT结构域的蛋白,即Ⅰ和Ⅱ类型BBX蛋白,有11种保守基序,保守基序的种类较为丰富;B1结构域的蛋白拥有的保守基序种类最少,只有3种。甘薯的BBX蛋白都含有motif 1。其次,13个BBX蛋白中均有motif 9,占全部蛋白数量的54%,出现率较高。Ⅰ和Ⅱ类型BBX蛋白均含有形式为motif 1-motif 3-motif 5的保守基序串,以及motif 2。motif 15和motif 13是B1+CCT形式的蛋白所特有的保守基序。
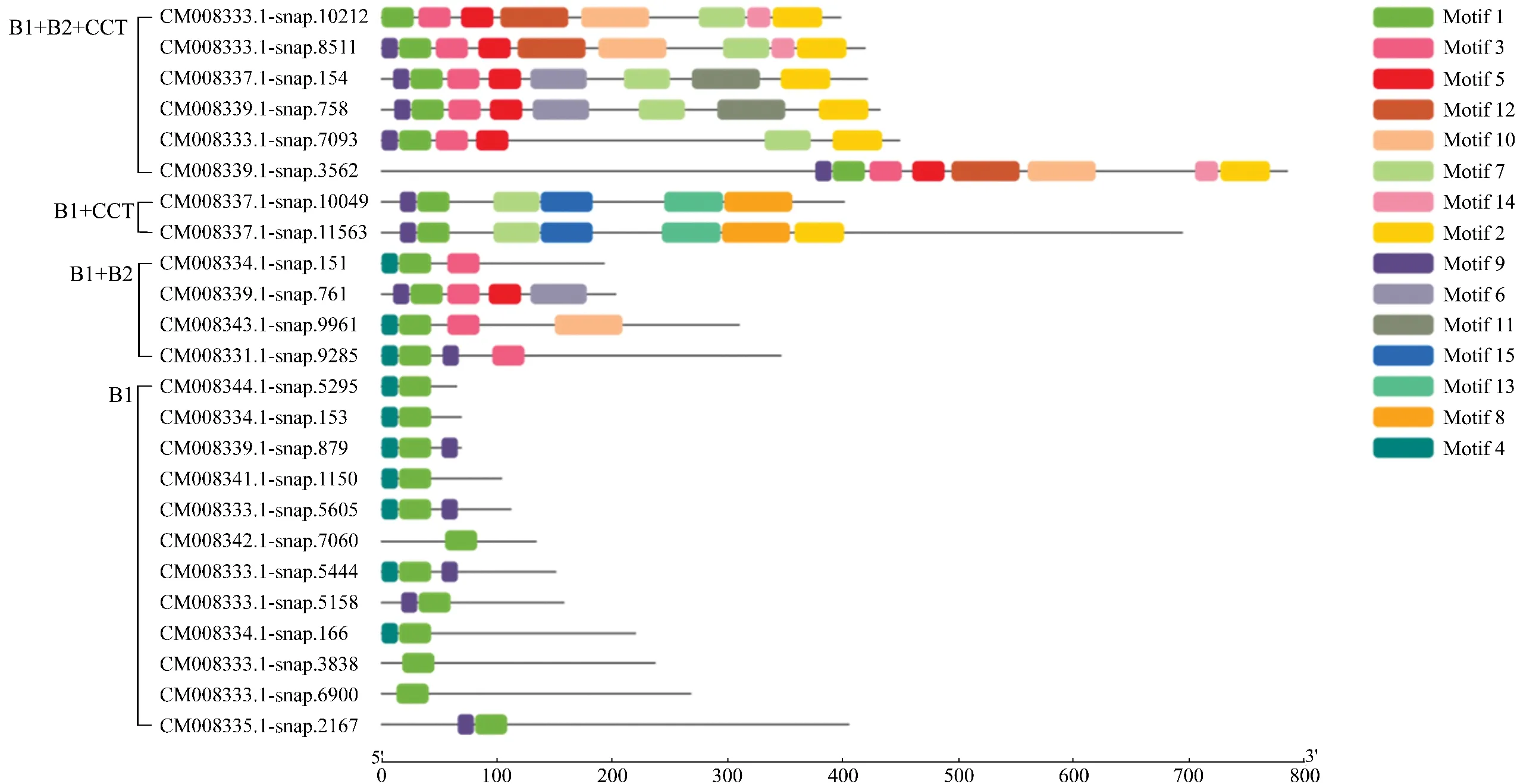
图7 甘薯BBX转录因子的基序分布Figure 7 Motif distribution of I.batatas BBX transcription factors
根据表1所示,MEME软件检索到的15个保守基序长度在15~60个氨基酸之间,长度最短的保守基序为motif 9(长度为15个氨基酸),较长的保守基序(长度为60个氨基酸)有4个,分别为motif 8、motif 10、motif 11和motif 12。结合保守结构域分析(图4),B-Box1结构域的锌指形式为C-X2-C-X8-C-X7-C-X2-C-X4-H-X8-H,motif 4和motif 9为CX2的两种形式,motif 1为C-X7-C-X2-C-X4-H-X8-H部分,由于结构域的第2个半胱氨酸(C)后的8个氨基酸在甘薯BBX转录因子中保守性较低,C-X8没有被MEME检索为保守基序。motif 4(或motif 9)与motif 1构成不完整的B-Box1结构域。B-Box2保守结构域的形式为C-X2-C-X8-C-X7-C-X2-C-X4-H-X8-H,motif 3为 C-X2-C-X8-C-X7-C-X2-C-X4-H部分,motif 5包含结构域的最后一个组氨酸(H)及后面较为保守的氨基酸序列。motif 3和motif 5构成较为完整的B-Box2保守结构域。由甘薯BBX转录因子CCT保守结构域分析图(图6)可知,CCT保守结构域的序列预测为R+DA++RYKEKKKTRTFEKQ IRYASRKARAD+RRRVKGRFVKA(下划线部分为较为保守的氨基酸),与motif 2一致,因而motif 2代表甘薯BBX转录因子的CCT结构域保守基序。

表1 甘薯BBX转录因子的保守基序长度及其氨基酸序列Table 1 The length and amino acid sequence of conservative motifs for the BBX transcription factors in I.batatas
2.5 甘薯BBX转录因子在生物胁迫 (蔓割病菌侵染)下的表达分析
为研究甘薯苗期受蔓割病真菌侵染后转录组中表达发生差异的基因,我们之前报道的研究分别选取2个抗病性不同的甘薯品种(高抗病品种JS57,感病品种XZH)和致病性不同的蔓割病菌(强致病性病菌F07,非致病性病菌F04)进行蔓割病侵染实验[21]。经分析,在24个BBX基因中有3个基因在F04侵染JS57后表现出差异表达,log2FoldChange值范围为-1.11~2.33(图 8)。CM008333.1-snap.10242 和 CM008333.1-snap.8511均上调表达(log2FoldChange值分别为2.33和1.52),是第3号染色体上的片段复制基因对(图3),其编码的蛋白拥有类似的保守结构域(B1+B2+CCT)。
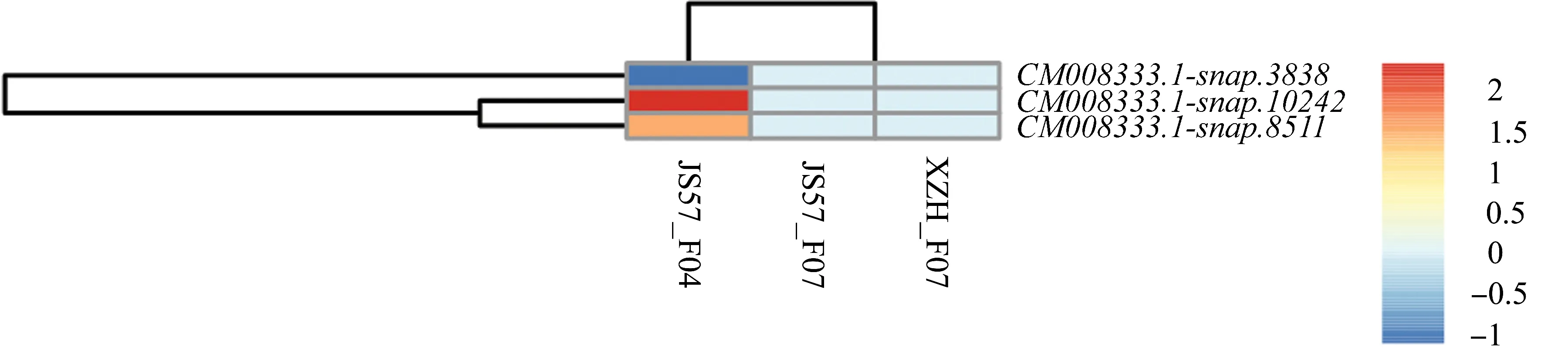
图8 甘薯BBX基因在甘薯蔓割病菌胁迫下的差异性表达Figure 8 Differential expression of BBX genes in I.batatas under the stress of Fusarium oxysporum f.sp.batatas
2.6 甘薯BBX转录因子在非生物胁迫(块根储藏期低温)条件下的差异表达分析
甘薯在收获后通常要经过一段时间的贮藏,再流通到销售平台进行售卖。为了延长甘薯的货架期,低温贮藏是目前较为普遍的一种甘薯保鲜方式。为了研究甘薯块根在贮藏期受到冷害的机制,Ji C.Y.等[22]利用两种对低温敏感度不同的甘薯品种(低温耐受性好:Xushu15_1,低温耐受性差:Xushu15_4),分别以4℃的条件贮藏2周或6周,测得实验组与对照组的转录组数据。我们结合该转录组数据和挖掘的甘薯BBX转录因子进行分析,得到13个在冷胁迫实验中发生差异表达的基因(图9),涵盖了Ⅰ~Ⅴ类型,分别有1、3、2、1和6个,Ⅴ类型的基因最多,占46%。BBX基因在冷胁迫下的表达差异较大,log2FoldChange值的范围为-7.00~2.57。

图9 甘薯BBX基因在甘薯低温胁迫下的差异性表达Figure 9 Differential expression of BBX genes in I.batatas under low temperature stress
根据图9中的实验组聚类所示,基因的差异表达情况主要以冷胁迫持续的时间(2周或6周)分类。当甘薯块根在储藏期受到冷胁迫时,多数的BBX基因表达量下降,只有CM008333.1-snap.5444和CM008333.1-snap.5605的表达量增加。CM008333.1-snap.5444仅在Xushu15_1低温储藏6周后上调表达。Xushu15_1和Xushu15_4低温储藏6周后,CM008333.1-snap.5605均上调表达(log2FoldChange分别为2.67和2.57),上调表达的幅度一致。在下调表达的11个基因中,有些基因只在耐冷性较好的Xushu15_1中发生差异表达,例如CM008339.1-snap.3562和CM008339.1-snap.761在Xushu15_1块根4℃储藏2周和6周时表达量均降低,在Xushu15_4中则表达无明显差异。有些基因在两个甘薯品种中的表达差异相似,例如CM008337.1-snap.10049和CM008337.1-snap.11563在2周和6周时表达量均下调,且6周的下调幅度更大。还有一些基因仅在一个实验组中存在差异表达的现象,例如CM008333.1-snap.8511仅在Xushu15_4_Cold_6w的实验组中表达量下调。
3 讨论
BBX转录因子家族作为一类锌指蛋白,参与植物中许多光信号途径,如植物光形态建成、植物成花和避荫响应等,在生物及非生物胁迫中也具有一定功能,广泛参与植物各种生长发育过程。本研究通过Snap基因注释、HMM模型预测、CDD结构域分析等生物信息学手段,鉴定甘薯BBX转录因子家族成员,并分析蛋白全长序列和保守结构域的系统进化树、基因相似度、保守结构域、保守基序、生物胁迫(蔓割病真菌)及非生物胁迫(低温)下的抗逆表达模式。
甘薯全基因组中共鉴定到24个BBX转录因子,这与葡萄(Vitis vinifera L.)[25]和花生(Arachis duranensis.)[26]的数量一致,略少于拟南芥(Arabidopsis thaliana)的 32 个[7]、水稻的 30 个[23]和番茄(Solanum lycopersicum)的29个[27]。检索到的保守基序中,motif 3和motif 5构成较为完整的B-Box2保守结构域,motif 2代表CCT保守结构域。甘薯BBX转录因子的B-Box 2保守结构域的形式为C-X2-C-X8-C-X7-C-X2-C-X4-H-X8-H,这与水稻的B-Box 2的形式一致[23]。在甘薯的5对相似度较高的基因中,CM008339.1-snap.761基因分别与CM008337.1-snap.154和CM0 08339.1-snap.758的序列相似(图3),其编码的蛋白全长序列(图1)、B-Box 1结构域和B-Box 2结构域的进化树(图2)都聚类在同一分支。在甘薯块根储藏期冷胁迫下,这3个基因的表达均显著降低。拟南芥BBX转录因子的进化树中属于同一进化树分支的AtBBX20和AtBBX21,研究发现均能抑制植物的避荫响应[14],因此推测这3个甘薯BBX转录因子可能具有类似的功能。
尖孢镰刀菌甘薯专化型Fusarium oxysporum f.sp.batatas(Fob)引起的甘薯蔓割病是甘薯生产上的主要病害之一[28]。2017年张欢等[29]发现IbBBX24分别在对Fob真菌敏感和抗性的甘薯植株中显著性差异表达。研究表明,过表达该基因能够显著提高转基因甘薯的茉莉酸含量,增强其蔓割病抗性,原因是IbBBX24蛋白能够结合在茉莉酸信号转导途径关键蛋白IbJAZ10和IbMYC2的启动子上,抑制IbJAZ10但激活IbMYC2的表达[30]。我们分析Lin Y.等[21]得到的转录组数据,发现甘薯在蔓割病菌侵染后,有3个甘薯BBX基因发生差异性表达。CM008333.1-snap.10242和CM008333.1-snap.8511在蔓割病胁迫下的表达模式类似,且基因相似度高,可能参与蔓割病胁迫的响应过程,可为研究蔓割病胁迫相关基因提供参考。甘薯在收获后通常需要进行一段时间的低温贮藏,可能造成甘薯块根受到冷害。本研究结合Ji C.Y.等[22]的转录组数据分析,发现甘薯块根中有13个BBX基因表达量发生变化,大多数的基因表达量下调。可为进一步研究甘薯BBX基因耐冷功能以及甘薯的抗冷育种提供重要信息。

