体重对草鱼鱼肉鱼糜特性的影响
谭小千,但 静,李树红
(四川农业大学食品学院,四川雅安 625014)
草鱼(Ctenopharyngodon idella),属于鲤形目鲤科雅罗鱼亚科草鱼属[1],已经在40多个国家内被广泛养殖,同时其作为四大家鱼之一,也是我国主要的淡水养殖经济鱼种,其2019年淡水养殖年产量位居全国第一位,达553.31万t[2]。草鱼不仅适应能力强、生长快、产量高[3],而且肉质肥嫩、肉味鲜美、价格低廉,因此草鱼已成为淡水鱼加工的主要原料[4]。鱼糜是经采肉、绞碎、漂洗、喷淋、精滤和脱水等步骤形成的稠而富有黏性的鱼肉浆[5]。以鱼糜为原料加工的鱼糜制品,风味独特、无刺骨、无腥味、保质期长以及含有高度不饱和脂肪酸等特点,其年产量逐年增加,2019年的我国鱼糜及其制品年产量高达139.40万t[6],前景广阔。尽管鱼糜的生产原料主要是海水鱼,但是由于近年来过度捕捞以及环境污染等问题,以海水鱼为原料的鱼糜生产受到了一定程度的限制。而产量高、肉厚色白并且高蛋白低脂肪的淡水草鱼已逐渐成为我国鱼糜生产的另一种主要的原料来源[7-8]。
已有众多研究表明鱼类的耗氧率、耗氧量、吸收率和生长率等这些直接或间接地反映鱼类新陈代谢的规律及其生理状况的指标与鱼类体重显著相关[9-13]。目前已有学者陆续从饲料营养的角度阐述了不同营养素水平对特定体重鱼的品质影响,如对体成分[14]、鱼肉硬度[15]、货架期[16]和持水性[17]等品质的影响,然而对于同一适宜营养水平下,达到商品规格的不同鱼体重与其肉质及鱼糜品质的关系研究,尚十分有限。
优质鱼糜是生产高品质鱼糜制品的基础,同时鱼糜制品的最主要质构特性——凝胶强度,决定着鱼糜制品品质的优劣。在鱼糜凝胶化过程中,盐溶性的肌原纤维蛋白分子之间相互缠绕,巯基(Sulfhydryl,SH)被激活氧化成二硫键,产生架桥,形成凝胶网状结构,使得凝胶结构更加稳定[18-19]。而衡量鱼糜品质的指标包括盐溶性蛋白含量、鱼糜白度、Ca2+-ATPase活性、总巯基(total sulfhydryl,TSH)含量、凝胶强度等质构特性等[10,20-21]。因此,本文首先对不同商品规格草鱼加工的鱼糜品质进行了对比研究,以期为后续选择适宜生产草鱼鱼糜的原料鱼规格提供科学依据,进而有助于提高并保持稳定的鱼糜产品的品质。
1 材料和方法
1.1 材料与试剂
1.1.1 试验材料
采购自雅安市农贸市场的鲜活健康的雄性草鱼(均来自同一养殖场,饲喂方式及饲料营养水平相同),将其按体重分为 1 000 g±100 g(A组)、1 500 g±150 g(B组)及 2 000 g±200 g(C 组),每个体重组各10尾鱼。置于冰块上运回实验室。
1.1.2 试验试剂
蛋白浓度测定试剂盒、Ca2+-ATPase测定试剂盒,南京建成生物工程研究所;三羟甲基氨基甲烷(Tris),天津科密欧化学试剂有限公司;乙二胺四乙酸二钠(Na2EDTA)、尿素,成都科龙化工有限公司。
1.2 仪器与设备
Scientz-IID超声波细胞粉碎机,苏州江东精密仪器有限公司;Varioskan全波长荧光/比色扫描读数仪、B4i-BR4i Jouan大容量高速冷冻离心机,美国Thermo Scientific公司;PHS-320酸度计,上海雷磁仪器厂;TA-XTPlus质构仪,英国Stable Micro system公司;V-1100可见分光光度计,上海美谱达仪器有限公司。
1.3 方法
1.3.1 鱼糜制备
采肉:将鱼去鳞、去头、内脏及黑膜后冲净血水,于孔径3 mm的滚筒挤压式采肉机一次性采肉,利用公式得出其采肉率。

其中,W为采肉率,%;M为采肉后获得碎肉重,g;M0为采肉前原料鱼重,mg。
漂洗:取鱼肉糜加入5倍体积的冷却去离子水(0℃~4 ℃),缓慢搅拌 10 min,静置 5 min,充分沉淀鱼肉糜,倾去漂洗液。进行两次漂洗后,用0.15% NaCl溶液漂洗,操作同前。离心脱水:8800g,15min。
以上操作均在4℃下进行。
1.3.2 白度的测定
基本参考陈秀华等[9]方法。用TCP2全自动测色色差机测定成型为直径10 mm,厚度2 mm的圆柱状的鱼肉糜,漂洗前后的色度指标均要测定并重复5次。白度计算公式如下[10]:
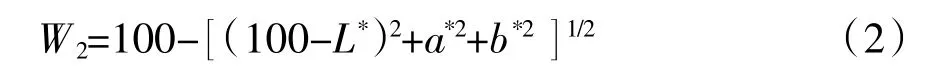
其中,W2为鱼糜白度;L*为鱼糜的亮度;a*为鱼糜的红度;b*为鱼糜的黄度。
1.3.3 鱼糜盐溶性蛋白的测定
取一定质量的鱼糜按照张静雅[22]的方法制备待测样品,之后采用考马斯亮蓝法测定盐溶性蛋白的含量。盐溶性蛋白含量的计算公式如下:

其中,W3为盐溶性蛋白含量,mg/g;C为蛋白浓度,mg/g;m1为鱼糜质量,mg。
1.3.4 鱼糜Ca2+-ATPase活性的测定
测定Ca2+-ATPase的活性基本参考S.Benjakul等[23]的方法,且略作改动,按南京建成公司的试剂盒进行测定。

其中,A 为 Ca2+-ATPase活性,U/mg;S1为样品OD值;S2为对照OD值;S3为标准OD值;S4为空白OD值;C1为待测样品蛋白浓度。
1.3.5 鱼糜总巯基(total sulfhydryl,TSH)含量的测定
测定肌动球蛋白的总巯基含量基本参考S.Benjakul等[23]的方法。

其中,T1为TSH摩尔浓度,mol/L;T2为TSH含量,μmol/L;A412为412 nm波长处的吸光值;n为稀释倍数,11;ε为摩尔吸光系数,13 600[L/(mol·cm)];ρ为蛋白浓度质量,mg/mL。
1.3.6 鱼糜凝胶的制备和凝胶强度的测定
基本参考标准SCT 3702-2014《冷冻鱼糜》制备并测定鱼糜凝胶强度,即测试各组鱼糜凝胶的破断力和凹陷深度。采用TA-XTPlus质构仪分析鱼糜凝胶结构。测试条件:P/36R探头,采用TPA模式,压缩程度50%,触发力5.0 g,停留时间间隔5 s,测试速度60 mm/min,数据采集率200 pps。每组分别取样重复测定10次。

其中,G为鱼糜凝胶强度,g·cm;N为鱼糜凝胶的破断力,g;D为凹陷深度,cm。在二段加热冷却后,置于4℃存放备用。
1.3.7 TPA模式的质构分析
采用TA-XTPlus质构仪分析鱼糜凝胶结构。取制作好的鱼糜凝胶在室温放置2 h,之后将其切成25 mm长的均一圆柱小段。测试条件:P/36R探头,采用TPA模式,压缩程度50%,停留时间间隔5 s,测试速度60 mm/min,数据采集率200 pps。
1.4 数据处理与统计分析
采用数据处理软件SPSS 22.0统计分析实验中所得数据,求得各指标的平均值和标准差,采用One-Way ANOVA法进行差异显著性分析。其中P>0.05表示差异不显著,P<0.05表示差异显著。
2 结果与讨论
2.1 体重对采肉率和鱼糜白度的影响
在对鱼类的经济性状和品质进行评价时,采肉率是重要的指标之一,它不仅一定程度决定了生产性能,也影响着鱼糜生产成本的核算[24]。鱼体质量、鱼体长度、鱼体高度及鱼体厚度都会对采肉率产生重要的影响[25]。目前市场上受到养殖成本及贮销的限制,商品规格草鱼体重通常在1 000~2 000 g之间,因此,本研究主要针对此商品规格的草鱼进行体重与采肉率关系的初步探究,结果如表1所示,B组和C组草鱼的采肉率显著(P<0.05)高于A组,且该两组间采肉率差异不显著(P>0.05)。因此看出高体重组更适合用于鱼糜的制备。该结果可能也与鱼体重大、鱼肉肥满,因而采肉率高有关。
鱼肉有红肉白肉之分,白肉尤其以盐溶性的肌原纤维蛋白为主,即构成鱼糜的主要成分,因此白度是衡量鱼糜及鱼糜制品的一项重要指标[26]。本研究中,漂洗前,A组和C组体重草鱼鱼肉糜的白度如表1所示均显著高于B组(P<0.05),而漂洗后,仅C组白度显著高于B组(P<0.05)。高档鱼糜制品,要求肉色洁白,凝胶强度和弹性高,因此通常采用白肉加工鱼糜。试验中体重最高组C组加工的鱼糜,漂洗后的色泽更洁白,由此可以推测高体重的草鱼其白肉含量高,漂洗除去水溶性色素成分后,该特点更加突出,因此更利于生产品质优良的鱼糜制品。
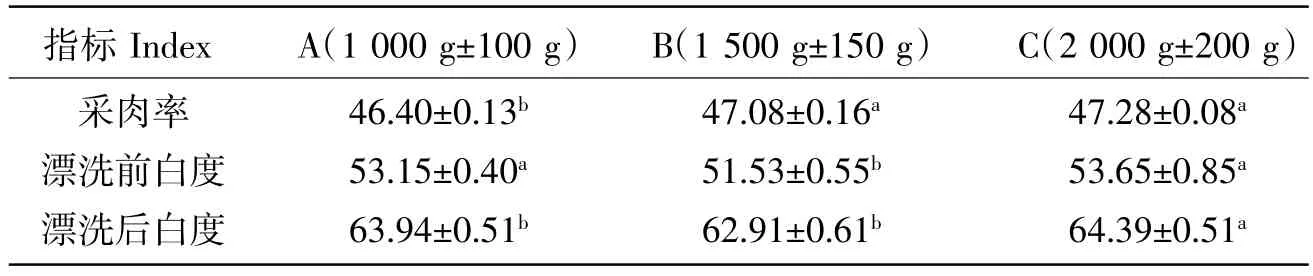
表1 体重对草鱼肌肉采肉率、鱼肉糜白度的影响(n=10)Table 1 Effects of body weight on muscle intake rate,surmis whiteness %
2.2 体重对草鱼鱼糜肌动球蛋白稳定性和凝胶强度的影响
在鱼糜凝胶形成过程中,盐溶性肌原纤维蛋白中含有的肌球蛋白起着关键性作用[27]。肌球蛋白是形成三维网状结构的主要成分[28-29],E.Foegeding等[30]的研究也证明了这一结论。因此,鱼糜中盐溶性的肌原纤维蛋白含量越高越有利于形成凝胶网状结构,使得最终的鱼糜制品获得更优良的质构品质。另一方面,在鱼糜凝胶制品生产的加热过程中,蛋白中巯基会氧化交联成二硫键,使活性区域构象改变,从而导致Ca2+-ATPase活性降低[31-32],Ca2+-ATPase内部的巯基暴露后也会氧化交联形成二硫键,促进网络结构的形成。因此Ca2+-ATPase活性、总巯基是评价鱼糜及其凝结结构稳定性的典型指标。本研究中,3个体重组的盐溶性蛋白含量、Ca2+-ATPase活性、总巯基含量及鱼糜凝胶强度如表2所示。其中,尽管3组间盐溶性蛋白含量的差异并不显著(P>0.05),但趋势上,C组最高且,B组与之接近,A组最低,这种差异不显著现象也可能与试验过程中许多代谢性蛋白质和内、外源蛋白酶对其存在不同程度降解有关[33]。C组与B组的总巯基含量接近且均显著高于A组(P<0.05),C组的Ca2+-ATPase活性和凝胶强度则显著优于B组和A组。因此推测,体重大的鱼其自身Ca2+-ATPase活性和总巯基含量比较高或者是其肌动球蛋白的稳定性更高。
鱼糜凝胶的强度和弹性质构品质是鱼糜制品的生命所在,直接影响到鱼糜的商品价值,所以凝胶强度通常作为评定鱼糜等级的决定性指标[34]。尽管表2中B组和C组的总巯基含量差异不显著(P>0.05),但从Ca2+-ATPase活性结果分析,B组Ca2+-ATPase活性显著低于C组,即形成鱼糜凝胶的关键蛋白——肌原纤维蛋白稳定性逊色于C组。这也是导致B组凝胶强度显著低于C组的可能原因之一。综上,可见C组规格的草鱼鱼糜其凝胶强度更高,C组体重草鱼更适合作为生产鱼糜或鱼糜制品的原料。
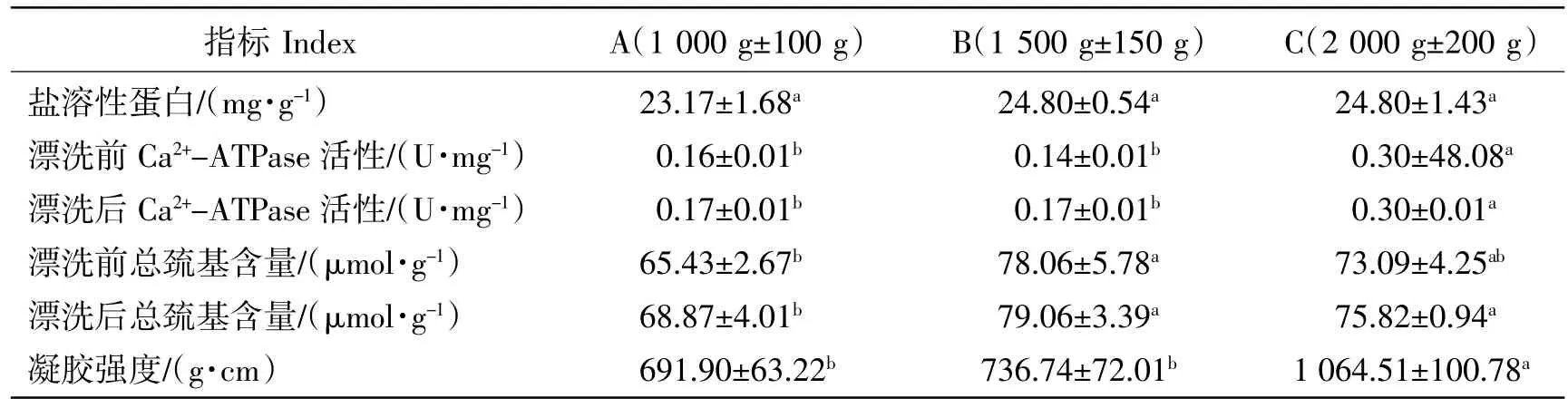
表2 体重对草鱼鱼糜肌动球蛋白稳定性和凝胶强度的影响(n=10)Table 2 The effect of body weight on the stability and gel strength of actomyosin in grass carp surimi
2.3 体重对鱼糜制品质构特性的影响
TPA模式的质构分析中包含的要素——胶黏性、硬度、弹性、内聚性、咀嚼性及回复性等,是对鱼糜凝胶质量进行评价时主要的参考依据[35-37]。硬度是食品达到一定形变所需要的力,弹性反映的是外力作用时变形及去力后的恢复程度,回复性可以反映鱼肉在受压状态下快速恢复变形的能力,内聚性体现了组成产品结构的内部键力的大小[38],胶黏性和咀嚼性是硬度、弹性、内聚性等的综合结果。本研究对A组、B组、C组草鱼鱼糜凝胶进行TPA质构特性测试,结果如表3所示,3个体重的硬度、内聚性和回复性基本上都随体重的增大而增大,但三者差异均不显著(P>0.05),B组和C组的弹性显著高于A组(P<0.05),C组的胶黏性和咀嚼性显著高于A组和B组(P<0.05)。本研究中C组的TPA质构特性表现出突出的优势,这与前述的C组鱼糜其他品质指标结果表现的特性相吻合。
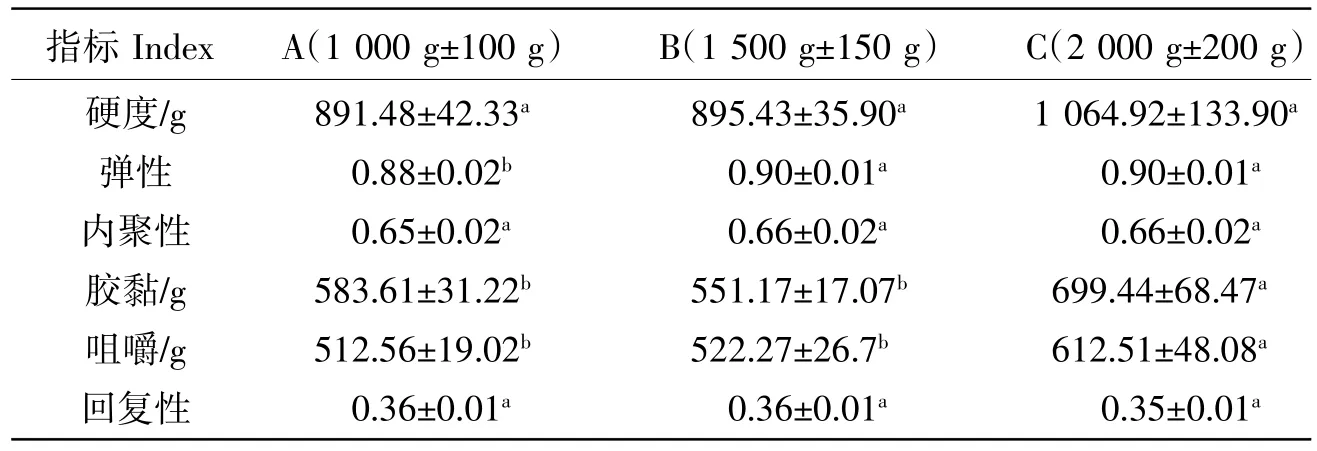
表3 体重对鱼糜制品质构特性的影响(n=10)Table 3 Effect of body weight on surimi products texture property
综合本文各鱼糜品质指标的分析,发现体重越大的草鱼加工的鱼糜品质会更好。这种特性应该与不同体重草鱼其本身的组织学特性、化学成分组成及物理特性有关。有文献表明,体重大的草鱼其肌纤维直径大,肌肉更紧实[39],本实验团队前期研究也发现C组体重的草鱼的粗蛋白含量明显高于B组和C组,而水分含量则正相反;而且肌肉本身pH值,C 组(2 000 g±200 g)也是明显高于 B 组(1 500 g±150 g)和 A 组(1 000 g±100 g)[40],肌肉 pH,越高越接近中性,则越有利于鱼糜凝胶的形成。这也与本文中C组鱼糜凝胶强度最高的结果相对应。
3 结论
为初步探究同一营养水平下,达到不同商品规格的草鱼体重(1 000 g±100 g、1 500 g±150 g、2 000 g±200 g)与采肉率、鱼糜及鱼糜凝胶特性之间的关系,本文对影响鱼糜及鱼糜凝胶品质的典型指标进行了分析,发现体重越大的草鱼,其采肉率越高,鱼糜及其凝胶品质会更好这一特性,并结合经济性状确定C组(2 000 g±200 g)草鱼最适合作为鱼糜及其制品的生产原料。试验结果对于草鱼鱼糜制品的生产实践具有一定的现实指导意义。

