miR-214-3P在卵巢癌中的表达及临床意义
范文秀 马思晨 张亚洁 朱绣玉 闫洪超
卵巢上皮性癌(卵巢癌),是最常见的妇科恶性肿瘤之一,尽管目前的外科手术和联合化疗治疗手段趋向于成熟,但由于卵巢癌临床表现隐匿,前哨症状少,疼痛轻微,约25%的卵巢癌病例早期以占优势的肿块出现,大多情况下患者触及包块伴明显的腹胀就诊时多已晚期[1]。加之其容易发生化疗耐药和复发转移,晚期患者的5年生存率仅为30%,相比之下,早发现、早治疗的患者,其5年生存率则提高到92%[2,3]。因此,早期干预是改善卵巢癌患者不良预后的重要策略,故亟需更多的研究来确定新的生物学标志物和治疗靶点,使得卵巢癌患者拥有良好结局。
近年来,有研究显示各种类型的恶性肿瘤发生均与miRNA的失调有关,miR-214-3P也是研究热点,作为重要分子枢纽参与肿瘤网络调控[4]。大多数情况下miR-214-3P下调,在宫颈癌、结直肠癌子宫内膜癌等肿瘤中表达降低,发挥抑癌基因作用,相反,在恶性黑色素瘤、胰腺癌、膀胱癌高表达,发挥癌基因作用[5~10]。因此miR-214-3P极有可能成为潜在的诊断及预后生物学标志物和治疗干预的靶点。本研究拟观察卵巢组织中miR-214-3P的表达水平,通过转染miR-214-3P-inhibitor质粒至卵巢癌A2780细胞中,探究其对卵巢癌细胞的生物学行为的影响,寻找其对卵巢癌的临床诊治是否具有指导意义,现报告如下。
资料与方法
1.实验样本:组织样本取自徐州医科大学附属医院2018年10月~2020年6月行手术切除,术前均未进行放疗和化疗,术后病理确诊为卵巢上皮性癌组织40例,同期取得良性卵巢肿瘤组织、正常卵巢组织各30例,经笔者医院医学伦理学委员会同意,患者均签署知情同意书。各样本提取后立即放入液氮罐,送入实验室,进行相应处理。
2.实验材料:人卵巢癌细胞株A2780复苏于徐州医科大学细胞与分子公共实验室,DMEM不完全培养基购自南京凯基生物有限公司,四季青胎牛血清购自浙江天杭生物科技股份有限公司,LiPo2000、Trizol试剂购自上海拜力生物有限公司。miR-214-3P-down质粒购自上海吉凯基因化学技术有限公司。miR-214-3P引物购自上海生工生物工程有限公司。反转录试剂盒和实时荧光定量PCR试剂盒购自美国诺唯赞生物科技有限公司。细胞增殖及毒性检测试剂盒(CCK-8)购自大连美仑生物技术有限公司。引物序列:反转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACA-CTGCC-3′;miRNA-214-3P正向引物:GCGACAGCAGGCACAGACA,miRNA-214-3P反向引物:AGTGCAGGGTCCGAGGTATT;U6 snRNA正向引物:CGCTTCGGCAGCACATATAC,U6 snRNA反向引物:TTCACGAATTTGCGTGTCATC。
3.实验方法:(1)实时荧光定量PCR(qPCR)检测卵巢癌组织中miR-214-3P的表达:按照Trizol试剂说明书,提取各卵巢组织中的总RNA,利用反转录试剂盒进行反转录,合成cDNA后进行实时定量PCR扩增,获得各组织的Ct值,以U6作为内参校正误差。反应条件:95℃预变性5min,然后95℃变性10s,60℃退火30s,共循环40次。运用2-△△Ct相对定量法来计算目的基因miR-214-3P的相对表达量。(2)细胞培养:复苏冻存于徐州医科大学细胞与分子公共实验室的人卵巢癌上皮细胞A2780,使用含10%胎牛血清和1%双抗的DMEM培养基进行培养,置于37℃、5%的CO2的恒温培养箱中孵育细胞至细胞融合90%左右进行传代,传代至2~5代进行实验。(3)细胞转染:将处于对数生长期的A2780细胞消化,以5×105个/孔密度的细胞悬液均匀接种于6孔板,置于37℃、5%的CO2的恒温培养箱中培养,将细胞分为miR-214-3P抑制组、阴性对照组、正常组,各组设两个复孔,培养24h后,按照LIPO2000转染试剂进行转染,转染后5h换液,转染24~48h内同实验方法中实时荧光定量PCR检测卵巢癌组织中miR-214-3P的表达法提取各细胞组的总RNA进行实时荧光定量PCR,验证转染效果。(4)CCK-8法检测细胞的增殖情况:收集各组已转染处于对数生长期细胞,以104个/孔密度的细胞悬液均匀接种于96孔板,每组细胞设4个副孔,置于37℃、5%的CO2的恒温培养箱培养,0、12、24、36、48h后,分别取各阶段的细胞,每孔加入10μl的CCK-8,放恒温培养箱孵育2h,利用酶标仪测定各孔在450nm波长处的吸光度(A)。(5)Transwell小室检测细胞的迁移和侵袭情况:收集各组已转染处于对数生长期细胞,以2×105个/孔密度的细胞悬液接种于上室,下室中加入600μl含20%胎牛血清的培养基,每组设2个副孔,置于细胞培养箱中继续培养24h,取出小室,4%多聚甲醛固定,结晶紫染色,高倍显微镜下随机计数5个单独视野的细胞数量,取平均值进行统计分析。检测细胞侵袭能力实验与上述过程相同,除了Transwell上室预先使用Matrige基质胶(1∶8稀释)包被。

结 果
1.miR-214-3P在卵巢癌中的表达及相关性分析:卵巢癌组织、良性卵巢肿瘤组织和正常卵巢组织的miR-214-3P表达水平分别是5.18±1.91、2.03±0.48和1.41±0.24,卵巢癌组织miR-214-3P表达水平较良性卵巢肿瘤和正常卵巢组织明显升高(P<0.05),良性卵巢肿瘤组织与正常的卵巢组织比较,差异无统计学意义(P>0.05,图1);其中40例卵巢上皮性癌中,miR-214-3P的表达水平与FIGO分期、分化程度以及有无淋巴转移相关(P<0.05),而与年龄、病理类型无显著的相关性(P>0.05,表1)。
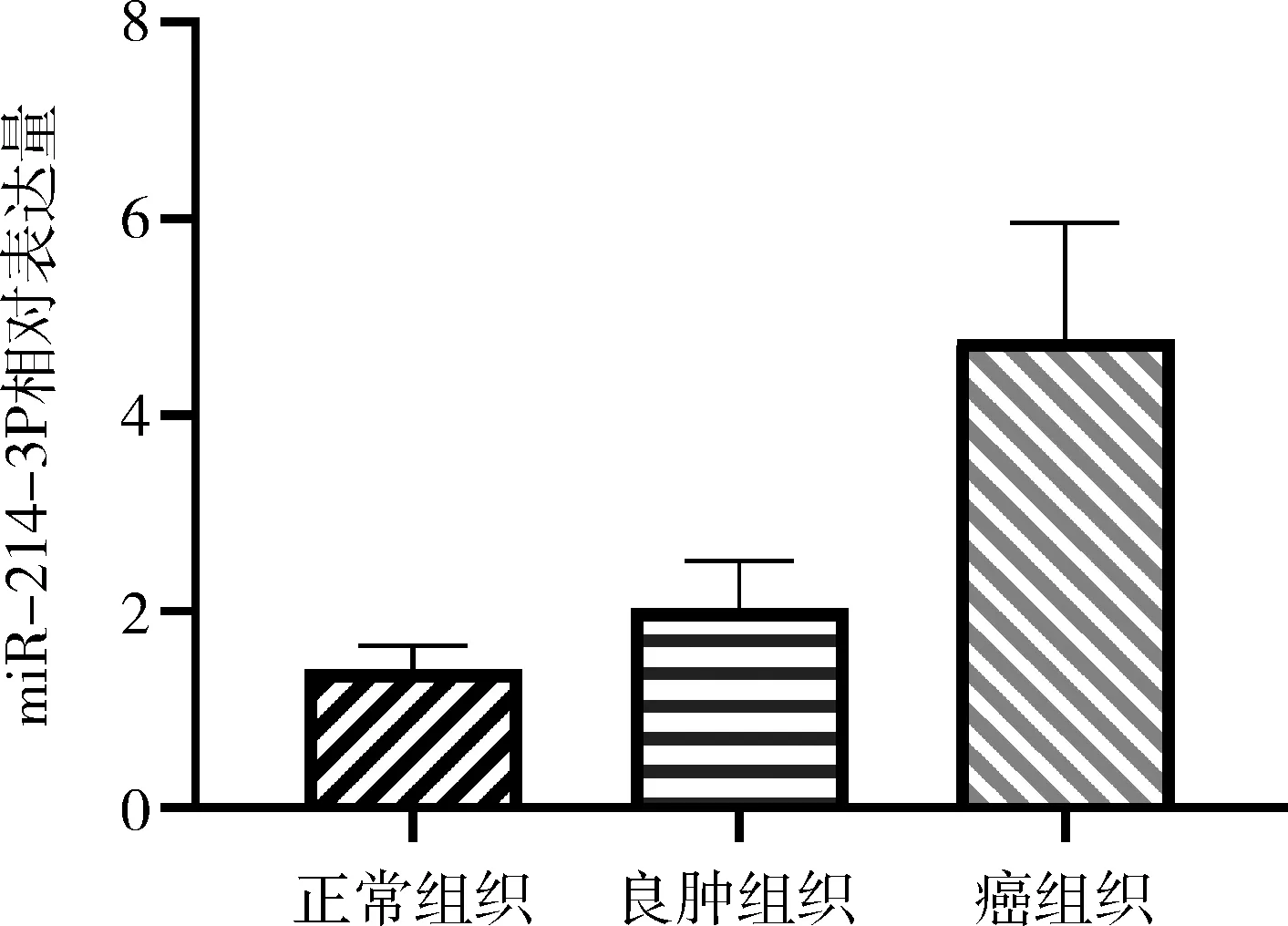
图1 miR-214-3P在各卵巢组织中表达水平

表1 miR-214-3P表达水平与卵巢上皮性癌临床病理关系的分析
2.实时荧光定量PCR检测卵巢癌细胞中miR-214-3P的表达水平:正常组、阴性对照组和抑制组的miR-214-3P表达水平分别是1、0.875±0.630和0.396±0.931,抑制组miR-214-3P表达水平较正常组和阴性对照组降低(P<0.05),正常组和阴性对照组比较差异无统计学意义(P>0.05,图2)。

图2 miR-214-3P在各卵巢细胞中表达水平
3.CCK-8法检测细胞增殖情况:与正常组和阴性对照组比较,抑制组细胞在0h时,A值比较差异无统计学意义(F=1.528,P=0.256),在培养12、24、36、48h的A值降低,差异有统计学意义(F=7.507、10.279、23.323、29.464,P均<0.05);正常组和阴性对照组在培养0、12、24、36、48h的A值,差异无统计学意义(P>0.05,图3)。

图3 CCK-8法检测各组细胞的增殖情况与抑制组比较,*P<0.05
4.Transwell小室检测细胞迁移和侵袭能力:与正常组和阴性对照组比较,抑制组细胞发生迁移和侵袭的细胞数下降,差异有统计学意义(F=22.606、40.382,P均<0.05),正常组和阴性对照组比较,差异无统计学意义(P>0.05,图4、图5)。
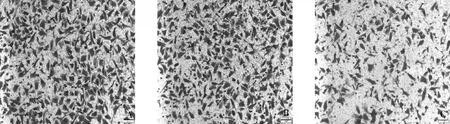
图4 转染miR-214-3P-抑制质粒后各组A2780细胞迁移数目变化(结晶紫染色,×200)A.正常组;B.阴性对照组;C.抑制组

图5 转染miR-214-3P-抑制质粒后各组A2780细胞侵袭数目变化(结晶紫染色,×200)A.正常组;B.阴性对照组;C.抑制组
讨 论
MicroRNA是一组短链、非编码单链RNA,调节多种细胞的分化、增殖和凋亡,直接靶向mRNA的非翻译区(UTR),并成为新的转录后调节因子,起着抑癌基因或启动子作用[11]。而其中miR-214-3P通过协调基本信号网络如PTEN/AKT、β-catrnin和酪氨酸激酶受体途径,起到关键枢纽的作用。同时,miR-214-3P还调节了关键基因表达调控因子的水平,如表观抑制因子Ezh2、“基因组管家”p53、转录因子TFAP2等[12]。因此,miR-214-3P在肿瘤发生、发展过程中发挥重要作用。
目前,临床常用检测血CA125联合经阴道彩超作为早期卵巢癌筛查手段,敏感度低,只有血CA125等肿瘤指标大幅度升高,并在放射磁共振成像显示腹内肿块、腹腔积液、胸腔积液后,才能怀疑诊断[13,14]。通过彩超定位下肿块穿刺活检或腹腔镜探查取样活检才得以确诊。因此,卵巢癌早期筛查手段和诊断方法还具有一定的局限性。miR-214-3P是近年来研究的一个热点,在众多肿瘤中都处于失调状态,在乳腺癌中表达降低起到抑癌基因的作用,而在胰腺癌等中高表达发挥促癌作用[9,15]。本研究中miR-214-3P在卵巢癌组织中表达水平高于正常卵巢组织和良性卵巢肿瘤组织,而正常组织与良性肿瘤组织间比较差异无统计学意义。
既往有研究表明,miRNAs不仅在组织中表达,在血液中也是稳定和可复制的,它们被结合在脂质或脂蛋白复合体中,如外泌体,保护它们不被内源性RNase降解。癌症患者血液中miRNAs的存在增加了miRNAs作为一种新的诊断标志物的可能性。有研究报道,血清miR-21水平与弥漫性大B细胞淋巴瘤患者的无进展生存期相关[16]。有研究发现血清miR21在乳腺癌诊断中比其他传统癌症标志物显示出更高的敏感度[17]。由于检测血液中miRNAs是非侵入性的检查,不需要对肿块进行活检,而miR-214-3P又在卵巢癌中高表达,因此,对卵巢癌患者循环中外泌体miR-214-3P的检测,联合检测CA125及HE4,具有成为卵巢癌早期筛选工具的潜力。不过在绕过活检之前需要进行验证研究,运用至临床尚需要一段时间。另外,本研究还分析了miR-214-3P表达与临床病理特征的关系,临床期别越高,病理分化越差和已发生淋巴结转移的患者,miR-214-3P表达水平越高,而与年龄和病理类型无关,说明其与肿瘤的恶性程度密切相关,可以作为初步评价卵巢癌患者预后的一个指标。
为了更进一步验证miR-214-3P对卵巢癌细胞的生物学行为的影响,本研究通过体外细胞实验,采用脂质体转染的方法,以卵巢癌A2780细胞为研究对象,转染miR-214-3P抑制表达质粒。研究结果显示,转染抑制质粒后抑制A2780增殖,迁移和侵袭能力减弱,这与Yang等[18]研究结论相一致,表明miR-214-3P对卵巢癌细胞系的生物学行为起一定的促进作用。同时Wang等[19]通过慢病毒转染方法,上调miR-214-3P的表达,再次验证mir-214-3P在卵巢癌发生、发展过程中发挥癌基因作用。另一方面,肿瘤的生长和肿瘤转移的进展在很大程度上取决于血管生成。
目前大量研究表明,在肿瘤血管生成过程中,miRNAs可以通过非细胞自主和细胞自主的方式调节内皮细胞的功能,巧妙地控制着“血管生成开关”。有研究显示,miR-214-3P通过抑制编码内源性血管生成抑制因子的基因来积极调节肿瘤血管生成,促进肿瘤血管内皮细胞的增殖和迁移。鉴于miRNAs在肿瘤血管生成中的重要调节作用,靶向或向肿瘤递送miRNAs作为一种新的治疗方法具有很大的前景。另外,癌症在一定程度上是一种表观遗传疾病,肿瘤的发生、发展与表观遗传修饰紊乱密切相关,且具有癌基因作用或抑癌基因作用的miRNAs主要受DNA甲基化调控[20]。因此,虽然靶向miR-214-3P治疗不会增加以其为抑癌基因的一类肿瘤的发生可能,但是对于已经罹患恶性肿瘤患者,miR-214-3P的表达水平的改变极有可能促进其发生、发展。故靶向mir-214-3P治疗卵巢癌的同时,必须先行评估患者有无罹患其他恶性肿瘤,或者是否暴露于罹患其他恶性肿瘤的高危环境中,做到权衡利弊,开展个体化治疗。
综上所述,miR-214-3P在卵巢癌中发挥一定的促进作用,抑制其表达可减缓肿瘤的进展。尽管现有的检测技术尚未成熟,但在不远的将来,miR-214-3P有望成为卵巢癌早期诊断、治疗和判断预后的新靶点。

