lncRNA SBF2-AS1低表达提高食管鳞癌的放射敏感度
查文娟 李晓敏 铁小伟 陈 瑞 李 皓 刘阳晨
食管癌是一种恶性程度很高的肿瘤,在东亚地区高发[1]。而中国的食管癌发生率居高不下,约占所有食管癌病例的一半[2]。鳞癌和腺癌是食管癌的两种主要组织学类型,且全球一半以上的食管鳞癌发生在中国[3,4]。而在中国食管癌的发生率位居第6位,病死率位居第5位[5]。中国的食管癌患者主要以食管鳞癌为主,食管腺癌较少。虽然食管癌的治疗方法多种,但由于早期诊断困难,被发现时已到中晚期导致患者预后很差,5年总体生存率不足20%[6]。放射治疗是食管鳞癌主要的治疗方法之一,但是由于存在放疗抵抗,影响了放射治疗的疗效,导致许多食管癌患者放疗失败。但越来越多的研究证实了一种长链非编码RNA(lncRNA)可能是导致恶性肿瘤产生放疗抵抗的原因。lncRNA MALAT1在放疗耐受的结直肠癌细胞中高表达,并且可以增加细胞活力,MALAT1主要作为ceRNA吸附miR-101-3P来增强结直肠癌细胞的放疗抵抗,导致结直肠癌细胞对放射治疗不敏感,或许这是许多结直肠癌患者放疗失败的一个可能原因[7]。
lncRNA HOTAIR与乳腺癌细胞的放疗敏感度呈负相关,且进一步的研究发现HOTAIR通过与miR-449b-5p结合使得HSPA1A的表达上调,导致乳腺癌细胞放疗耐受性的产生[8]。lncRNA MINCR也被发现为是导致鼻咽癌放疗抵抗的一个潜在基因,MINCR通过海绵化miR-223,增加ZEB1和激活AKT/PI3K轴来降低鼻咽癌细胞的放射敏感度[9]。同样地也有许多调控食管鳞癌放疗敏感度的lncRNA被发现。LINC00473可以调节microRNA-497-5p 和细胞分裂周期 25A降低食管鳞癌的放疗敏感度[10]。lncTUG 1通过降低miR-144-3p水平和调节MET/EGFR/AKT轴来增强ESCC的放射抵抗[11]。SBF2-AS1已被报道可以作为促癌因子在多种肿瘤中发挥作用,但是SBF2-AS1是否是食管鳞癌放疗抵抗的潜在的分子尚未被报道。
材料与方法
1.材料:人食管鳞癌细胞TE-13购自中国科学院上海生命科学研究院细胞资源中心;RPMI1640培养基和胎牛血清购自美国Gibco公司;无血清冻存液和10%聚丙烯酰胺凝胶预混液(10%SDS PAGE)购自苏州新赛美科技公司;TRIzol试剂和lipofectamineRNAiMAX购自美国赛默飞公司,E2F1抗体和actin抗体购自美国CST公司,q-PCR试剂盒和反转录试剂盒购自南京诺唯赞生物科技有限公司,胸腺嘧啶核苷酸类似物(thymine nucleotide analogue,EDU)试剂盒购自广州锐博公司,四甲基偶氮唑蓝(methyl thiazol tetrazolium, MTT)试剂盒和蛋白marker购自碧云天生物技术公司。
2.细胞培养与转染:复苏食管鳞癌细胞系TE-13和正常细胞HET-1A,用含10%胎牛血清的RPMI1640培养基培养并放在37℃、5%CO2的培养箱中孵育。待细胞长至80%~90%用预冷PBS洗2遍,用胰酶进行消化,待细胞变圆将细胞吹打下来离心,将其分装在2个培养瓶中。取对数生长期的细胞铺板于6孔板中,24h后按照LipofectamineRNAiMAX说明将si-SBF2-AS1和si-NC 转染进TE-13细胞中分为si-SBF2-AS1组和si-NC组,转染48h后进行后续实验。
3.RT-PCR检测:RT-PCR检测SBF2-AS1的表达水平:用TRIzol试剂按照说明书提取细胞中的总RNA,并检测浓度和纯度;用反转录试剂盒将RNA反转录成cDNA,荧光定量PCR进行RT-PCR。以GAPDH为SBF2-AS1的内参基因,SBF2-AS1的相对表达量用2-ΔΔCt计算。反应条件:95℃,预变性5min(1个循坏),95℃ 10s,60℃ 30s(40个循坏);相应的引物序列:SBF2-AS1 上游引物:5′-CACGACCCAGAAGGAGTCTAC-3′,下游引物:5′-CCCGGTACCTTCCTGTCATA-3′;GAPDH上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′。
4.MTT法检测:si-SBF2-AS1和si-NC 转染进TE-13细胞然后分别用0Gy和4Gy的X线照射后将细胞分为si-NC组、si-SBF2-AS1组、IR+si-NC组和IR+si-SBF2-AS1组,收集细胞以每孔5000个铺到96孔板中,每组设置5个复孔,培养24、48、72和96h后分别在每个孔中加入100μl MTT溶液适当混匀,在37℃培养箱中孵育4h;每孔加入100μl Formazan溶液适当混匀,在培养箱中孵育3h,最后在570nm波长处测吸光度。
5.EDU实验:si-SBF2-AS1和si-NC 转染进TE-13细胞然后分别用0Gy和4Gy的X线照射后将细胞分为si-NC组、si-SBF2-AS1组、IR+si-NC组和IR+si-SBF2-AS1组,以每孔1×105个细胞铺进免疫荧光薄底96孔板中,每组设置3个复孔。每个孔中加入100μl 50nmol/L Edu培养基孵育2h,弃培养基,PBS清洗细胞2次,每次5min。然后加入50μl的细胞固定液室温孵育30min,弃固定液,接着加入50μl 2mg/ml甘氨酸,脱色摇床孵育5min,弃甘氨酸。再加入100μlPBS脱色摇床清洗5min,使用100μl渗透剂脱色摇床孵育10min,然后加入100μl的1×Apoll®染色反应液进行染色,避光室温脱色摇床孵育30min,弃反应液。接着加入100μl渗透剂清洗2遍,最后每孔加入100μl 1×Hoechst33342反应液进行DNA染色,避光室温孵育30min,加PBS清洗2次;最后用荧光显微镜放大100倍进行图像获取。
6.流式细胞术:取对数生长期的TE-13细胞消化下来铺进6孔板,将si-SBF2-AS1和si-NC 转染进TE-13细胞然后分别用0Gy和4Gy的X线照射后将细胞分为si-NC组、si-SBF2-AS1组、IR+si-NC组和IR+si-SBF2-AS1组,每组设置3个复孔。收集细胞(约1×106个),用预冷PBS清洗2次之后弃去PBS,在每管中加入100μl的binding buffer,轻轻吹打混匀;1000r/min离心5min,避光条件下每管加入0.5ml PI染色,重悬细胞,室温避光孵育15min后进行流式检测。
7.Western blot法:取对数生长期的TE-13细胞消化下来铺进6孔板,将si-SBF2-AS1和si-NC 转染进TE-13细胞然后4Gy的X线照射后将细胞分IR+si-NC组和IR+si-SBF2-AS1组。待细胞长至70%~80%时用预冷PBS清洗2次,在每个孔中加入含有1μl cocktail的RIPA裂解液,并放在冰上裂解20min,之后将细胞刮下来,12000×g4℃离心15min。取上清,按上清液的量加入5×SDS使其稀释成1×SDS,95℃煮5min,用BCA蛋白测浓度。取40μg的蛋白用配好10%聚丙烯酰胺凝胶预混液电泳,转膜后用2%脱脂奶粉室温孵育2h,一抗4℃摇床孵育过夜。TBST摇床清洗3次,每次5min,二抗室温孵育1h,TBST清洗3次,每次5min,采用ECL化学发光试剂盒显影。

结 果
1.SBF2-AS1在食管鳞癌细胞和食管正常上皮细胞中的表达水平:用RT-PCR检测人食管鳞癌细胞TE-13和人正常食管上皮细胞HET-1A中SBF2-AS1的表达。TE-13细胞中SBF2-AS1的表达(5.508±0.283)明显高于HET-1A组(1.000±0.344),差异有统计学意义(t=4.710,P=0.009),详见图1。

图1 qRT-PCR检测SBF2-AS1在TE-13和HET-1A中的表达
2.TE-13细胞存活:用si-SBF2-AS1和si-NC转染TE-13细胞,并用0Gy、2Gy、4Gy、6Gy和8Gy照射,结果显示,与si-NC组(100%±0.00%、83.00%±4.00%、69.00%±7.00%、58.00%±3.00%、36.00%±6.00%)比较,si-SBF2-AS1组(100.00%±0.00%、55.00%±1.00%、26.00%±5.00%、10.00%±3.00%、4.00%±4.00%)的细胞存活分数显著降低,差异有统计学意义(t=2.497,P=0.047),详见图2。

图2 不同放射剂量下TE-13细胞的存活曲线
3.TE-13的A值:与si-NC组比较,IR+si-NC组、si-SBF2-AS1组和IR+si-SBF2-AS1组在48h和72h的A值显著降低。与IR+si-NC组比较,IR+si-SBF2-AS1组48h和72h的A值显著降低。与si-SBF2-AS1组比较,IR+si-SBF2-AS1组48h和72h的A值显著降低,差异有统计学意义,详见表1。

表1 MTT检测各组细胞的活力
4.TE-13细胞的增殖能力:与si-NC组比较,IR+si-NC组、si-SBF2-AS1组和IR+si-SBF2-AS1组增殖率显著降低。与IR+si-NC组比较,IR+si-SBF2-AS1组增殖率显著降低。与si-SBF2-AS1组比较,IR+si-SBF2-AS1组增殖率显著降低,差异有统计学意义,详见图3和表2。
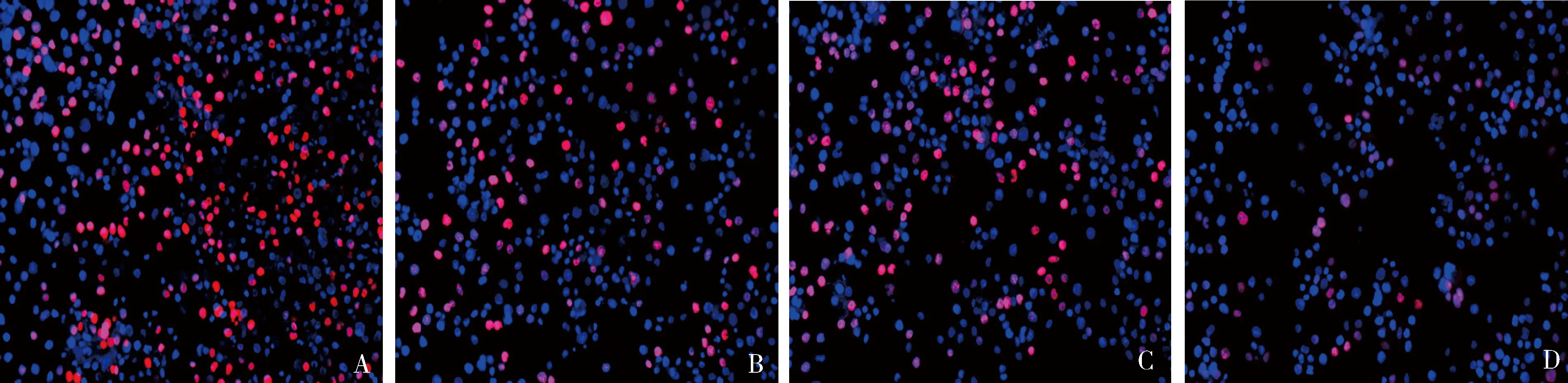
图3 EDU检测各组细胞增殖水平A.si-NC组;B.IR+si-NC组;C.si-SBF2-AS1组;D.IR+si-SBF2-AS1组

表2 干扰SBF2-AS1的表达联合放疗对TE-13细胞增殖率的影响
5.TE-13细胞凋亡:与si-NC组比较,IR+si-NC组、si-SBF2-AS1组和IR+si-SBF2-AS1组的细胞凋亡率显著升高。与IR+si-NC组比较,IR+si-SBF2-AS1组的细胞凋亡率显著升高。与si-SBF2-AS1组比较,IR+si-SBF2-AS1组的细胞凋亡率显著升高,差异有统计学意义,详见图4和表3。
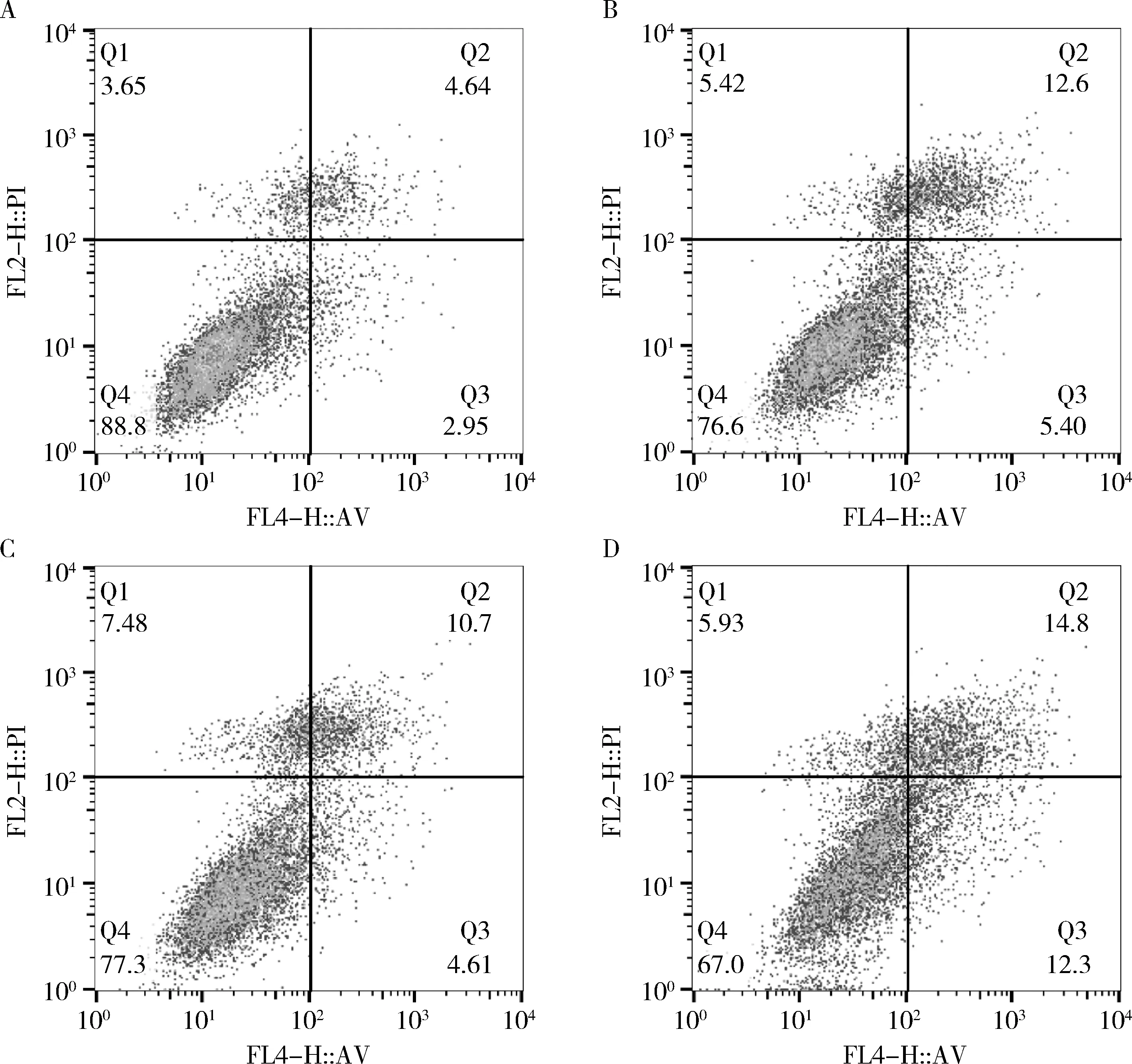
图4 流式细胞术检测各组细胞凋亡水平A.si-NC组;B.IR+si-NC组;C.si-SBF2-AS1组;D.IR+si-SBF2-AS1组

表3 干扰SBF2-AS1的表达联合放疗对TE-13细胞凋亡的影响
6.干扰SBF2-AS1的表达联合放疗抑制E2F1蛋白的表达:与IR+si-NC组(80.000±3.215)比较,IR+si-SBF2-AS1组(45.000±3.215)E2F1蛋白的表达量显著下降,差异有统计学意义(t=7.699,P=0.002),详见图5。

图5 干扰SBF2-AS1的表达联合放疗对E2F1蛋白的影响
讨 论
虽然现在食管鳞癌的治疗方法有很多种,放疗也是食管鳞癌治疗的主要手段之一,特别是对于胸中上段的食管鳞癌来说。新辅助放疗和术后辅助放疗都是食管鳞癌治疗的标准方法, 尽管放射疗法及各种新型化疗药物的临床应用提高了治疗效果,但患者的生存率仍然较低,其中放疗抵抗被认为是导致食管鳞癌治疗失败的原因之一。因此寻找影响食管鳞癌放疗疗效的基因可能为以后提高放疗疗效奠定基础。lncRNA是一种具有200多个核苷酸的非编码RNA,lncRNA可以从表观遗传学、转录和转录后的角度调节生物体的生理功能。它们参与细胞增殖、分化、染色体重塑、表观遗传调控、转录和转录后调控等多种生物学过程[12,13]。根据其特征和功能,它们可以在多种肿瘤中起着促癌或抑癌因子的作用。随着lncRNA研究的深入,它们也被发现可以调控化疗或者放疗的敏感度,这一发现为食管鳞癌的临床诊断和治疗提供了新的思路。lncRNA SBF2-AS1已被发现不仅在多种肿瘤中上调,而且对放疗也有影响。Yu等[14]研究发现SBF2-AS1可以通过micoRNA-302a/MBNL3来增强非小细胞肺癌的辐射抗性。
本研究结果显示,SBF2-AS1在食管鳞癌放疗抵抗细胞株中高表达。E2F1是一种转录因子,一般参与调节了细胞周期的进程。且有许多研究发现E2F1可以促进多种肿瘤生长如膀胱癌、垂体瘤和喉癌[15~17]。也有研究发现E2F1会影响恶性肿瘤放射治疗。研究发现TFAM下调使E2F1下降导致G1期阻滞进而抑制肿瘤细胞的增殖最后导致肿瘤细胞的放射敏感度提高[18]。microRNA-16-5p通过调节细胞周期蛋白D1/E1-pRB-E2F1通路增强前列腺癌细胞的放射敏感度[19]。本研究发现E2F1在食管鳞癌放疗抵抗细胞株中高表达。本研究结果显示SBF2-AS1可以使E2F1表达升高,SBF2-AS1可以促进食管鳞癌放疗抵抗细胞增殖,并且促进食管鳞癌放疗抵抗细胞中E2F1蛋白和mRNA的表达,由此可推断SBF2-AS1是通过促进E2F1表达来提高食管鳞癌细胞的放疗抵抗的,但关于SBF2-AS1调控E2F1的机制还应进行深入研究。

