不同比例低碳高脂饮食对糖代谢的影响
夏心怡 胡丽丽 殷 峻
低碳饮食是近年来兴起的新饮食方式,提倡减少碳水化合物的净摄入,每日碳水化合物摄入大都低于总热量的20%,所需热量转而由脂肪提供。机体从基于葡萄糖的能量代谢转变为基于脂肪的能量代谢。临床研究发现,低碳饮食减少葡萄糖诱导的胰岛素级联反应,从而改善肥胖[1~6]。对于糖尿病患者,低碳饮食显著降低体重,改善空腹血糖及糖化血红蛋白,减少胰岛素的注射剂量,甚至停药[7~9]。然而,在动物实验中,60%脂肪的低碳高脂饮食常用于肥胖小鼠的造模,小鼠出现明显的血糖增高及胰岛素抵抗。本实验旨在探讨不同碳水化合物比例的饮食对小鼠体质量及代谢的影响,并与低碳饮食的2型糖尿病患者进行初步比较,探究低碳饮食对小鼠及人产生不同效果的原因。
材料与方法
1.实验材料:3周龄健康SPF级C57BL/6J野生型雄鼠48只,购自上海西普尔-必凯实验动物有限公司,饲养于上海交通大学附属第六人民医院动物中心。短效人胰岛素购自丹麦诺和诺德制药有限公司,葡萄糖购自上海生工生物工程公司,丙酮酸购自美国Sigma公司,血糖仪及血糖试纸购自瑞士Roche公司,血清胰岛素检测试剂盒购自美国Crystal Chem公司。普食、60%高脂饮食(可可脂)和75%高脂饮食定制于江苏省协同医药生物工程有限责任公司。60%高脂饮食(猪油)购自美国Research Diets公司。
2.动物饲养:动物饲养在12h光照/12h黑暗、恒温、恒湿环境下。每组10只,随机分为4组,共40只。4组小鼠适应性喂养3周后,根据组别分别喂养普食饲料及3种高脂饲料,4种饲料蛋白质的热量占比均为20%。小鼠分组如下:A组:碳水化合物占70%,脂肪占10%;B组:碳水化合物占20%,脂肪占60%,脂肪来源主要为可可脂;C组:碳水化合物占5%,脂肪占75%,脂肪来源主要为可可脂;D组:碳水化合物占20%,脂肪占60%,脂肪来源为猪油。开始喂养后定期记录摄食量,每周测量小鼠体质量。麻醉后处死并测量肝重。
3.代谢评估:开始后第4周、第24周测量随机血糖水平并留取血清。第22周禁食12h后,测量空腹血糖并留取血清。酶联免疫吸附试验测定随机及空腹胰岛素水平。
4.腹腔注射葡萄糖耐量试验(introperitoneal glucose tolerance test,IPGTT)及丙酮酸耐量试验(pyruvate tolerance test,PTT):小鼠禁食12h,按2g/kg体质量腹腔注射葡萄糖溶液或丙酮酸溶液,分别于0、30及120min测量血糖水平。
5.胰岛素耐量试验(insulin tolerance test,ITT):小鼠禁食6h,按1U/kg体质量腹腔注射胰岛素溶液,分别于0、30及120min测量血糖水平。
6.食物选择试验:8只小鼠适应性喂养2周后,随机分为4笼,每笼2只,同时给予足量普通饮食饲料(70%碳水化合物,10%脂肪)及60%高脂饲料(60%脂肪,来源主要为猪油,20%碳水化合物),每天记录两种饲料摄食量。
7.研究对象:选取2019年12月~2020年5月于笔者医院内分泌门诊诊疗的2型糖尿病患者8例。纳入标准:①T2DM患者符合《中国2型糖尿病防治指南(2017版)》诊断标准[10];②年龄>18岁;③糖化血红蛋白≥7.5%且≤11.0%。排除标准:①1型糖尿病;②具有其他代谢相关疾病病史及DKA相关诱因;③肝肾功能异常者。研究经笔者医院医学伦理学委员会审核通过,研究对象均签署知情同意书。
8.研究方法:患者在试验开始前接受试验者的健康宣传教育,在原有糖尿病药物基础上自行进行低碳饮食,试验期间禁止受试者摄入米面类主食、粗粮、杂粮及含淀粉的蔬菜等高碳食物(要求每日碳水化合物摄入量占总能量摄入的20%以下),对进食次数及数量无限制。开始前及开始1个月后记录患者完整一天的饮食情况,并在期间不定期抽查(>10次/月)。禁食12h后,次日晨检测患者空腹及餐后2h血糖。
结 果
喂养2周后,D组相较于A、B、C组出现明显的体质量增长(P均<0.01),随着喂养时间的增加,4组体质量的差异逐渐增大。喂养24周后,体质量差异进一步增大(P=0.000,图1A)。4组小鼠能量摄入差异有统计学意义(P=0.000,图1B),小鼠体质量增长快慢与能量摄入相一致。高脂饮食喂养后小鼠肝脏重量增加,C组肝重较A组增加37%(P=0.078),D组肝重约为A组的2倍(P=0.000,图1C)。喂养4周及24周后,4组随机血糖比较,差异无统计学意义(P值分别为0.492、0.773,图1D)。4组空腹、随机胰岛素水平比较,差异无统计学意义(P值分别为0.078、0.131,图1E)。
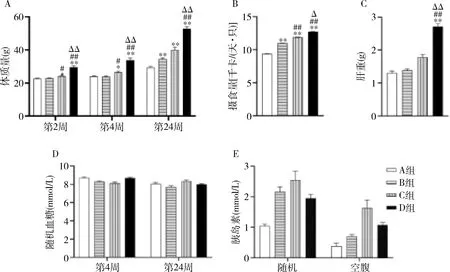
图1 不同饮食组小鼠代谢情况A.体质量;B.摄食量;C.肝重;D.随机血糖;E胰岛素。与A组比较,*P<0.05,**P<0.01;与B组比较,#P<0.05,##P<0.01;与C组比较,ΔP<0.05,ΔΔP<0.01
IPGTT结果表明,D组各点血糖显著高于其他3组(P均为0.000)。ITT结果显示禁食6h后,A组各时间点血糖低于B、C、D组(P均<0.05),D组注射胰岛素后120mim血糖积显著高于B组及C组(P均为0.000)。PTT 结果表明,禁食12h后,A组、B组、C组及D组空腹血糖依次显著升高(P<0.05),A组注射丙酮酸后30min血糖显著低于B、C、D组(P均<0.05),而D组注射丙酮酸后曲线下面积显著高于A、B、C组[1264.00±60.72mmol/(L·min) vs 760.70±92.57mmol/(L·min) vs 1014.00±100.60mmol/(L·min) vs 1012.00±191.10mmol/(L·min),P均<0.05],详见图2。以上结果提示,B、C、D组小鼠相较A组小鼠出现胰岛素耐量和丙酮酸耐量异常,D组异常最为明显。

图2 葡萄糖耐量试验、胰岛素耐量试验及丙酮酸耐量试验中血糖变化情况A.IPGTT;B.ITT;C.PTT;与A组比较,*P<0.05,**P<0.01;与B组比较,#P<0.05,##P<0.01;与C组比较,ΔP<0.05,ΔΔP<0.01
同时给予普通饮食饲料及高脂饲料后,小鼠每日高脂饲料摄入量显著高于普通饲料(P均为0.000,图3)。
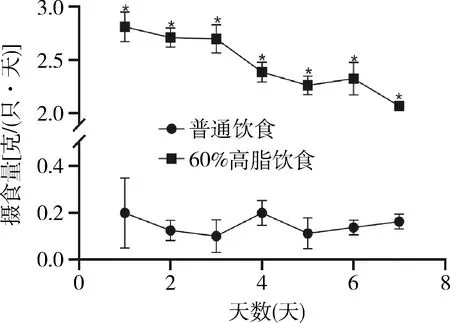
图3 小鼠食物选择试验两组比较,*P<0.01
2型糖尿病患者低碳饮食1个月后摄入能量及体重较饮食前差异无统计学意义,碳水化合物比例减少,脂肪和蛋白比例显著上升(P值分别为0.000、0.003、0.000)。患者空腹及餐后2h血糖显著下降(P值分别为0.013、0.002,图4)。
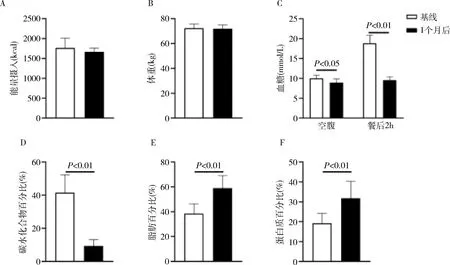
图4 糖尿病患者低碳饮食前及饮食后1个月变化情况A.能量摄入;B.体重;C.血糖;D~F.饮食结构分别为碳水化合物、脂肪、蛋白质
讨 论
本研究在固定蛋白质比例,排除其对小鼠体质量及糖代谢的影响后,发现C组和D组小鼠早期即出现体质量的增加,随着喂养时间延长,各高脂饮食组与普通饮食组之间的体质量差异逐渐增大,体质量增长与能量摄入相一致,并出现胰岛素抵抗及糖异生增加。Hu等[11]研究也发现在控制蛋白质比例后,随着脂肪含量的上升,BALB/c小鼠、C3H小鼠、DBA/2小鼠及FVB小鼠的平均体质量均随之增加。表明高脂饮食在小鼠中更倾向于诱发肥胖及糖脂代谢的紊乱。
一项12周的短期临床试验表明,相较于低脂饮食,低碳饮食组的糖尿病受试者出现更明显的体重下降,更多低碳饮食组受试者减少胰岛素的使用(85% vs 22%)[12]。长期临床试验也表明低碳饮食可改善体重[13, 14]。这与动物模型得出的结论正好相反。
本研究中小鼠在进食同种来源脂肪时,摄入能量及体质量随脂肪比例增高而增加。同样以可可脂为主要脂肪来源,D组小鼠喂养24周后能量摄入较C组小鼠增长8.2%,平均体质量增加了15.5%。既往研究提示使用猪油作为主要脂肪来源的60%高脂饲料喂养小鼠18周后平均体质量及每日能量摄入显著增加[15, 16]。本研究也发现以猪油为主要脂肪来源的小鼠(D组)体质量及摄食量均高于以可可脂为主的同脂肪比例同周龄小鼠(B组),甚至高于以可可脂为主的75%高脂饮食小鼠(C组)。而在同时给予普通饲料及高脂饲料时,小鼠饮食以高脂饲料为主,几乎不摄入普通饲料。笔者猜测以上现象是因为小鼠更偏向于摄入高脂饮食,随饲料中脂肪含量增高,对小鼠食欲的刺激作用更为明显,猪油对小鼠的刺激作用大于可可脂,而脂肪对人群的食欲无刺激作用。本实验在一定程度上证明小鼠体质量增加与能量摄入关系更为密切,而非饮食结构。
本研究人群纳入对象为血糖控制欠佳的2型糖尿病患者,受试者基线日常饮食中碳水化合物比例约40%,明显低于平均约50%的中国居民碳水摄入量,推测患者为改善血糖已自发性地降低碳水化合物摄入。本研究中将碳水的摄入量进一步降低至总热卡20%以下,空腹及餐后血糖出现明显改善。既往一项临床试验发现,一旦限制肥胖受试者碳水化合物的摄入,即使不限制能量摄入,也会出现能量摄入减少[17]。然而本研究观察到2型糖尿病患者低碳饮食后摄入能量无明显变化,考虑原因为基线时患者已降低碳水化合物摄入,总热量减少,低碳后就没有进一步降低摄入量。本研究结果表明,对于2型糖尿病患者,在同等能量摄入下,低碳饮食能够明显改善血糖。
综上所述,喂养低碳高脂饮食后,小鼠摄入能量增多,体质量增加,并伴有胰岛素抵抗及糖代谢紊乱。而2型糖尿病患者在进入低碳饮食后能量摄入不变,代谢改善,因此小鼠难以模拟人体低碳饮食后的代谢变化。

