宫颈管病变
——诊断性辅助检查
李娜,孔宪超
近年部分发达国家已实施全国性筛查和疫苗接种计划,以降低宫颈病变的发病率,但情况仍不容乐观[1]。宫颈外口病变多发生于鳞柱交界处,宫颈高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)常累及宫颈管[2],宫颈管病变被认为是腺上皮和(或)鳞状上皮相关的各种病理学改变的起点。随着对宫颈管病变不断深入地研究发现:①宫颈管病变包括人乳头瘤病毒(HPV)不相关型宫颈腺癌[3],其病毒学检测价值较低;②宫颈管病变存在常规三阶梯筛查取材困难的部位,如宫颈内口及宫颈管中上部;③宫颈管病变有一个特点是跳跃性,即病灶之间至少相隔2 mm 的正常黏膜,因此切缘阴性并不意味着病灶被完全切除[4];④现已有少数宫颈原位腺癌伴卵巢受累[5]。也有研究发现微浸润性宫颈管腺癌出现显微镜下淋巴结转移和肉眼可见的盆腔淋巴结转移[6]。宫颈细胞学检查主要检测鳞状上皮内病变,诊断宫颈管病变准确性不高。常规阴道镜检查可视部位仅为宫颈管下1/3 的黏膜层,对宫颈浸润癌容易造成诊断不足而延误治疗。环形电刀切除术(loop electrosurgical excision procedure,LEEP)下活检取材深度和宽度都有限,不能保证将病变部位切除完整,而且热损伤还会影响标本边缘组织的病理检查结果[7]。现就宫颈管取样(endocervical sampling,ES)、宫腔镜检查和磁共振成像(magnetic resonance imaging,MRI)在宫颈管病变诊断上的价值及指征进行综述。
1 ES
ES 的取材方式分为宫颈管搔刮术(endocervical curettage,ECC)和宫颈刷(endocervical brushing,ECB)。研究表明,ECB 从操作的难易程度、取样质量、患者的承受程度以及出血量上来讲,均优于ECC[6,8-9]。Al-Nourhji 等[10]研究显示,Tp-液基细胞学能检测宫颈管上皮病变,可替代ECC;尽管活检标本可以补充Tp-液基细胞学的发现并有助于进行辅助检查,但并不会检测出其他额外病变。
诊断性ES 包括阴道镜下ES、LEEP 下ES 和超声下ES。其具体指征以及何时进行取样存在争议,不同的指南之间有所不同或者对行ECC 的年龄界限未作说明。
2 阴道镜下ES
阴道镜检查属于传统检查方式,能够将宫颈组织形态经过显示器放大,从而观察到宫颈的颜色、血管情况以及有无病变。当阴道镜检查结果不满意,可疑宫颈管病变时(见图1)[11],许多阴道镜专家会进行ES,以提高检查的可靠性并降低隐匿性恶性肿瘤的风险[12]。
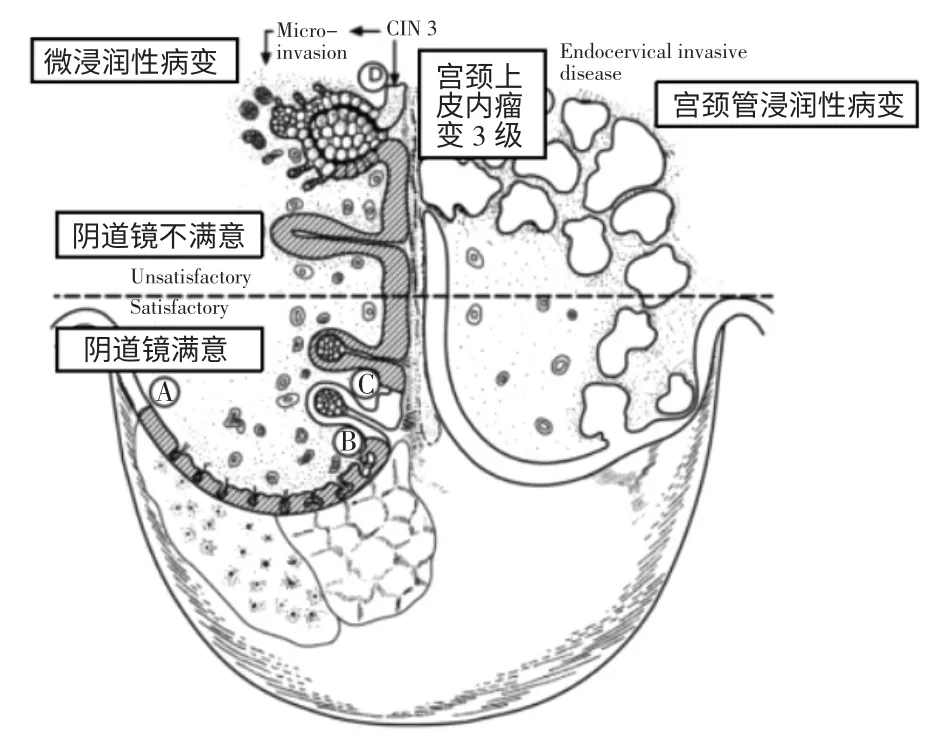
图1 宫颈疾病的横断面剖面图[11]
阴道镜检查不满意时,位于宫颈管的病变无法识别,包括宫颈HSIL,甚至微浸润癌和宫颈管浸润癌。
ES 是阴道镜检查的重要补充部分,以评估宫颈管内癌前病变和隐匿性浸润癌,其可避免遗漏部分浸润性癌[13]。但有研究表明随着宫颈活检次数增加(多达4 次),阴道镜下ES 检出率会有所下降[14]。
2012 年美国阴道镜和宫颈病理学会(ASCCP)提出阴道镜下ES 的指南:经细胞学检查转诊,阴道镜检查不满意(见图2)或阴道镜检查结果满意但未见病变的未孕女性[15]。当前对于阴道镜检查满意、病变部位可见,在患者要求下也可行阴道镜下ES,但指南称其存在争议。
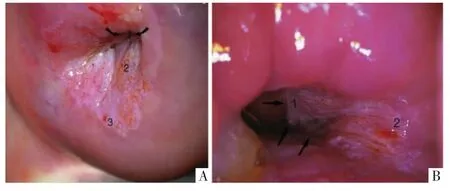
图2 阴道镜检查
在异常细胞学检查结果的诊断中,通常通过阴道镜进行定向活检。2019 年意大利阴道镜和宫颈病理学会(SICPCV)的临床实践指南指出,宫颈细胞学检查中腺细胞异常和宫颈原位腺癌(adenocarcinoma in situ,AIS)所有亚型的妇女均应接受阴道镜检查并进行ES[3]。但对于筛查仅高危型HPV(HR-HPV)阳性是否可以增加CIN 的检出率已有研究结果不一,Ureyen 等[16]研究表明HPV 16(+)、细胞学和阴道镜检查正常的女性,仍有11%的患者通过阴道镜下ECC检出CIN 2+,建议患者仅HPV 16(+)也应常规行阴道镜下ECC。而有研究发现对细胞学检查正常且在转诊子宫颈抹片检查中鉴定出HR-HPV 的患者行阴道镜下ECC 检查未显示出任何作用[8]。
另外,阴道镜下ES 联合多点活检对绝经后女性宫颈病变的诊断具有重要价值[17-18],与LEEP 术后诊断一致,可最小程度地减轻患者的痛苦等,然而对于其他年龄女性则不能完全依赖其结果,应重视诊断性锥切术[19]。
3 LEEP 下ES
对于LEEP 下ES 的意义尚不明确。有研究表明LEEP 的同时行ES 不能诊断病灶是否残留,与单独LEEP 诊断相比,未增加浸润性癌的检出率,但可以发现腺细胞异常[20]。而Cuello 等[21]研究表明LEEP 下ES 结果阳性比切缘阳性更能预测疾病的持续性或复发性,更有助于临床医生做出更精准的决策。另外,对于LEEP 切缘阳性、ECC 阴性的患者来讲,保留生育能力的需求成为一种可能。
需要注意的是,LEEP 下ES 诊断为宫颈低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL),表明可能有HSIL+病变存在于宫颈管内,有助于诊断宫颈原位腺癌(adenocarcinoma in situ,AIS)和隐匿性癌,推荐阴道镜拟诊为极高风险者[12],可行不经活检病理确诊的LEEP(LEEP 仅切除宫颈外口可见病灶)及ES[12,22]。
4 超声下ES
近年有研究显示宫颈管腺体小叶状增生(lobular endocervical glandular hyperplasia,LEGH)可进展为AIS,甚至宫颈腺癌(特别是胃型)[23],因胃型宫颈腺癌预后差、年轻化和HPV 阴性的特点[2],诊断LEGH 至关重要。LEGH 的病灶通常位于宫颈管的上部,常见的取样方式通常很难获得合适的标本,采用超声下ES(见图3)可以靶向定位进行取材,提高其可靠性[24]。大多数LEGH 患者有水样-黏液样白带分泌物,若患者自述此症状突然增加或者定期超声检查观察到积液突然发生,应进行超声下ES,获取细胞学标本进行诊断[24]。
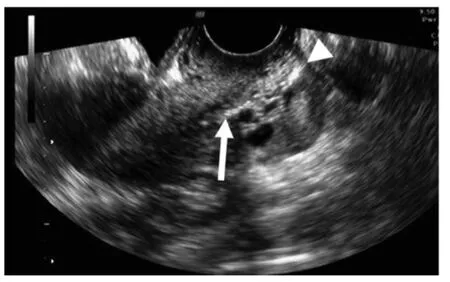
图3 靶向宫颈管取样经阴道超声检查
5 宫腔镜检查
宫腔镜检查直视下观察宫颈管病变,准确定位并评估病变大小、数量,部分情况下可取材进行诊断,并适时治疗。患者自述反复阴道流液、阴道镜检查不满意、阴道镜检查的病变级别与筛查结果不一致或其他影像学检查提示宫颈管内异常等情况下,考虑宫腔镜检查。如:宫颈腺癌(见图4A);宫颈管子宫内膜异位症(见图4B);阴道镜下观察宫颈外口见息肉样组织,利用宫腔镜检查准确定位息肉(见图4C)是来源于宫颈管还是宫腔内,评估其大小、数量并进行取材诊断和(或)切除治疗[25]。然而,对于小和(或)隐蔽于皱襞中的宫颈管病变,如宫颈管憩室,宫腔镜检查很容易漏诊,需要结合其他影像学检查提高检出率。
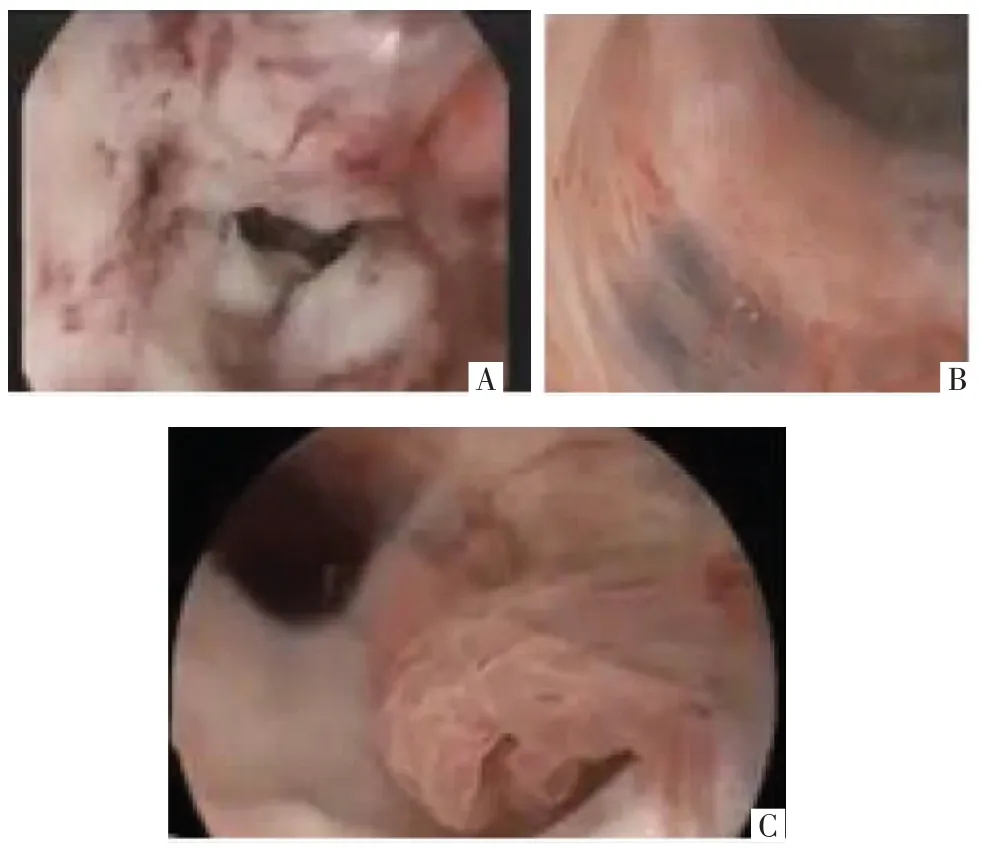
图4 宫腔镜检查可见的多种病灶形态
宫腔镜下取材不受宽度和深度的影响,比盲视下取材更能达到取材的完整性,使诊断更加精准。在如下情况时,可应用宫腔镜切除病变标本进行诊断:①多次锥切术后,细胞学检查仍呈阳性再次取材困难;②绝经后女性宫颈萎缩取材困难;③HPV 持续阳性,可疑宫颈腺癌。
6 MRI
MRI 多方位、多序列成像,可显示肿瘤大小、浸润深度及淋巴结转移等情况,其诊断宫颈癌并评估分期的价值已得到临床广泛认可。有研究表明较常规MRI,磁共振弥散成像(magnetic resonance diffusion imaging,DWI)序列中病变弥散受限呈高信号,并结合病变自动生成表观扩散系数(apparent diffusion coefficient,ADC)信号减低以及ADC 值可以综合判断宫颈病变的良恶性[26]。有研究表明,在绝经后妇女盆腔MRI 图像中,宫颈“树莓型”(呈现宇宙征,见图5)多囊性病变可能与LEGH 的癌变有关,其诊断有利于LEGH 进行危险分层[24]。但宫颈管小的病变在超声上有时观察不到,因此MRI 显示出其突出的诊断价值。
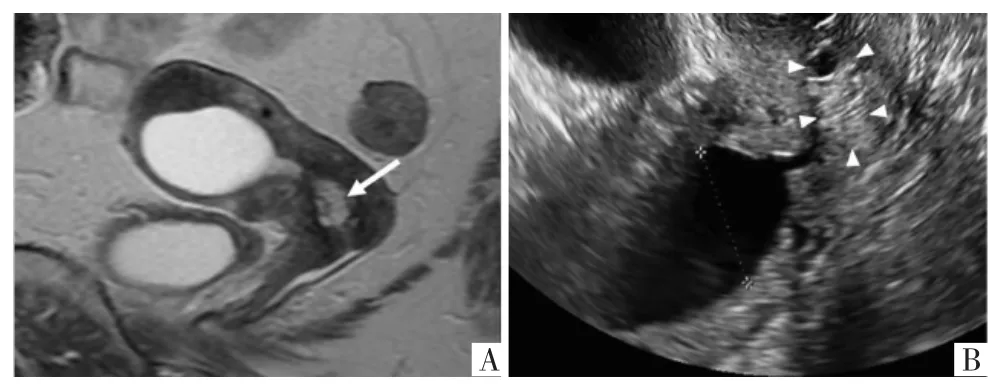
图5 宫颈管病变的影像学检查
7 结语与展望
宫颈管单层柱状上皮菲薄抗感染能力差,易引起感染,且黏膜皱襞较多,发生感染后很难将病原体完全清除,以及早期病变就已发生淋巴结转移,因此应将其精准检出。由于解剖部位的特殊性,其发生病变后在细胞学检查、常规阴道镜检查及LEEP 中不能达到充分评估及诊断,应结合ES(包括阴道镜下ES、LEEP 下ES 及超声下ES)、宫腔镜、MRI 进行综合评估,以提高诊断的准确性。如何规范合理地对宫颈管病变进行诊断,是临床工作中既常见又极为重要的问题,目前指南尚不明确,仍存在一定的研究空间,但需要注意的是,无论采取何种方法进行诊断和治疗,应尽可能对患者进行密切随访。

