帕金森病患者血清中miRNA-153和miRNA-223的表达研究
单岩东,曾晓云,罗志秀,伍俊伊,周 洁,毛正盛
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,其发病率随年龄增长而增加,在65岁以上人群中的发病率可达2%[1]。PD的病理特征是中脑黑质致密部多巴胺能神经元的选择性变性丢失[2],其症状包括典型的运动症状(震颤、强直、姿势步态异常和运动迟缓)和非运动症状(嗅觉减退、睡眠障碍、感觉异常等)。有研究估算了过去的25 y间PD的诊断准确率,为80%[3]。但是有研究指出,在PD的早期阶段(H-Y分级1级),PD病程在5 y内的诊断准确率为53%,而病程在3 y内的诊断准确率仅为26%[4]。目前,PD的诊断主要依赖于临床医师对其临床症状和体征的评估,而缺乏敏感性和特异性都较好的临床诊断标记物。
目前认为PD是遗传易感性与环境因素相互作用的结果,其中遗传因素对PD的发病起着重要作用。MicroRNA(miRNA)是一种非蛋白质编码RNA,在正常和疾病状态的各个过程中均具有重要的调节作用[5]。由于miRNA在疾病进展中的异常表达,因此 miRNA可以作为诊断PD以及其他疾病的生物标记物[6,7]。多个研究证实了miRNA-153和miRNA-223与PD病理改变之间的密切联系[8~10]。本研究将定量检测miRNA-153和miRNA-223在PD患者血清中的表达,评价其诊断PD的效能,以期为PD的诊断提供生物学标志物。
1 材料与方法
1.1 研究对象 选择2018年1月至2019年6月在武汉市第四医院住院的PD患者35例为研究对象(PD组),其中男性16例,女性19例,平均年龄(65.12±10.37)岁。另选取同期本院体检中心的健康体检者40例为对照组,其中男性18例,女性22例,平均年龄(63.71±9.89)岁。两组受试者的年龄、性别无统计学差异(P>0.05)。所有受试者签署知情同意书,本研究经我院伦理委员会审核批准。
1.2 PD纳入标准 由两名神经科医生根据英国PD脑库的诊断标准诊断为原发性PD。
1.3 PD排除标准 ①继发性PD;②帕金森综合征;③PD阳性家族史者;④患有脑血管疾病及其他全身系统严重疾病者。
1.4 收集血清样本 抽取PD患者和健康体检者的空腹肘静脉血5 ml,置入含EDTA-K2抗凝剂的真空采血管中,静置30 min,然后放入离心机,3000转10 min,取上清液置于离心管中,放入-80 ℃冰箱保存。
1.5 RNA的提取及逆转录 按照血清RNA提取试剂盒(北京天根公司)说明书操作提取血清标本中的总RNA,后用紫外分光光度计检测吸光度值,选取比值在1.8~2.0的RNA样本,放入-80℃冰箱。将上述RNA样本采用逆转录试剂盒(Revertra Ace qRT-PCR Master Mix)逆转录为cDNA,置入-80 ℃备用。
1.6 实时定量PCR(qRT-PCR)检测miR-153和miR-223的表达 根据GenBank中的基因序列号,用Primer Primer 5.0软件设计引物(上海生工合成),U6作为内参。miR-153的上游引物序列:5’-TCAATGCCTATCAATTATGC-3’,下游引物序列:5’-CTAACGTACGATTCCATAGG-3’;miR-223的上游引物序列:5’-ATTCTGTACCGTATCGGCC-3’,下游引物序列:5’-TACCGGTACTATCCTAGAA-3’;U6的上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCGT-3’。PCR反应在ABI 7500 Fast荧光定量PCR仪(美国ABI公司)上进行,程序为:95 ℃ 30 s,60 ℃ 20 s,72 ℃ 45 s,共40个循环。实验所得数据运用公式2-ΔΔCt进行分析。
2 结 果
2.1 miRNA-153和miRNA-223在PD组和健康对照组血清中的表达 本研究中,PD组血清中miRNA-153的相对表达水平(1.87±0.64)明显低于对照组(2.76±0.71),差异有统计学意义(t=5.71;P<0.01)(见图1A);PD组血清miRNA-223的相对表达水平(1.62±0.64)与健康对照组(2.72±0.89)相比,也明显下降,差异有统计学意义(t=6.07;P<0.01)(见图1B)。

A B
2.2 血清miRNA-153、miRNA-223和miRNA153+miRNA-223对PD的诊断价值 根据ROC分析所示,血清miRNA-153作为诊断PD的AUC为0.8279,其敏感性和特异性分别为72.65%和81.24%;miRNA-223作为诊断PD的AUC为0.8404,敏感性和特异性分别为75.03%和77.14%;血清miRNA-153+miRNA-223作为诊断PD的AUC为0.8589,敏感性和特异性分别为77.34%和82.51%。血清miRNA-153和miRNA-223单独诊断PD的AUC的差异无统计学意义(P>0.05);血清miRNA-153+miRNA-223联合检测与分别单独应用血清miRNA-153、miRNA-223诊断PD的AUC相比,差异无统计学意义,(P>0.05)(见表1、图2)。
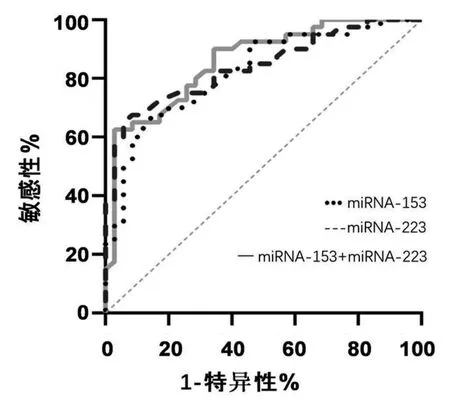
图2 血清miRNA-153、miRNA-223以及miRNA-153+miRNA-223诊断PD的ROC
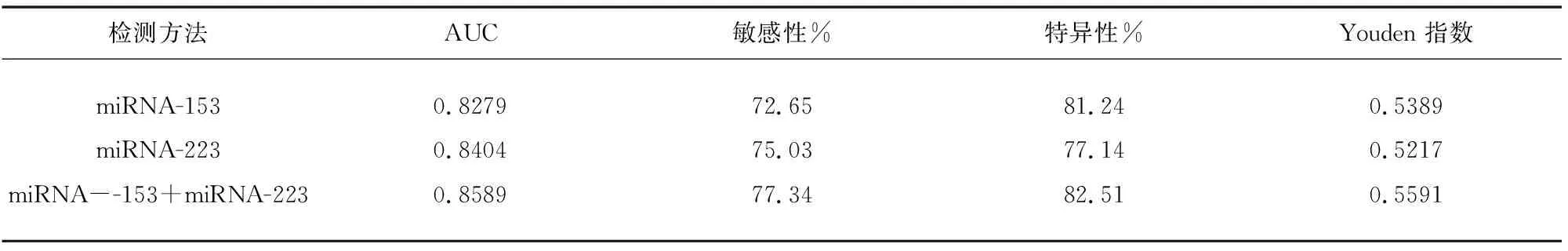
表1 血清miRNA-153和miRNA-223的诊断价值分析
2.3 PD组血清miRNA-153、miRNA-223的相对表达与H-Y分级的相关性分析 根据分析所示,PD组血清miRNA-153的相对表达(1.87±0.64)与H-Y分级(3.07±0.99)呈负相关(r=-0.4504,P<0.01);PD组血清miRNA-223的相对表达(1.62±0.64)与H-Y分级(3.07±0.99)无明显相关性(r=-0.2289,P>0.1)(见图3)。
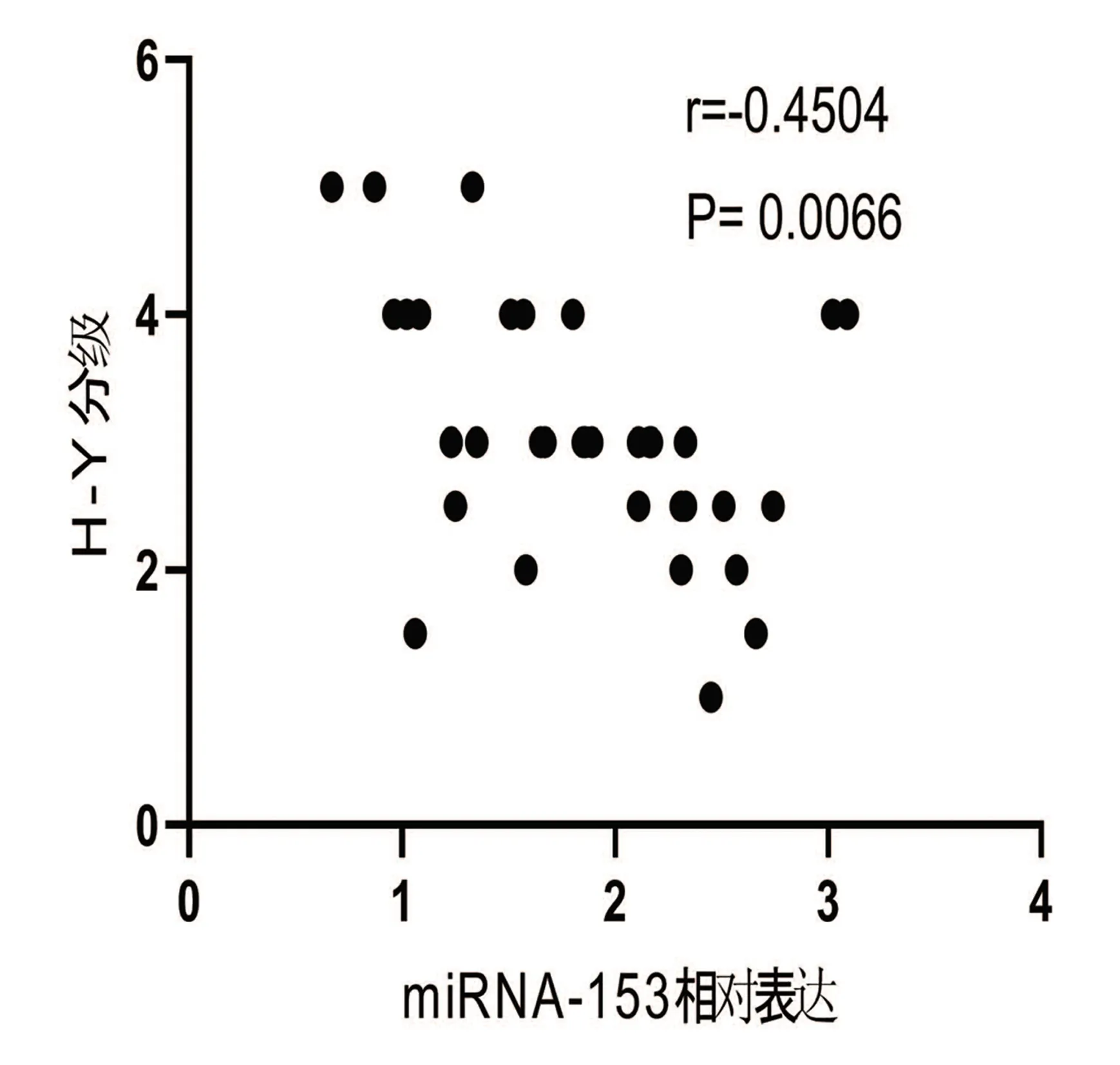
图3 PD组血清miRNA-153、miRNA-223相对表达水平与H-Y分级相关性分析的散点图
3 讨 论
PD是一种慢性、进展性的神经系统变性疾病,目前尚无法治愈。明确诊断是PD在临床方面的一大难题,尤其是在疾病的早期阶段。因此临床急需准确可靠的PD诊断临床标记物。PD的病理特征是中脑黑质致密部和纹状体中的多巴胺能神经元进行性退化,并形成纤维状内含物:路易体和路易神经突。α-突触核蛋白是路易体和路易神经突含有的一种重要物质,其大小为14 kDa,多位于突触前末端和核膜中,主要作用为参与N-乙基马来酰亚胺敏感因子受体介导的胞吐作用和突触小泡的转运[11]。基因或环境的改变极易引起α-突触核蛋白发生错误折叠,蛋白质出现寡聚体,纤维性蛋白质逐渐增多,可溶性改变,继而路易小体出现,最终导致多巴胺能神经元受损。多项研究发现miRNA-153和miRNA-223通过调控α-突触核蛋白,进而与PD的发病及疾病的进展产生密切联系[8,9]。Annamaria等的研究发现[10],PD患者的血清miRNA-223表达明显下调。也有团队对PD患者脑脊液miRNA-153的表达进行了研究,发现脑脊液miRNA-153的表达明显上调[12];而在另一项研究中,PD患者血清miRNA-153的表达明显下调[13]。Marisa等对PD患者唾液中miRNA-153和miRNA-223的表达进行了研究,发现miRNA-153和miRNA-223的表达均明显下调[14]。我们的研究发现,与健康对照人群相比,PD患者血清miRNA-153和miRNA-223的表达均明显下调;血清miRNA-153和miRNA-223作为诊断PD的AUC分别为0.8279和0.8404,而且敏感性和特异性均良好,因此可作为诊断PD的生物学标记物。血清miRNA-153和miRNA-223单独诊断PD的价值无明显差异;而且血清miRNA-153联合miRNA-223诊断PD的价值无明显提升。
本研究还分析了PD患者血清miRNA-153和miRNA-223的相对表达与PD患者H-Y分级的相关性。我们发现,PD患者血清miRNA-153的相对表达与H-Y分级之间具有明显的相关性,呈负相关;而PD患者血清miRNA-223的相对表达与H-Y分级无相关性。因此,血清miRNA-153的相对表达有可能成为评价PD病程进展的一项指标。
综上所述,PD患者血清miRNA-153和miRNA-223的相对表达均明显下调,可作为诊断PD的生物学标志物;PD患者血清miRNA-153与H-Y分级呈负相关,可用于评估PD的病程进展情况。但是,本研究还存在着很多局限性:样本量较少;对照组为健康人群,进一步的临床应用尚需纳入与其他神经系统疾病(非PD所致的运动障碍性疾病和变性疾病);血清miRNA-153的表达是否能准确评价PD的病程进展等。这都需要进一步的深入研究。

