白藜芦醇对IEC-6 细胞辐射损伤的防护作用及机制研究
秦浩人 孙婉君 张恒 阎皓 张诗武 朱思伟 王辉
放射性肠炎是腹腔、盆腔、腹膜后恶性肿瘤放疗后的常见并发症,主要表现为腹痛、腹泻、便血、里急后重等症状,严重者可引起肠穿孔、腹膜炎等并发症,危及病人生命[1]。放疗医师为避免放射性肠炎,对肿瘤靶区的单次照射剂量和总照射剂量给与限制,甚至放弃对部分靶区的治疗,因此严重影响病人的预后。目前除对症支持治疗外,临床上对放射性肠炎尚缺乏有效的治疗手段,因此如何有效减轻和治疗放射性肠炎是一个亟需解决的问题。
电离辐射诱导的氧化应激是放射性肠损伤主要原因[2]。相关研究[3]表明,电离辐射产生的过量活性氧(reactive oxygen species,ROS)能抑制小肠黏膜再生,由此导致放射性肠炎。在细胞水平上,ROS 积累会导致细胞衰老和凋亡,造成辐射损伤[4-5]。因此,通过消除ROS 并抑制细胞衰老、凋亡对放射性肠炎的治疗具有重要意义。
白藜芦醇是一种天然多酚类化合物,具有抗氧化、抗衰老、抗炎和抗凋亡等多种药理作用[6-7],可以改善电离辐射引起的肝损伤、造血系统损伤和卵巢炎症,是一种潜在的放射防护剂。前期研究[11]发现白藜芦醇能够改善电离辐射诱导的小鼠小肠损伤,但其能否通过消除ROS 并减轻辐射诱导的细胞衰老、凋亡,从而改善辐射诱导的小肠损伤仍不清楚。本研究以大鼠小肠隐窝上皮细胞(intestinal epithelial cell-6,IEC-6)为研究对象,评估白藜芦醇对IEC-6辐射损伤的保护作用,并探讨白藜芦醇是否可以消除ROS 并抑制细胞衰老及凋亡,为白藜芦醇治疗放射性肠炎提供理论支持。
1 材料与方法
1.1 材料 大鼠IEC-6 细胞系购自中国医学科学院基础医学研究所。DMEM 高糖培养基、胎牛血清、双抗购自美国Gibco 公司,白藜芦醇、牛胰岛素购自美国Sigma 公司。P16 抗体购自Abcam 公司;P21 抗体购自Affinity 公司;β-actin、过氧化氢酶(catalase,CAT)、超氧化物歧化酶2(superoxide dismutase 2,SOD2)抗体购自于CST 公司。细胞增殖及毒性检测(cell counting kit-8,CCK-8)试剂盒、β-半乳糖苷酶(β-galactosidase,β-Gal)染色试剂盒购自北京索莱宝科技有限公司;ROS 检测试剂盒、细胞凋亡检测(Annexin V-PI Apoptosis Detection, Annexin V-PI)试剂盒购自碧云天生物技术有限公司。mRNA 提取及反转录、cDNA 扩增及实时荧光定量PCR(realtime qPCR)检测试剂盒购自上海翊圣生物科技有限公司。引物序列由生工生物工程股份有限公司合成。
1.2 细胞培养及分组 用含10%胎牛血清、1%双抗、0.1%胰岛素的DMEM 高糖培养基中培养,在含5%CO2、37.0 ℃的恒温细胞培养箱中孵育,每2 d 换液1 次,细胞密度至90%以上后传代,取对数生长期细胞进行实验。白藜芦醇在二甲基亚砜中溶解,用DMEM 高糖培养基稀释。将细胞进行等量载体孵育后分为对照组、模型组和白藜芦醇组,分别做不同处理。①对照组:仅接受伪照射。②模型组:接受不同剂量(2、4、6、8、10 Gy)的6 MeV 高能X 射线照射,剂量率0.99 Gy/min。记录不同剂量照射后的细胞克隆团数量,分析电离辐射对细胞增殖的影响。③白藜芦醇组:照射前2 h 加入含不同浓度的白藜芦醇培养基孵育,测量0.1、0.5、1、5、10、20、40 μmol/L白藜芦醇处理后的细胞活力;另外,测量在0.1、1、2、4、6、8 μmol/L 白藜芦醇处理后经电离辐射的细胞活力。选取细胞活力最佳时对应的白藜芦醇浓度,测量该浓度下细胞凋亡率、DCFH-DA 荧光强度、β-Gal 阳性率及SOD2、CAT、p16、p21 的mRNA 水平和蛋白质表达。
1.3 克隆形成实验检测细胞增殖 细胞处理后常规消化细胞,将细胞稀释至104 个/mL,在6 孔板内接种细胞,每孔600 个细胞。在37 ℃细胞培养箱内孵育7~14 d,当肉眼可见细胞克隆团时中止孵育。用4%多聚甲醛固定细胞15 min,弃去固定液后0.1%结晶紫染色30 min,流水缓慢洗去染色液,空气干燥。在显微镜下计数,将细胞数目大于10 的克隆团计为1 个克隆团。
1.4 CCK-8 法检测细胞活力 细胞消化后接种于96 孔板内,3 000 个细胞/孔,每组设置5 个副孔。细胞在培养箱中孵育24 h 至细胞贴壁后对细胞进行处理。细胞处理后在培养箱中继续孵育24 h。向每孔加入10 μL CCK-8 试剂,培养箱内孵育2 h 后用酶标仪测定在450 nm 处的光密度(OD)。
1.5 2’,7’-二氯荧光黄双乙酸盐(2,7-Dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针检测ROS 照射及给药处理后6 h 检测ROS。按照1∶1 000 无血清培养基稀释DCFH-DA。去除细胞培养液,加入1 mL 稀释的DCFH-DA。37 ℃细胞培养箱内孵育20 min。无血清培养基洗涤细胞3 次后在荧光显微镜下检测,激发波长为488 nm,发射波长为525 nm。
1.6 流式细胞术检测细胞凋亡 照射给药处理后24 h,参照Annexin V-PI 凋亡检测试剂盒说明书检测IEC-6 细胞凋亡、坏死率。将处理后的细胞培养液转移至离心管内,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤贴壁细胞1 次,加入胰酶消化。室温孵育至轻轻吹打可以使贴壁细胞吹打下来时加入收集的细胞培养液中止消化。调整细胞浓度至(5~10)×105/mL,取1 mL 再次离心洗涤。弃上清,加入195 μL Annexin V-FITC 结合液轻轻重悬细胞。加入5 μL Annexin V-FITC,加入10 μL 碘化丙啶染色液,轻轻混匀。20~25 ℃室温下避光孵育10~20 min 后进行检测。
1.7 β-Gal 染色检测细胞衰老 将IEC-6 细胞接种于6 孔板内,照射给药处理后48 h 检测细胞衰老。吸出孔内培养液,PBS 洗涤后加入1 mL β-Gal染色固定液,室温固定15 min。吸除固定液后PBS洗涤3 次,每孔加入1 mL 染色工作液,37 ℃孵育在无二氧化碳环境中过夜,光学显微镜下观察,每组随机选取6 个视野,统计β-Gal 阳性率
1.8 Real-time qPCR 检测mRNA 水平 照射后24 h胰酶消化并收集细胞,采用Trizol 提取总RNA,测定RNA 浓度及纯度,按反转录试剂盒步骤构建cDNA文库。以cDNA 为模板进行Real-time qPCR 扩增。GAPDH 为内参,内参及目的基因Cdkn2a(p16)、Cdkn1a(p21)、SOD2、CAT 引物序列见表1。扩增条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火/延伸30 s,循环40 次。采用2-ΔΔCt法计算目的基因相对表达量。

表1 基因的引物序列及产物大小
1.9 Western Blot 检测蛋白质表达 照射后24 h 采用胰酶消化并收集细胞,加入适量的细胞裂解液重悬,置于冰上裂解30 min(每隔5 min 震荡1 次),裂解完全后放入已预冷的离心机中14 000 r/min 离心15 min;BCA 法测定蛋白质浓度后取上清并加入上样缓冲液,100 ℃变性10 min;每孔等量上样,将蛋白质进行SDS-PAGE 电泳分离,并转移至PVDF 膜上;5%脱脂奶粉室温封闭2 h 后孵育一抗,4 ℃震荡过夜。TBST 洗膜3 次,室温下孵育二抗2 h,再次洗膜后用ECL 化学发光液显影,Bio-rad 全自动凝胶成像系统显影拍照。将β-actin 设为内参蛋白,Image J 1.4 软件分析P16、P21、CAT、SOD2 和β-actin 蛋白条带的灰度值,比较各组蛋白质表达量。
1.10 统计学方法 采用SPSS 20.0 软件对数据进行统计学分析。采用Kolmogorov-Smirnov 检验评估计量资料的正态性,符合正态分布的计量资料以均数±标准差(±s)表示。多组间比较采用单因素方差分析,应用Tukey’s HSD 进行验后两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 电离辐射对IEC-6 细胞增殖的影响 对照组细胞克隆团数量为(272.00±15.00)个,模型组采用2、4、6、8、10 Gy 电离辐射后细胞克隆团数量分别为(249.30±14.19)、(215.70±19.55)、(146.70±15.70)、(65.00±12.77)、(27.33±3.51)个,组间比较差异有统计学意义(F=147.40,P<0.001)。模型组4、6、8、10 Gy电离辐射后细胞克隆团数量逐渐减少,均低于对照组(P<0.05)(图1)。

图1 电离辐射后细胞克隆团数量。a 与对照组相比,P<0.05。
2.2 白藜芦醇对IEC-6 细胞活力的影响 对照组细胞在450 nm 处的OD 值为2.475±0.271,浓度为0.1、0.5、1、5、10、20、40 μmol/L 的白藜芦醇组细胞的OD 值分别为2.479±0.358、2.355±0.260、2.593±0.376、2.340 ±0.384、1.956 ±0.368、1.236 ±0.262、0.719±0.072,组间比较差异有统计学意义(F=28.70,P<0.001)。其中,浓度为10、20、40 μmol/L 的白藜芦醇组细胞的OD 值逐渐降低,均低于对照组(均P<0.05),其余各组与对照组相比差异无统计学意义(均P>0.05)(图2)。
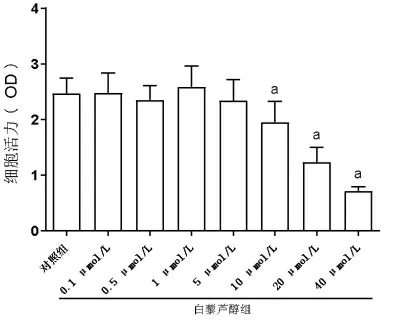
图2 白藜芦醇对细胞活力的影响。a与对照组相比,P<0.05。
2.3 白藜芦醇对电离辐射后细胞活力的影响 对照组细胞在450 nm 处的OD 值为1.416±0.177,模型组的OD 值为1.108±0.123,浓度为0.1、1、2、4、6、8 μmol/L 的白藜芦醇组细胞的OD 值分别为1.291±0.119、1.329±0.210、1.125±0.100、1.143±0.211、0.946±0.368、0.943±0.062,多组间比较差异有统计学意义(F=10.94,P<0.001)。模型组和2、4、6、8 μmol/L 白藜芦醇组细胞OD 值均低于对照组(均P<0.05);0.1、1 μmol/L 白藜芦醇组细胞OD 值高于模型组(P<0.05);其余各组细胞OD 值比较差异无统计学意义(均P>0.05)(图3)。
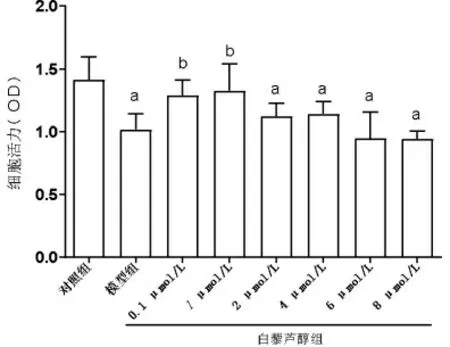
图3 白藜芦醇对电离辐射后细胞活力的影响。a 与对照组相比,P<0.05;b 与模型组相比,P<0.05。
2.4 3 组间细胞凋亡率、DCFH-DA 荧光强度及β-Gal 阳性率的比较 相比对照组,模型组的细胞凋亡率、DCFH-DA 荧光强度、β-Gal 阳性率均明显升高(均P<0.05),白藜芦醇组的DCFH-DA 荧光强度也升高(P<0.05);相比模型组,白藜芦醇组各指标均降低(均P<0.05)。详见图4-6,表2。
2.5 3 组目的基因的mRNA 水平比较 3 组IEC-6细胞中CAT、SOD2、p16、p21 的mRNA 水平比较差异均有统计学意义(均P<0.05)。其中,模型组细胞的SOD2、CAT 的mRNA 水平均低于对照组和白藜芦醇组(均P<0.05),p16、p21 的mRNA 水平高于对照组和白藜芦醇组(均P<0.05)(表3)。
2.6 3 组细胞目的蛋白表达的比较 3 组IEC-6 细胞中CAT、SOD2、P16、P21 蛋白的表达差异均有统计学意义(均P<0.05)(图7)。其中,模型组细胞SOD2、CAT 蛋白的表达均低于对照组和白藜芦醇组(均P<0.05),而P16、P21 蛋白的表达高于对照组和白藜芦醇组(均P<0.05)。白藜芦醇组P21 蛋白表达也高于对照组(P<0.05)(表4)。
3 讨论
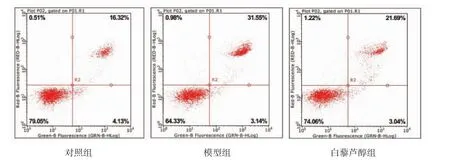
图4 Annexin V/PI 染色后3 组IEC-6 细胞凋亡及坏死散点图。左下象限为活细胞数量(Annexin V-/PI-),左上象限为坏死细胞数量(Annexin V-/PI+),右上象限为凋亡和坏死细胞数量(Annexin V+/PI+),右下象限为凋亡细胞数量(Annexin V+/PI-),右上和右下象限细胞数目之和(Annexin V+)为凋亡细胞数。
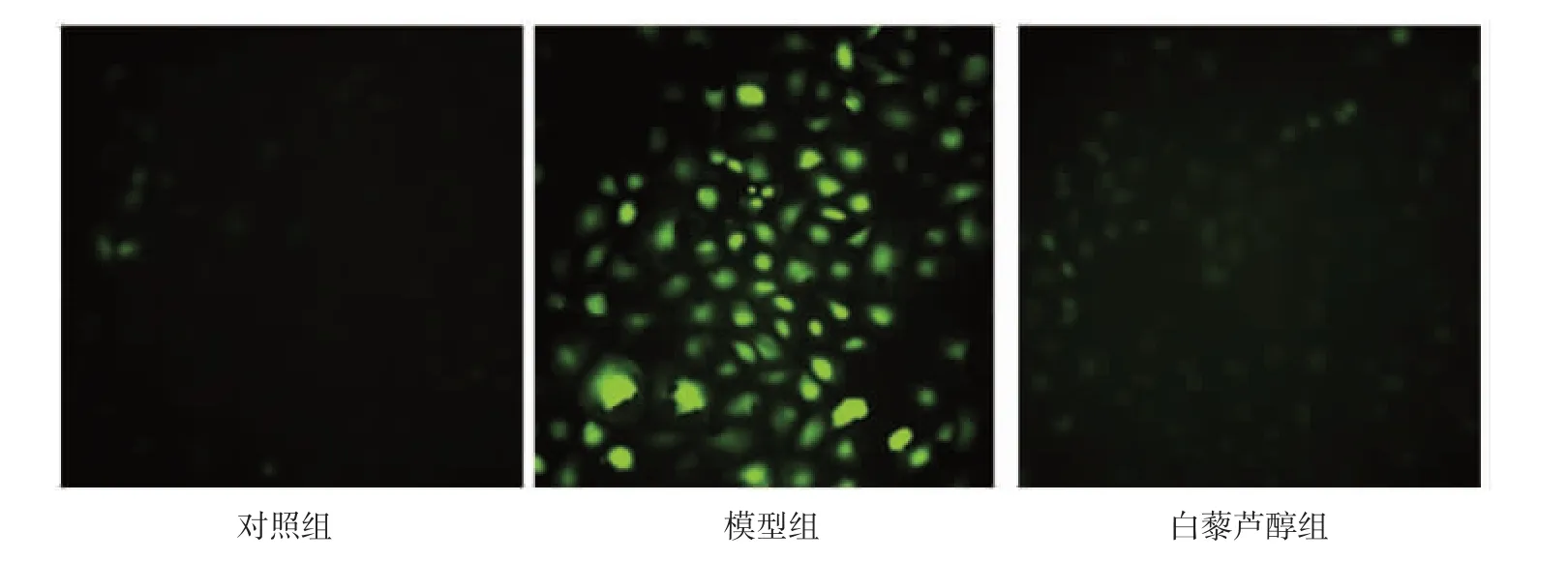
图5 3 组IEC-6 细胞DCFH-DA 荧光强度图。应用DCFH-DA 荧光探针对细胞内ROS 染色,ROS 呈绿色荧光。
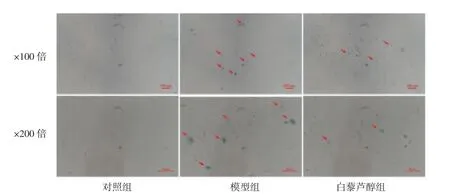
图6 白藜芦醇对电离辐射后IEC-6 细胞衰老的影响。3 组间β-Gal 阳性细胞染色照片,β-Gal阳性细胞染色后呈青绿色(红色箭头标注)。
小肠黏膜是快速更新的组织之一,对辐射敏感,目前对辐射导致的小肠损伤尚无有效治疗措施。黏膜是早反应组织,辐射损伤的修复主要依赖于黏膜干细胞的增殖作用[12]。研究[13]表明位于小肠隐窝底部第4、5 层的细胞,具有较强的增殖和分化功能,可以生成吸收细胞、杯状细胞、内分泌细胞和潘氏细胞,以维持小肠隐窝和绒毛上皮的完整性。IEC-6 细胞是从正常SD 大鼠空肠隐窝分离并培养的细胞系,能很好地反映肠上皮细胞的生物特性,常被用作炎性肠病的体外模型。本研究以IEC-6 细胞为研究对象,应用克隆形成实验检测细胞克隆团数量,发现4~10 Gy 电离辐射能够以剂量依赖性抑制IEC-6 细胞增殖。因此,选用10 Gy 电离辐射建立IEC-6 细胞辐射损伤模型。CCK-8 实验结果表明,IEC-6 细胞对浓度为0.1~5 μmol/L 的白藜芦醇耐受性良好;在该剂量范围内,进一步检测白藜芦醇对电离辐射后IEC-6 细胞活力的影响。结果表明低剂量(0.1~1 μmol/L)白藜芦醇预处理后细胞活力较模型组增加,提示低剂量白藜芦醇能够改善辐射诱导的细胞损伤,因此选择浓度为1 μmol/L 的白藜芦醇进行后续实验。Annexin V-PI 染色结果表明,白藜芦醇预处理后细胞凋亡率较模型组下降,这进一步说明了白藜芦醇能有效改善辐射诱导的IEC-6细胞损伤。
电离辐射诱导的ROS 产生是细胞辐射损伤的重要原因。ROS 是一类不稳定的含氧分子,具有高度反应活性,可引发链式自由基反应,引起DNA、蛋白质、脂类等生物大分子变性和交联,从而造成细胞损伤[4,14]。DCFH-DA 荧光探针能够反映细胞内ROS 水平。本研究结果表明,白藜芦醇处理后DCFHDA 荧光强度较模型组明显降低,但仍高于对照组,这表明白藜芦醇能够抑制但不能完全消除电离辐射后ROS 的产生。SOD2 是一种线粒体解毒酶,能够催化超氧化物转化为过氧化氢。随后,CAT 将过氧化氢分解为水,从而减轻细胞的氧化应激损伤。有研究[3]显示小肠中过量的ROS 会抑制小肠干细胞增殖和分化,而抗氧化应激治疗能促进小肠黏膜再生,从而减轻辐射诱导的小肠损伤。本研究结果表明,白藜芦醇预处理后IEC-6 细胞中SOD2、CAT 的mRNA 水平和蛋白质表达较模型组明显增高,这说明白藜芦醇可以通过增加抗氧化酶的表达,消除电离辐射后ROS 的产生,从而改善IEC-6 细胞辐射损伤。
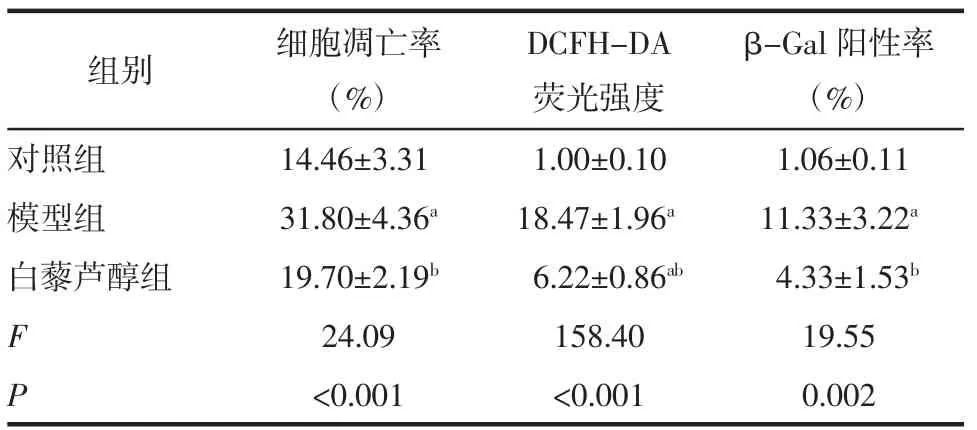
表2 3 组间IEC-6 细胞的凋亡率、DCFH-DA 荧光强度、β-Gal 阳性率的比较

表3 3 组间IEC-6 细胞p16、p21、CAT、SOD2 的mRNA 水平比较

表4 3 组间IEC-6 细胞P16、P21、CAT、SOD2 蛋白的表达比较
细胞内过量的ROS 还能够诱导细胞衰老。细胞衰老是指细胞失去增殖分化能力,并伴随着永久的细胞周期阻滞。在衰老细胞中高表达衰老相关β-Gal,因此β-Gal 染色能够反映细胞衰老。p16 与p21 基因表达与细胞衰老密切相关[15]。p16 编码的蛋白主要作用于CDK4,并抑制CDK4 与Cyclin D1 结合,造成G1/S 期阻滞。研究表明,p16 在人类细胞衰老过程中表达持续增高,可作为细胞衰老的标志物[16]。P21 蛋白是P53 蛋白的下游产物,能够与Ckd2-Cyclin E 和Cdk4/6-Cyclin D1 等细胞周期蛋白结合并抑制其活性,使细胞停滞于G1期,诱发细胞衰老特征性改变。在本实验中,电离辐射后IEC-6 细胞中p16、p21 基因和蛋白的表达均上调。而白藜芦醇预处理后,p16、p21 基因和蛋白的表达及β-Gal 阳性细胞比例较模型组明显降低,这说明白藜芦醇可以改善电离辐射诱导的细胞衰老。
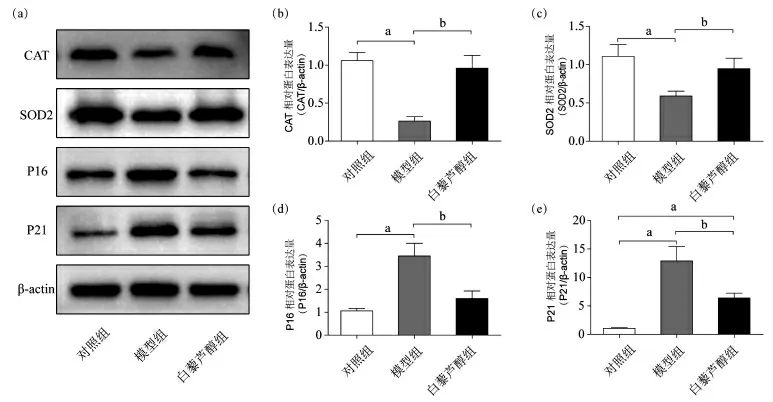
图7 Western blot 检测CAT、SOD2、P16、P21 蛋白的表达。(a)IEC-6 细胞中CAT、SOD2、P16、P21蛋白表达情况;(b-e)CAT、SOD2、P16、P21 蛋白相对表达量统计柱状图。a 与对照组相比,P<0.05;b 与模型组相比,P<0.05。
综上所述,白藜芦醇可以通过消除活性氧,抑制细胞衰老及凋亡,改善电离辐射诱导的IEC-6 细胞损伤。然而,辐射诱导细胞损伤的机制是复杂的,且白藜芦醇作为一种非特异性化合物,可作用于多个靶点。因此,在IEC-6 细胞的辐射损伤防护中,白藜芦醇的具体作用机制仍需进一步探讨。

