α 粒子靶向治疗肿瘤研究进展
周利心 张俊*
放射性核素治疗是治疗恶性肿瘤的重要方法之一。β 粒子发射体是目前主要用于内照射治疗的核素[1],而α 粒子凭借较高的传能线密度(linear energy transfer,LET)、较强的相对生物学效应(relative biological effectiveness,RBE)及较低的毒副作用,将来有可能替代β 粒子用于靶向治疗。α 粒子可以对原发性和转移性肿瘤进行全身性的靶向放疗,尤其对血液系统肿瘤及全身广泛分布的微小肿瘤灶具有较好的治疗潜力[2]。
结合α 核素在体内的代谢途径、半衰期及核素的可获取性,目前临床及临床前研究的核素主要有锕-225(225Ac)、铋-213(213Bi)、砹-211(211At)、铅-212(212Pb)和镭-223(223Ra)[3]。美国食品药物管理局(FDA)已批准223RaCl2用于治疗前列腺癌骨转移[4],其在国内也进入上市前审批阶段。鉴于前列腺特异膜抗原(prostate specific membrane antigen,PSMA)-617 小分子抑制剂对PSMA 具有较高的亲和力[5],临床已开展应用225Ac-PSMA-617 治疗转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)的研究[6-7]。近年随着靶向配体及载体的小分子配体、肽类、抗体和纳米材料等技术的迅速发展,α 粒子靶向治疗(targeted alpha-particle therapy,TAT)在临床上得到了更广泛的关注。本文对近年α 粒子在肿瘤靶向治疗方面的研究进展进行综述。
1 α 粒子简介及治疗特性
α 粒子带正电荷,质量大,能量范围4~9 MeV。放射性核素衰变产生的α 粒子含有2 个中子和2 个质子,等于氦原子核的质量和电荷(42He)。α 粒子比β 粒子的能量(50~2 300 keV)高出100~1 000 倍[8]。α 粒子速度慢、射程短,穿透组织的范围仅为50~100 μm;而β 粒子射程范围为0.5~5 mm。α 粒子还具有较高的LET(100 keV/μm),比β 粒子的LET(0.2 keV/μm)高出400~500 倍[9]。相比β 粒子,α粒子仅对少数几种肿瘤细胞起作用,在保护周围健康组织的同时,能够将药物引起的不良反应降到最低[10]。α 粒子在其穿行路径末端接近布拉格峰的最大能量,有较高的RBE[11],对细胞的DNA 双链和DNA 簇杀伤力高,且不依赖水分子裂解产生的氧自由基,不受细胞周期的影响,因此DNA 双链无法完成自身的断裂修复而产生永久性损伤[12-13]。α 粒子除了上述的直接作用,对肿瘤细胞还能产生一些间接作用。α 核素可在较短的距离内产生大量的α 射线,使邻近未被辐射到的非靶肿瘤细胞产生氧自由基及DNA 损伤等靶外效应[14]。此外,目前已有研究[3,15]证实α 粒子在灭活肿瘤细胞的同时可以提高免疫应答能力,使肿瘤细胞对T 细胞更敏感,联合其他药物可以提高治疗效果。因此,通过上述直接和间接作用,α 粒子对化疗以及包括β 射线在内的内外放疗均不敏感的异质肿瘤细胞具有杀伤作用,消除了肿瘤的抵抗机制,为常规治疗无效的病人提供了新的治疗方法[16]。另一方面,部分α 核素衰变的同时会产生γ 射线,适合核医学显像,有助于辅助药代动力学和剂量学评估[17]。可见,α 粒子在肿瘤的靶向治疗中具有独特优势。
2 α 放射性核素目前标记的配体和载体
α 放射性核素通常需要配体或载体才能被运输到靶组织而发挥治疗作用,因此配体和载体的选择是决定TAT 成败的关键。目前α 放射性核素主要标记的配体和载体有小分子配体、肽、抗体、抗体片段以及纳米材料等(部分α 放射性核素如223Ra 可直接与靶组织结合)[18]。为了确保α 粒子能安全、高效地到达靶点,且运输过程中不脱靶,在选择配体和载体时,需要考虑到其靶器官结合力、生物特性、药代动力学、半衰期、脱靶率等因素。
2.1 小分子配体 小分子配体可以迅速渗透到肿瘤组织中,且能从循环系统快速清除,因此降低了放射性药物的毒性,是目前临床研究最常见的配体[19]。PSMA-617 是靶向PSMA 的小分子,有良好的药代动力学,能快速被肿瘤组织吸收并内化至肿瘤细胞中[5],未结合的配体也迅速被清除,适用于半衰期为数天且衰变链有多个子代的α 核素(如225Ac)的标记[20],目前已有临床试验证实225Ac-PSMA-617对mCRPC 的治疗具有显著的疗效[6]。
2.2 多肽、抗体和抗体片段 多肽是氨基酸的低聚物,制备方便,清除迅速。生长抑素类似物是近年神经内分泌肿瘤靶向治疗研究的热点,FDA 已经批准了177Lu-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽(TATE)(DOTATATE)用于肽受体放射性核素治疗[21]。在Gao 等[22]的临床试验中,采用213Bi 和225Ac 分别标记DOTA-酪氨酸3-奥曲肽(DOTATOC)、DOTATATE 对β 射线抵抗的神经内分泌肿瘤治疗,结果显示病人的预后得到改善,生存时间延长。
抗体对细胞外受体有高度亲和力和特异性,G型免疫球蛋白(IgG)单克隆抗体(mAb)是目前最常用的肿瘤显像和治疗载体,分子量约为150 ku[23-24],但是单克隆抗体在血液中有较长的循环时间,且到达肿瘤组织的量较少,在关键器官(尤其是肝脏)中积累增多。针对这些问题,利用现代蛋白质工程技术可以生产抗体片段,包括单结构域抗体、双抗体、微型抗体、蛋白质支架和更复杂的双特异性抗体等[23]。有研究[25]表明,抗体的重组片段不仅提高了机体的清除率,而且也相应提高了肿瘤的渗透率。有临床试验应用225Ac-lintuzumab 治疗急性髓细胞白血病,lintuzumab 是人源化的抗CD33 mAb,与CD33结合形成的免疫复合物能迅速内化至细胞内,确保α 衰变发生在细胞内,使225Ac 成为治疗白血病和转移性疾病有效的放射性核素[26]。
2.3 纳米材料 纳米材料的研发是近年研究的重点,因纳米粒子具有高通透性和滞留效应,可透过肿瘤细胞的血管内皮间隙,携带α 放射性核素进入肿瘤组织,对肿瘤细胞产生内照射损伤[11,27]。有研究[9]报道用于递送α 放射性核素的材料类别主要包括自组装的囊泡结构(脂质体和聚合物体)、碳纳米管和无机纳米颗粒(层状纳米颗粒和沸石)等。纳米粒子不仅改变了其生物分布和药代动力学,同时也改变了α 衰变过程中子代核素的分布,纳米粒子或脂质体可以隔离α 衰变产生的子代核素,防止其释放到血液循环中[27]。Zhu 等[28]设计了一种非内化的纳米递送载体(脂质体),可在实体瘤的间质中大量释放,抑制肿瘤生长,提高了病人的总生存时间。纳米技术的临床应用将逐步成熟,为靶向治疗提供更广阔的前景。
3 α 粒子的临床前和临床试验研究
3.1 α 放射性核素衰变特点 目前临床前和临床试验中研究最多的发射α 粒子的核素包括225Ac、213Bi、211At、212Pb 和223Ra,其衰变特点详见表1。
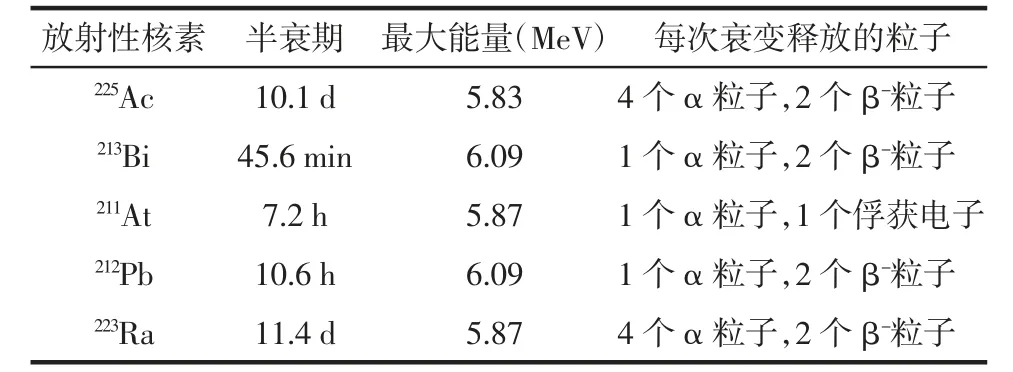
表1 常用α 放射性核素衰变特点
3.2 α 放射性核素的应用
3.2.1225Ac 和213Bi 目前已开展了多项临床试验研究225Ac 和213Bi 相关药物,225Ac/213Bi 可用放射化学方法从钍-229(229Th)中提取,也可由加速器生产获得。225Ac 在衰变过程中发射3 个α 粒子产生213Bi后继续衰变直至形成稳定的209Bi[20]。225Ac 的半衰期较长,有利于运输和进行临床操作,但其生产量不足且难以找到合适的配体[17]。在225Ac、213Bi 及其子代衰变过程中,产生的几种γ 射线可用于显像。213Bi是首个用于TAT 临床试验的核素,可以标记抗白血病抗体HuM195[29]。
目前225Ac 和213Bi 主要用于白血病、非霍奇金淋巴瘤、恶性黑色素瘤、膀胱癌、神经胶质瘤、神经内分泌肿瘤和前列腺癌等疾病的治疗。225Ac 和213Bi标记P 物质类似物用于治疗神经胶质瘤,213Bi-抗表皮生长因子受体(epidermal growth factor receptor,EGFR)mAb 用于膀胱癌的膀胱内治疗[20]。Kratochwil等[6]采用225Ac-PSMA-617 治疗mCRPC,结果显示TAT 的缓解率较高,明显改善了病人的生活质量,口干症是出现的唯一不良反应,未见相关的血液毒性反应。Sathekge 等[7]采用225Ac-PSMA-617 治疗了17 例晚期前列腺癌病人,治疗后有14 例的前列腺特异性抗原(prostate specific antigen,PSA)下降≥90%,15 例68Ga-PSMA PET/CT 显示病灶对示踪剂的摄取下降>50%,其中11 例病人在经过2 或3 个疗程的治疗后所有病灶均完全消退,未见严重不良反应,结果表明225Ac-PSMA-617 对前列腺癌治疗的效果显著。Ballal 等[30]对32 例177Lu-DOTATATE 治疗达到最高剂量或对177Lu-DOTATATE 治疗无效的神经内分泌肿瘤病人给予225Ac-DOTATATE 治疗,治疗后部分缓解率为62.5%,疾病控制率达到100%。在一项针对未经治疗的急性髓细胞性白血病老年病人的Ⅱ期试验中,共有40 例病人接受了225Ac-lintuzumab治疗,其中13 例治疗剂量为2.0 μCi/kg 体质量,27 例治疗剂量为1.5 μCi/kg 体质量,客观反应率分别为69%和22%,其中1 例病人完全缓解,5 例病人血小板计数恢复不完全,9 例病人血细胞计数恢复不完全[31]。
3.2.2211At211At 的半衰期为7.2 h,在回旋加速器中,通过209Bi(α,2n)211At 核反应生成211At,其获取方便且可以标记不同化合物,成为目前临床前研究使用最多的α 放射性核素,同时,211At 衰减中产生的X 射线可用于成像[2]。Sudo 等[32]采用211At 标记的间位砹代苄基胍(211At-labeled meta-astatobenzylguanidine,211At-MABG)治疗嗜铬细胞瘤荷瘤小鼠,结果表明211At-MABG 有很强的抗肿瘤作用和良好的耐受性,有望成为治疗恶性嗜铬细胞瘤的一种新选择。O’Steen等[33]应用211At-CD38 对多发性骨髓瘤(multiple myeloma,MM)小鼠模型进行治疗发现,相比MM 的高肿瘤负荷模型鼠,低肿瘤负荷模型鼠的肿瘤持续消退,小鼠可以长期存活,且无明显不良反应,表明211At-CD38 有可能清除低肿瘤负荷小鼠模型中的微小残留病灶及MM 细胞克隆群。
3.2.3212Pb212Pb 的半衰期为10.6 h,产生于228Th 衰变链或224Ra 发生器,212Pb 半衰期较长且衰变成212Bi(释放1 个β 粒子),212Bi 再衰变成稳定的208Pb(释放1 个β 粒子和1 个α 粒子)[34],因此212Pb 在体内可作为212Bi 的发生器,但子代212Bi 易游离到血液循环中而增加肾毒性[11]。目前已有大量的临床前研究应用212Pb-1,4,7,10-四(氨基甲酰基甲基)-1,4,7,10-四氮杂环十二烷(DOTAM)-TATE(C65H93N17O16S2)治疗神经内分泌肿瘤。Stallons 等[35]将212Pb-DOTAMTATE用于接种神经内分泌肿瘤的雌性无胸腺裸鼠动物实验研究,结果显示,31 周的研究结束后79%的裸鼠肿瘤消失。Meredith 等[36]对18 例腹膜内转移的恶性肿瘤病人(人表皮生长因子受体2 阳性且常规治疗无效)输注212Pb-S-2-(4-异硫氰酸根合苄基)-1,4,7,10-四氮杂-1,4,7,10-四(2-氨基甲酰基甲基)环十二烷(TCMC)-曲妥珠单抗治疗,结果显示治疗产生的毒性较小,在保证治疗安全的情况下剂量可高达27.4 MBq/m2。
3.2.4223Ra223Ra 的半衰期为11.4 d,由226Ra 发生器获得。223Ra 作为阳离子钙的类似物,对骨基质(即羟基磷灰石)具有天然的靶标能力。223Ra 的毒性较低,可迅速从血液清除,主要经肠道排出体外[37-38]。有研究者[4,13]将223Ra 用于921 例有症状的前列腺癌病人进行了223Ra 的Ⅲ期临床试验,结果显示病人的总生存期显著延长,骨骼相关事件发生的中位时间延迟了6 个月,药物安全性良好,病人疼痛得到改善。223RaCl2因其自身良好的特性,在mCRPC 的治疗中占有重要地位,故是FDA 和欧洲药品管理局批准的首个应用于临床的α 核素类药物[13]。Sraieb 等[39]研究了30 例行223RaCl2治疗的mCRPC 病人,多数病人接受了5 个疗程的治疗,最终17 例(56.7%)存活,中位生存期为26 个月(范围19.8~32.2 个月),病人的生活质量较治疗前明显提高。目前已有少量研究将223RaCl2用于治疗激素难治性乳腺癌的骨转移[40]。223Ra 目前主要用于骨转移,而不能用于其他肿瘤的治疗,其主要原因是找不到合适的螯合剂。
4 面临的困难和挑战
近年的临床前及临床研究均证实TAT 比β 粒子靶向治疗更有效,但TAT 仍只是潜在的有效治疗手段,在临床应用方面仍面临巨大挑战[41]。
4.1 体内靶向性 小分子配体、肽、抗体、抗体片段以及纳米材料等均可作为α 核素的载体,如何保证这些载体在体内高效到达靶肿瘤组织,滞留足够长时间的同时不降解、不脱靶,从而减少正常组织的辐射剂量仍然是核素靶向治疗需要考虑的问题。近年来α 核素标记的PSMA 小分子抑制剂、奥曲肽、利妥珠单抗等在临床试验中取得了良好的治疗效果,尤其是小分子PSMA-617 已在临床上进行了多项研究,有望得到批准用于临床治疗。
4.2 子代核素 α 核素通常有较长且复杂的衰变链,在运输过程中会衰变产生多个子代,部分子代核素的代谢方式不同于母体核素,脱靶进入人体循环系统会对机体造成不必要的伤害[42]。目前的解决方法之一是核素的内化,即递送核素的载体与靶细胞结合后内化至细胞中,使毒性子代与靶向载体分离后仍留在细胞中[11]。
4.3 生产和运输 α 粒子发射体主要通过反应堆和回旋加速器轰击产生,如何获得具有高比活度和高纯度的放射性核素是研究中的难点,能否安全经济地运输也是很多国家在研究中面临的关键问题。目前已提出225Ac、213Bi 的替代生产方法,通过回旋加速器加速质子轰击226Ra,由226Ra(p,2n)225Ac 核反应得到225Ac[43]。
4.4 治疗剂量 临床需要一个合理的剂量学标准来指导用药,在保证疗效的同时避免出现毒副作用。目前虽有少数关于药物安全剂量方面的研究,但在α 核素的用药剂量方面仍处于探索阶段[41]。
5 小结和展望
近年来放射性核素靶向诊疗一体化发展迅速。尽管β 放射性核素标记的奥曲肽及其类似物以及PSMA 小分子抑制剂逐步进入临床并取得了较好的疗效,但少部分肿瘤病人接受β 核素标记的靶向药物治疗后仍然不能得到较好的控制。由于α 放射性核素比β 核素更具优势,故近年备受临床关注。大量临床前和临床研究显示TAT 具有较好的应用前景,目前223RaCl2已经上市,也有不少药物进入临床试验阶段,TAT 将成为核医学靶向治疗的研究重点。今后需要通过加快发展α 核素最新的替代生产方法,寻找最合适的载体和螯合剂,完善临床前药物动力学及剂量学研究,并联合应用一些化疗、免疫治疗的药物,促进α 核素靶向治疗的发展。

