母鼠肥胖通过子鼠下丘脑SOCS3- JAK/STAT 通路影响采食量的研究
沈方方 祝峰 张大伟 张瑾 滕懿群
随着人们生活水平的提高,肥胖及其相关代谢综合征的发病率越来越高,严重威胁人类健康。越来越多的临床资料及动物实验研究表明,母亲肥胖和孕期营养过剩对胎儿及全生命周期有着深远的影响,是儿童肥胖及成年后慢性代谢疾病高发的重要原因之一[1-2],但其机制尚未清晰。细胞因子信号转导抑制因子3(suppressor of eytokine signaling 3,SOCS3)是瘦素(Leptin)信号转导的负反馈抑制因子,对调节同代的Leptin 抵抗和能量稳态非常重要[3],被认为是代谢性疾病的关键靶点[4],但SOCS3对子代成年期代谢性疾病影响的相关研究报道较少。本研究通过高脂饲料喂养构建肥胖母鼠模型,观察其子鼠摄食、体重的变化,成年后下丘脑SOCS3 及Janus 激酶(JAK)-信号转导子和转录激活物(STAT)通路中关键分子的变化,探讨母鼠高脂饲料喂养对子鼠下丘脑SOCS3- JAK/STAT 通路的影响,为预防肥胖等慢性代谢综合征的发生提供新思路。
1 材料和方法
1.1 实验动物 20 只4 周龄SPF 级C57BL/6J 雌性小鼠均购自苏州大学,喂养、繁殖于嘉兴学院动物房。饲养条件为(24±2)℃,相对湿度(50±10)%,12 h/12 h 明暗循环照明。本动物实验遵照《中华人民共和国实验动物管理条例》的相关规定,并已获得嘉兴学院动物实验伦理委员会审查批准。
1.2 主要试剂及仪器 高脂饲料购自江苏南通特洛菲公司(批号:TP23300,规格:1 000 g/包);普通饲料购自江苏南京协同生物公司(批号:1010083,规格:2 000 g/包);Leptin 检测试剂盒购自南京建成生物公司;SOCS3、Leptin 受体(LEPR)、刺鼠相关蛋白(AGRP)及阿黑皮素原(POMC)等引物均由中国通用生物技术公司合成;Trizol、反转录试剂盒均购自日本Takara 公司;磷酸化的JAK2(P-JAK2)、JAK2 抗体均购自美国Cell Signaling公司;磷酸化的STAT3(P-STAT3)、STAT3 抗体均购自美国Santa Cruz Biotechnology 公司;SOCS3 抗体购自中国ABclonal 公司;辣根过氧化物酶(HRP)二抗及微管蛋白(tubulin)抗体均购自中国Tianjin Sungene Biotech公司。仪器多功能酶标仪(SPARK)购自瑞士TECAN 公司;普通PCR 仪购自德国Eppendorf 公司;Thermo Fisher-QS3 实时定量PCR 仪购自美国Thermo 公司;Bio-Rad 凝胶成像仪购自美国Bio-Rad 公司。
1.3 实验动物分组和建模 将20 只母鼠采用随机数字表法分为肥胖母鼠(obese mother,OM)组及非肥胖母鼠(non-obese mother,NM)组两组,每组10 只,OM 组以高脂饲料喂养,NM 组以普通饲料喂养,均自由采食、饮水。4 周后OM 组平均体重为(24.16±0.81)g,NM 组为(20.13±0.97)g,OM 组体重高于NM 组,差异有统计学意义(P<0.05),达到建模成功标准[5]。两组母鼠均分别与全同胞健康雄鼠交配,1 雄2 雌同笼1 周后,取出雌鼠单笼饲养至产子。两组母鼠在孕期继续原饲养方案,哺乳期则均以普通饲料喂养至实验结束。每只母鼠所产子鼠随机选取1 只组成OM 组子鼠(obese mother-descent,OM-D)及NM 组子鼠(non-obese mother-descent,NM-D),每组10 只,所有子鼠出生4 周后均停止哺乳,采用高脂饲料喂养,自由采食、饮水,饲养至17 周龄。两组子鼠从4 周后开始每周称体重及每周一、三、五饲料的消耗量,持续至17 周末,计算平均日采食量。两组母鼠产子后4 周末予麻醉脱颈椎处死。OM-D 及NM-D 组子鼠全部于17 周末予麻醉,取眼球血于4 ℃保存(其中两组子鼠各8 只测定其Leptin 水平);脱颈椎处死后取下丘脑组织(其中两组子鼠各5 只测定其mRNA 和蛋白表达水平),放入液氮速冻后,-80 °C 冰箱保存。
1.4 检测方法
1.4.1 血清Leptin 水平测定 采用ELISA 法。取子鼠眼球血1 ml,收集的全血于4 ℃隔夜放置,3 500 r/min,10 min,取上清液。最后分别按照试剂盒说明书,在酶标仪上对血清Leptin 水平进行测定。
1.4.2 SOCS3、LEPR、AGRP 及POMC mRNA 表达水平检测 采用实时定量PCR 法。采用Trizol 从子鼠下丘脑组织中提取总RNA,然后根据反转录试剂盒说明书操作,并在普通PCR 仪上反转录获得cDNA。在Thermo Fisher-QS3 实时定量PCR 仪上检测SOCS3、LEPR、AGRP 和POMC mRNA 表达水平。以肌动蛋白(β-Actin)作为内对照。实验运行方案为:变性程序(95 ℃10 min),扩增定量程序重复40 次(95 ℃15 s,60 ℃10 s,72 ℃15 s,单次荧光测量),熔化曲线程序(60~95 ℃,升温速率0.1 °C/s,连续荧光测量)。使用2-ΔΔCt方法测定相对mRNA 的表达水平。本研究使用的引物序列见表1。
1.4.3 SOCS3、P-JAK2、JAK2、P-STAT3、STAT3 蛋白表达水平检测 采用Western blot 法。采用BCA 蛋白质测定试剂盒测定子鼠下丘脑组织中总蛋白浓度,将各样本的蛋白浓度调整一致,再与1/4 体积的蛋白上样缓冲液混合后煮沸,变性;通过10% SDS-聚丙烯酰胺凝胶电泳分离总蛋白,转膜;在室温下用5%脱脂奶粉封闭膜2 h,稀释SOCS3、P-JAK2、JAK2、P-STAT3、STAT3 及tubulin 抗体(1∶500), 于4 ℃过夜孵育;第2 天洗膜,用5%脱脂奶粉稀释HRP 标记的二抗(1∶1 000)于摇床上孵育90 min,洗膜后,加发光液,β-tubulin 作为内参,用Bio-Rad 成像系统曝光,目标蛋白分别与内参灰度值相比为各自蛋白表达水平。

表1 本研究所用的引物序列
1.5 统计学处理 采用SPSS 22.0 统计软件,采用Graph Pad Prism 8 进行制图。计量资料以表示,组间比较采用两独立样本t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组子鼠体重、采食量比较 两组子鼠4 周龄时体重比较差异无统计学意义(P >0.05),6、17 周龄时OM-D 组体重均明显高于NM-D 组,差异均有统计学意义(均P<0.05)。OM-D 组采食量高于NM-D 组,差异有统计学意义(P<0.05),见表2。
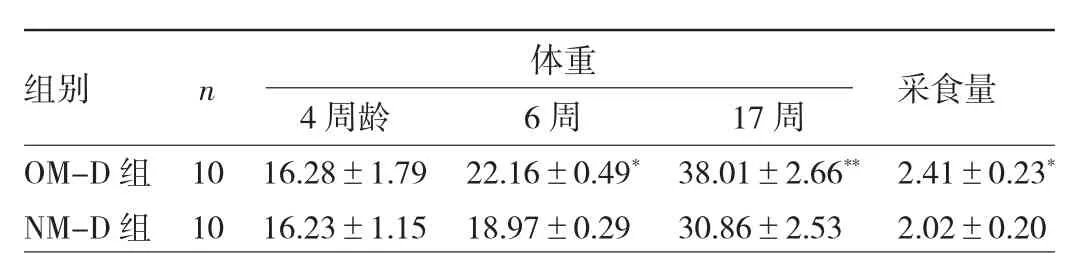
表2 两组子鼠体重、采食量比较(g)
2.2 两组子鼠血清Leptin 水平比较 OM-D 组Leptin水平显著高于NM-D 组,差异有统计学意义(P<0.05),见表3。

表3 两组子鼠血清Leptin 水平比较(mmol/L)
2.3 两组子鼠SOCS3、LEPR、AGRP 及POMC mRNA 表达水平比较 OM-D 组SOCS3、AGRP、POMC mRNA 表达水平与NM-D 组比较差异均有统计学意义(均P<0.05),而LEPR mRNA 表达水平比较差异无统计学意义(P >0.05)。见表4。
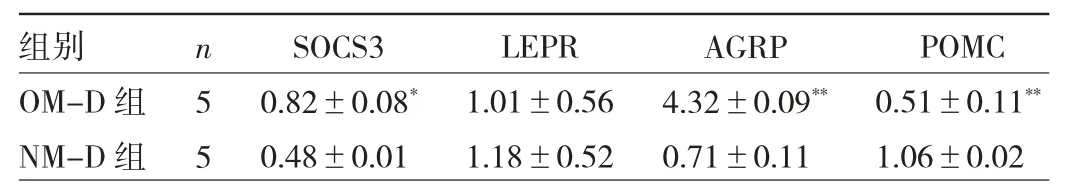
表4 两组子鼠下丘脑SOCS3、LEPR、AGRP 及POMC mRNA表达水平比较
2.4 两组子鼠SOCS3、P-JAK2、JAK2、P-STAT3、STAT3蛋白表达水平比较 进一步通过Western blot 法发现,OM-D 组SOCS3 蛋白表达水平显著高于NM-D 组,PJAK2/JAK2 较NM-D 组明显降低,差异均有统计学意义(均P<0.05);OM-D 组P-STAT3/STAT3 较NM-D 组也有下降趋势,但差异无统计学意义(P >0.05),见图1、表5。
3 讨论

图1 两组子鼠SOCS3、P-JAK2、JAK2、P-STAT3、STAT3 蛋白表达的电泳图(SOCS3 为细胞因子信号转导抑制因子3;P-JAK2 为磷酸化的Janus 激酶2;JAK2 为Janus 激酶2;P-STAT3 为磷酸化的信号转导子和转录激活物3;STAT3 为信号转导子和转录激活物3)

表5 两组子鼠SOCS3 蛋白表达水平、P-JAK2/JAK2、P-STAT3/STAT3 比较
目前大量研究已证实,当母代进行高脂饮食产生肥胖表型时,其子代同样会出现胰岛素及Leptin 抵抗[6-9],有动物实验显示,其机制可能与某些炎症因子如IL-1β的活性增强[10]、糖代谢调节因子表达异常[11]等有关。Yang 等[12]报道了母鼠肥胖会导致子代的锌指蛋白423(Zfp-423)启动子区域的DNA 甲基化、组蛋白的甲基化水平降低,进而导致Zfp-423 表达水平升高,诱发子代肥胖。SOCS3 是参与胰岛素及Leptin 抵抗的重要因子,抑制SOCS3 活性及其表达的药理策略可能是未来治疗肥胖症的方法之一[13-14],因此SOCS3 在子代中的作用成为研究热点。有研究发现,携带SOCS3 缺失基因的母鼠所生的或由具有相同突变的母鼠抚养的雄性子鼠,其体重减轻、肥胖改善,并且脑质量降低[15]。张旭等[16]认为检测孕前BMI 和孕期增重对新生儿代谢特征的指标发现,孕前或孕期母亲营养过度会导致子代淋巴细胞中SOCS3 mRNA 表达水平升高,而Leptin 诱导的P-STAT3 mRNAs 表达水平降低。
下丘脑是哺乳动物调控食欲的基本部位,其内存在食欲调节神经细胞群,其中弓状核是中枢与外周循环食欲因子交换信息的重要通路。弓状核主要合成下丘脑组织神经肽Y(neuropeptide,NPY)、AGRP、POMC 等。其中NPY 及AGRP 为促食欲调节因子,而POMC 为抑制食欲因子[17]。本研究结果中,在相同饲料喂养条件下,高脂饲料喂养母鼠的子鼠较正常饲料喂养母鼠的子鼠,下丘脑的摄食基因发生明显变化,促食基因AGRP mRNA表达水平增加,而抑食基因POMC mRNA 表达水平下降,这与OM-D 组采食量增加的结果是相吻合的。说明母代高脂饲料喂养可以影响子代的摄食基因的表达,从而影响子代的食欲及体重。
AGRP 和POMC 的释放受神经内分泌系统调节,其中Leptin 是重要的一个因子。Leptin 与LEPR 的结合可激活LEPR,减少食物摄入,同时增加能量消耗。但是大多数肥胖者均存在Leptin 抵抗[18]。本研究也发现高脂饲料喂养母鼠的子代LEPR mRNA 表达水平无明显变化,但其Leptin 水平明显增加,说明子代存在Leptin 抵抗。
Leptin 发挥抑制食欲的作用是通过与下丘脑的LEPR 结合,通过JAK2 和STAT3 的磷酸化,激活JAK/STAT 通路。在肥胖个体中,SOCS3 是JAK/STAT 通路的负反馈抑制因子,对抑制Leptin 信号起着主要作用[19]。研究表明,下丘脑中SOCS3 mRNA 表达水平降低,小鼠空腹胰岛素及葡萄糖水平较低[20]。
本研究证实,子鼠在相同饲料喂养条件下,17 周末时OM-D 组较NM-D 组下丘脑中SOCS3 mRNA 表达水平明显增加;进一步通过Western blot 分析发现,OMD 组下丘脑中SOCS3 蛋白表达水平增加,STAT3 蛋白表达水平明显减少,且P-STAT3 蛋白表达水平和PJAK2 蛋白表达水平也明显降低。从而推断,母鼠营养过剩会导致子代成年期下丘脑SOCS3 蛋白表达水平升高,进而抑制了JAK/STAT 信号通路,产生Leptin 抵抗,导致子鼠促食基因AGRP mRNA 表达水平增加,而抑食基因POMC mRNA 表达水平下降,采食量增加,进而成年期发生肥胖等慢性代谢性疾病。
综上所述,通过构建营养过剩的小鼠模型,发现子鼠成年期下丘脑中SOCS3 蛋白表达水平增加,抑制了Leptin-JAK/STAT 信号通路,下丘脑中的抑食激素POMC mRNA 表达水平降低,促食激素AGRP mRNA 表达水平增加,从而导致子鼠采食量增加及成年期肥胖的发生,这可能是母代营养过剩导致子代发生肥胖的机制之一。成年期的肥胖、糖尿病等慢性代谢性疾病病因复杂,如何早期干预一直备受关注。本研究对孕母高脂饮食、子代肥胖和SOCS3 三者之间的关系进行了探讨,为预防孕母肥胖、胎儿营养过剩和慢性代谢疾病的发生提供了理论依据和方向。

