长链非编码RNA FGD5-AS1通过miR-542-3p/GTPBP4对肝癌细胞放射敏感性的影响
陈新, 章诺贝
(1. 南昌大学 第二附属医院 核医学科,江西 南昌 330000; 2. 南昌大学 第二附属医院 消化内科,江西 南昌 330000)
原发性肝癌(hepatocellular carcinoma,HCC),是世界上第6大最常见的恶性肿瘤,其死亡率居全球癌症死亡率第3位[1-2].目前,放疗是治疗HCC常用的方法之一.然而,放射抗性的发生和发展已经成为治疗肝癌的主要临床障碍[3].因此,提高肝癌细胞的对放射的敏感性是提升放疗效果的有效途径.
多项研究表明,长链非编码RNA(long non-coding RNA,lncRNA)在调控肿瘤细胞的对放射的敏感性中起着至关重要的作用[4-5].lncRNA SNHG1在胶质瘤组织中的表达水平明显高于正常组织,沉默SNHG18可以通过抑制信号素5A,提高胶质瘤细胞的放射敏感性[6].lncRNA OIP5-AS1在耐辐射的结肠癌细胞中表达下调,沉默OIP5-AS1通过调控miR-369-3p/DYRK1A的表达以增强结肠癌细胞LoVo细胞活性,抑制放射诱导的LoVo细胞凋亡[7].研究发现,lncRNA FGD5-ASl可促进结直肠癌细胞的增殖、迁移及侵袭[8],但其在肿瘤放射敏感性中的作用至今仍不清楚.
miRNA是一类长度约为22个核苷酸的单链非编码RNA,可在转录水平及转录后水平上调节基因的表达,从而参与多种生物学过程的调控[9].研究发现,miRNA在调节癌细胞的放射敏感性中起关键作用[10].沉默miR-21可以通过抑制PI3K/Akt信号通路,增强胶质瘤细胞放射敏感性[11].沉默miR-214可以通过上调p38MAPK的表达,以增强非小细胞肺癌细胞的放射敏感性[12].过表达miR-133a可通过抑制表皮生长因子受体的表达从而增强食管癌细胞的放射敏感性[13].研究发现,miR-542-3p可抑制卵巢癌细胞的增殖与侵袭,但在肿瘤放射敏感性中的作用至今仍不清楚[14].本研究探究了lncRNA FGD5-AS1、miR-542-3p及其下游靶基因在HCC组织和细胞中的表达以及在调控HCC放射敏感性中的作用机制.
1 材料与方法
1.1 研究对象
本研究经南昌大学第二附属医院伦理委员会批准通过,并获得所有患者的知情同意书.21对HCC组织和癌旁组织取自南昌大学第二附属医院的肝癌手术患者.所有患者经组织病理学确诊为肝癌,且术前未接受任何辅助治疗.样品储存在-80 ℃冰箱中.
1.2 细胞培养及辐射
人肝细胞(LO2)和肝癌细胞系(Huh7、SMMC-7721、PLC5和Bel-7402)来自中国科学院上海细胞库.LO2、SMMC-7721和Bel-7402细胞在含体积分数10%胎牛血清的RPMI-1640培养基(美国Solarbio公司)中培养.Huh7和PLC5细胞在含体积分数10%胎牛血清的DMEM培养基(美国Solarbio公司)中培养.将细胞置于体积分数5%的CO2、37 ℃条件下培养.用X射线发生器(剂量率2 Gy/min)对细胞照射,Huh7和PLC5细胞给予0、2、4、6或8 Gy辐射剂量照射.
1.3 细胞转染
上海吉玛公司构建质粒sh-GTPBP4、si-FGD5-AS1、miR-542-3p、anta-miR-542-3p及相应对照质粒.使用PCR扩增FGD5-AS1的全长序列并克隆到pcDNA-3.1载体中,构建pcDNA-FGD5-AS1质粒用于过表达FGD5-AS1.采用Lipofectamine 2000(Invitrogen公司)将sh-GTPBP4、si-FGD5-AS1、miR-542-3p、anta-miR-542-3p、sh-NC、si-NC、miR-NC、anta-NC、pcDNA-FGD5-AS1和pcDNA质粒分别转染至Huh7和PLC5细胞中,转染后48 h收集细胞进行下一步实验.本研究中所用的shRNA GTPBP4,siRNA FGD5-AS1和anta-miR-542-3p的序列见表1.
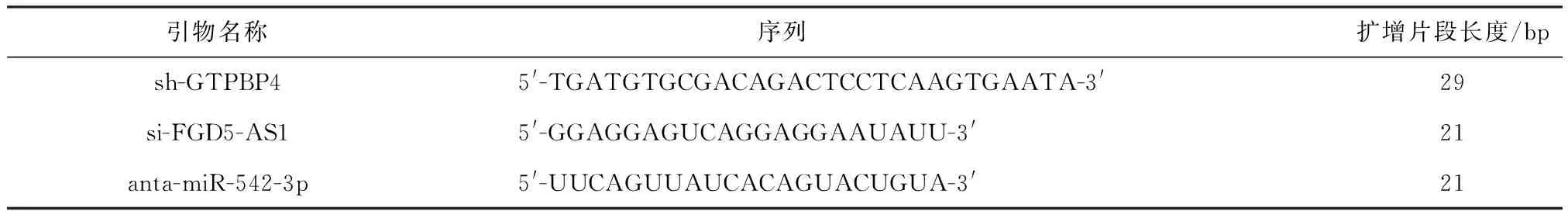
表1 实时定量聚合酶链反应(qRT-PCR)引物序列Table 1 Primer sequence of qRT-PCR
1.4 实时定量聚合酶链反应(qRT-PCR)
根据试剂说明书,使用TRIzol试剂(美国Invitrogen公司)从组织和细胞中分离总RNA.使用PrimeScriptTMRT试剂盒(美国Takara公司)将总RNA反转录合成cDNA.在序列检测系统(ABI Prism 7700;美国ABI公司)上使用PrimeScriptTMRT reagent kit(日本Takara公司)检测基因的表达水平.通过TaqMan miRNA assay试剂盒(美国Thermo Fisher Scientific公司)分析miR-542-3p在组织和细胞中的表达水平.使用β-actin作为FGD5-AS1和GTPBP4的内参基因,U6作为miR-542-3p的内参基因,采用2-ΔΔCt法检测FGD5-AS1、miR-542-3p和GTPBP4的相对表达水平.本研究所用的引物序列见表2.
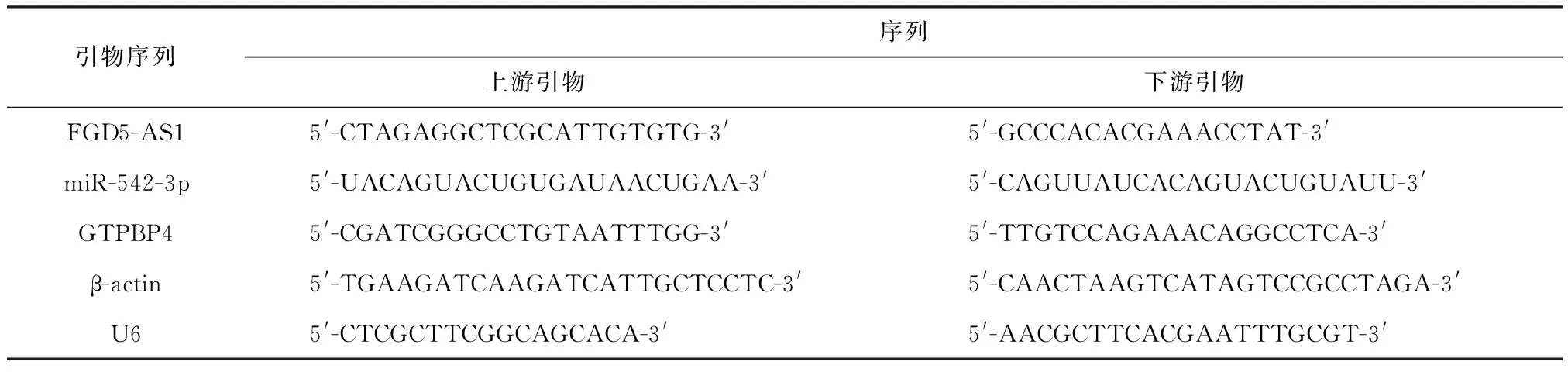
表2 RT-PCR引物序列Table 2 Primer sequence of RT-PCR
1.5 蛋白质印迹分析
使用含有蛋白抑制剂的RIPA buffer(美国Solarbio公司)提取Huh7和PLC5细胞的总蛋白.使用Enhanced BCA Protein Assay Kit(上海Beyotime公司)检测蛋白表达.取30 μg蛋白样品以质量分数14% SDS聚丙烯酰胺凝胶电泳分离,分离的蛋白转移到聚偏氟乙烯膜上.使用质量分数5%脱脂奶粉封闭后,将聚偏氟乙烯膜浸泡在一抗GTPBP4 (V抗体∶V抗体稀释液=1∶1 000,英国Abcam公司)和抗β-actin(V抗体∶V抗体稀释液=1∶1 000,美国Boster公司)稀释液二抗稀释液(V抗体∶V抗体稀释液=1∶2 000,美国Boster公司)中,室温孵育1 h;洗膜液洗膜后使用BeyoECL Plus(上海Beyotime公司)试剂盒显色,以β-actin作为内参基因,实验重复3次,ImageJ(美国NIH Image公司)软件分析蛋白条带灰度值.
1.6 克隆形成试验
转染后,分别给予Huh7和PLC5细胞0、2、4、6和8 Gy的辐射照射.细胞培养5 d后,用甲醇固定15 min,并在室温条件下使用结晶紫(美国Solarbio公司)染色20 min,在倒置显微镜下观察细胞克隆数(>50个细胞/克隆),放射细胞存活曲线计算如下:存活分数=处理组集落形成率/对照组集落形成率.
1.7 流式细胞仪分析
Annexin V-FITC凋亡检测试剂盒(美国Sigma-Aldrich公司)分析Huh7和PLC5细胞的凋亡.转染后,给予Huh7和PLC5细胞0、6 Gy剂量照射,细胞离心后悬浮于1 × Annexin V Binding buffer(500 μL).Annexin V-FITC(5 μL)在黑暗条件下处理细胞5 min.流式细胞仪分析细胞的凋亡情况.
1.8 荧光素酶报告试验
扩增野生型和突变型的GTPBP4 3′UTR区的碱基序列(包含miR-542-3p位点),并将其分别克隆到荧光素酶报告载体(pmiR-RB-Report)中构建pmiR-GTPBP4-WT和pmiR-GTPBP4-MUT载体.同样将野生型和突变型的FGD5-AS1 3′UTR区的碱基序列克隆到荧光素酶报告载体(pmiR-RB-Report)中构建pmiR-FGD5-AS1-WT和pmiR-FGD5-AS1-MUT载体.将荧光素酶报告载体和miR-542-3p、anta-miR-542-3p、miR-NC和anta-NC共转染人Huh7细胞.转染48 h后,用荧光素酶测定试剂盒(美国Pharmingen公司)检测细胞内荧光素酶的相对活性.
1.9 统计学分析
采用SPSS 20.0软件进行统计分析.结果以均值±标准差表示,用student’sttest分析两组组间的差异.多组组间差异采用单因素方差分析以及Tukey’s post hoc进行检验.以P<0.05为差异有统计学意义.
2 结果
2.1 FGD5-AS1、miR-542-3p和GTPBP4在HCC组织和细胞中的表达
FGD5-AS1和GTPBP4的mRNA表达水平在肝癌组织中升高(P<0.01,图1A、1C).相反,miR-542-3p在HCC组织中的表达水平明显低于癌旁组织(P<0.01,图1B).此外,与人肝细胞(LO2)相比,FGD5-AS1和GTPBP4的mRNA表达水平在HCC细胞系显著升高,miR-542-3p表达水平显著降低(图1D-1F).由此可见,在HCC组织和细胞中,FGD5-AS1和GTPBP4表达上调,miR-542-3p表达下调.
2.2 下调GTPBP4可增强HCC细胞对放射的敏感性
为探讨GTPBP4在HCC细胞放射敏感性中的作用,通过向HCC细胞(Huh7和PLC5)中转染sh-GTPBP4、sh-NC降低HCC细胞中GTPBP4的表达水平.qRT-PCR和Western blot检测分析发现,与sh-NC组相比,sh-GTPBP4组中GTPBP4的mRNA和蛋白水平明显降低(图2A-2D).采用克隆形成实验和流式细胞仪分析了沉默GTPBP4对HCC细胞系放射敏感性的影响.用sh-GTPBP4或sh-NC转染Huh7和PLC5细胞,分别给予0、2、4、6和8Gy的剂量照射.结果表明,沉默GTPBP4对Huh7和PLC5细胞的克隆形成能力具有放射剂量依赖性的抑制作用(图2E、2F).在没有或存在放射线照射(6Gy)的情况下,敲除GTPBP4促进了Huh7和PLC5细胞的凋亡(图2G、2H).这些结果表明GTPBP4的下调可以增强HCC细胞的放射敏感性.
1)与癌旁组织比较,P<0.01;2)与人肝细胞比较,P<0.05;3)与人肝细胞比较,P<0.01.1)Compared with normal tissues,P<0.01;2)Compared with human hepatocyte cells,P<0.05;3)Compared with human hepatocyte cells,P<0.01qRT-PCR分析HCC组织中(A)FGD5-AS1、(B)miR-542-3p和(C)GTPBP4的表达水平.qRT-PCR分析HCC细胞(Huh7、SMMC-7721、PLC5和Bel-7402)中(D)FGD5-AS1、(E)miR-542-3p和(F)GTPBP4的表达水平qRT-PCR analysis of (A)FGD5-AS1, (B)miR-542-3p, and (C)GTPBP4 mRNA expression in HCC tissues. qRT-PCR analysis of (D) FGD5-AS1, (E)miR-542-3p, and (F)GTPBP4 mRNA expression in HCC cell lines (Huh7, SMMC-7721, PLC5, and Bel-7402).图1 FGD5-AS1、miR-542-3p和GTPBP4在HCC组织和细胞中的表达变化Fig.1 Expression of FGD5-AS1, miR-542-3p, and GTPBP4 in HCC tissues and cell lines
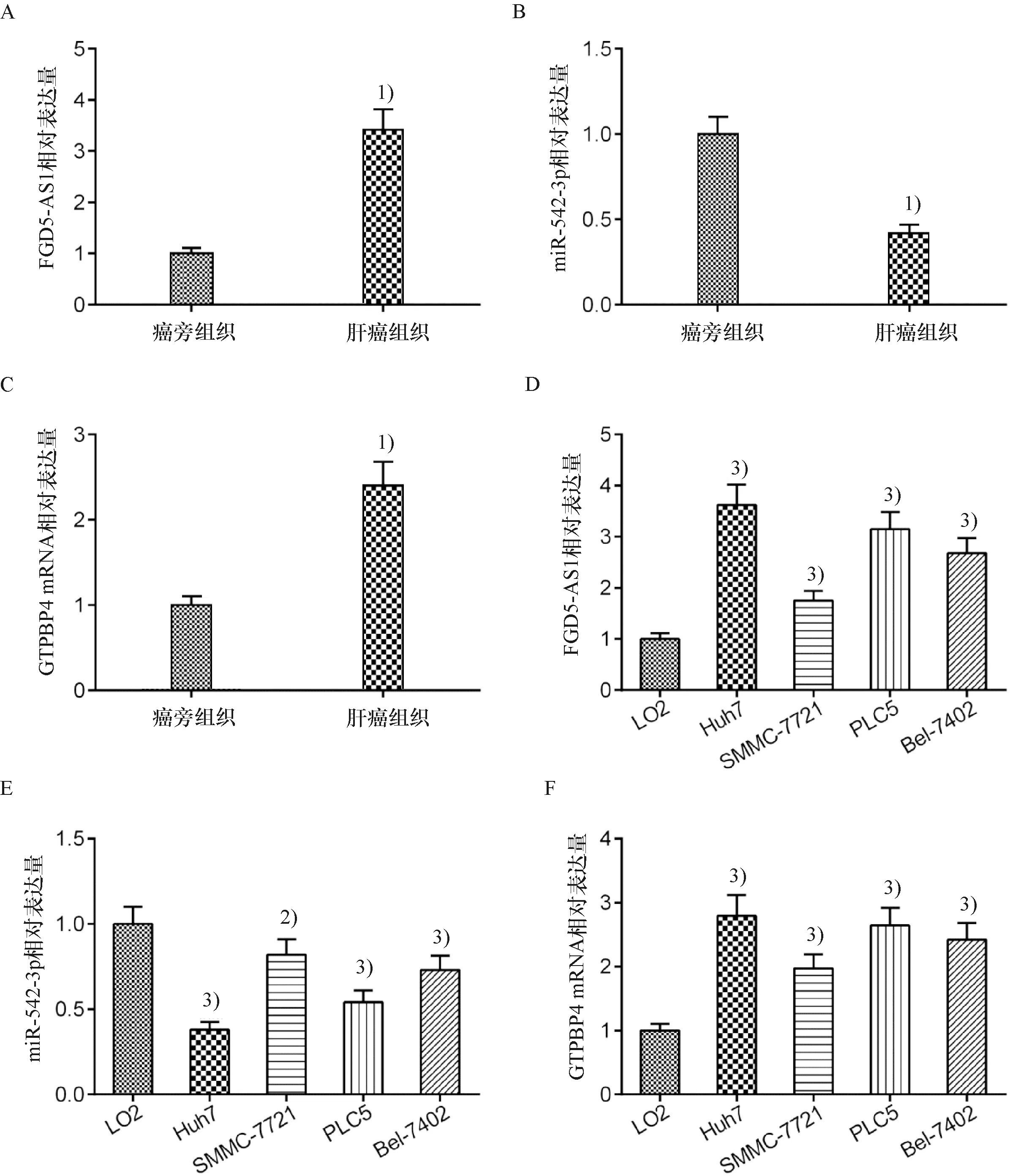
2.3 下调FGD5-AS1可提高HCC细胞对放射的敏感性
与sh-NC组相比,sh-FGD5-AS1组Huh7和PLC5细胞中FGD5-AS1的表达显著降低(图3A、3B).转染后,给予Huh7和PLC5细胞0、2、4、6和8 Gy的剂量照射.克隆形成试验结果表明,射线照射后,FGD5-AS1下调可显著降低Huh7和PLC5细胞的克隆形成能力(图3C、3D).在没有或存在放射线照射(6 Gy)的情况下,FGD5-AS1的下调可以促进Huh7和PLC5细胞的凋亡(图3E、3F).由此可见,FGD5-AS1下调可增强HCC细胞对放射的敏感性.
1)与sh-NC组比较,P<0.01.1)Compared with sh-NC,P<0.01.A-D:GTPBP4的mRNA和蛋白水平.E、F: Huh7和PLC5细胞的克隆形成能力.G、H:sh-GTPBP4转染后的Huh7和PLC5细胞的凋亡情况.A-D:the mRNA and protein levels of GTPBP4. E、F:The effect of GTPBP4 on the sensitivity of HCC cell lines. G、H: The effect of GTPBP4 on the sensitivity of HCC cell lines.图2 下调GTPBP4对HCC细胞放射敏感性的影响Fig.2 The effect of down-regulation of GTPBP4 on the radiosensitivity of HCC cells
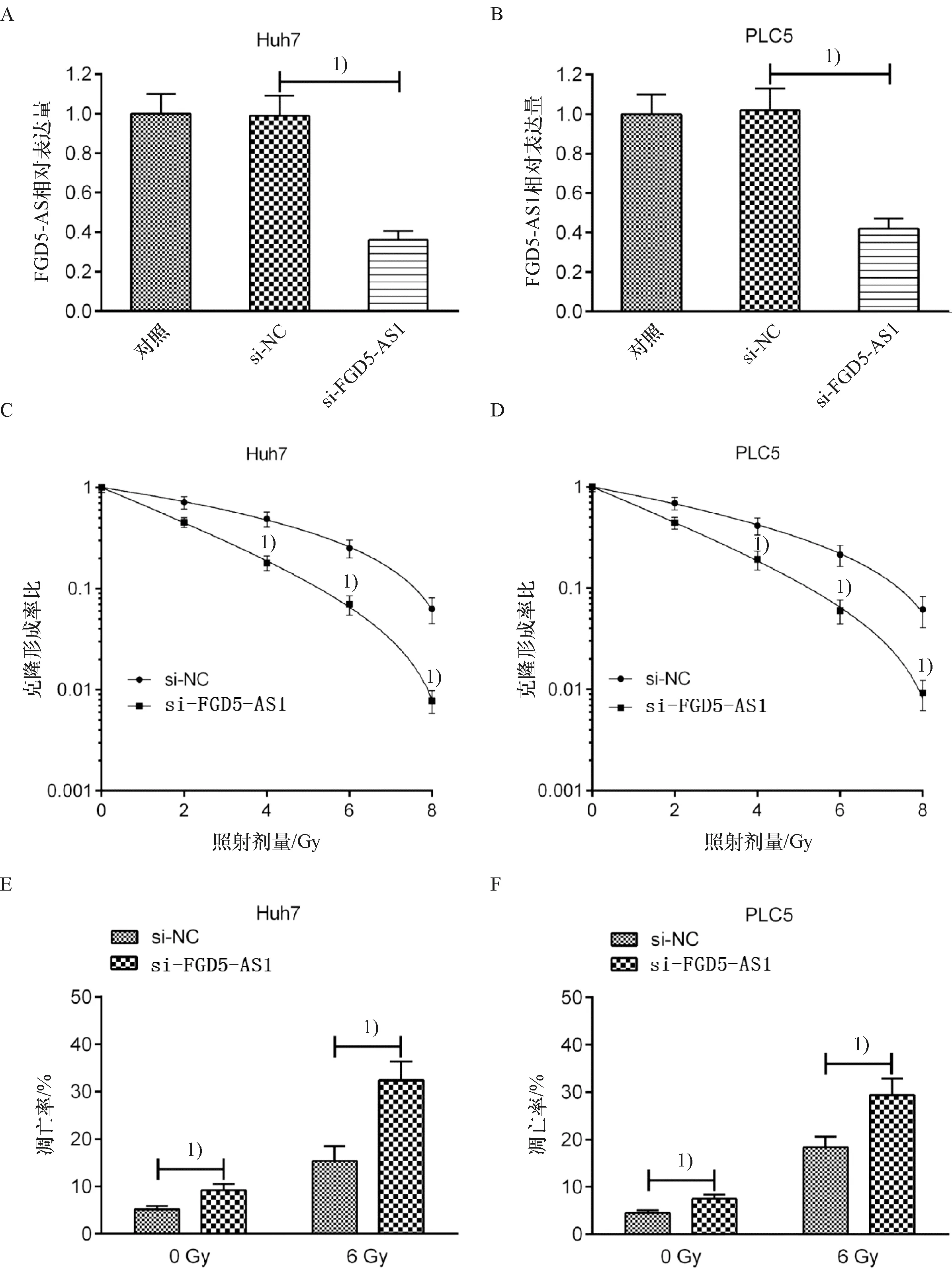
1)与sh-NC组比较,P<0.011)Compared with sh-NC,P<0.01.A、B:用sh-FGD5-AS1转染Huh7和PLC5细胞后FGD5-AS1的表达水平;C、D:Huh7和PLC5细胞的克隆形成能力;E、F:Huh7和PLC5细胞sh-FGD5-AS1转染后的凋亡情况A、B: Huh7 and PLC5 cells were transfected with sh- FGD5-AS1, and the expression of FGD5-AS1;C、D: The survival fractions of Huh7 and PLC5 cells;E、F:The apoptosis of Huh7 and PLC5 cells which were transfected with sh-FGD5-AS1图3 下调FGD5-AS1对HCC细胞放射敏感性的影响Fig.3 The effect of FGD5-AS1 down-regulation on the radiosensitivity of HCC cells
2.4 miR-542-3p靶向GTPBP4并抑制HCC GTPBP4的表达
使用Starbase v 2.0(http://starbase.sysu.edu.cn/)分析预测GTPBP4的3′UTR包含一个miR-542-3p结合位点(图4A).为了证实GTPBP4是否是miR-542-3p的靶基因,将GTPBP4-WT-3′UTR质粒、GTPBP4-MUT-3″UTR质粒与miR-542-3p、miR-NC共转染到Huh7细胞中.转染48 h后,miR-542-3p可显著降低pmiR-GTPBP4-WT载体的荧光活性.然而,含有pmiR-GTPBP4-MUT载体的荧光活性不受miR-542-3p的影响(图4B).此外,与miR-NC组相比,miR-542-3p上调可显著降低GTPBP4的mRNA和蛋白水平,而转染anta-miR-542-3p则可显著上调GTPBP4的mRNA和蛋白水平(图4C、4D).这些结果表明miR-542-3p靶向GTPBP4,并抑制GTPBP4在HCC细胞中的表达.
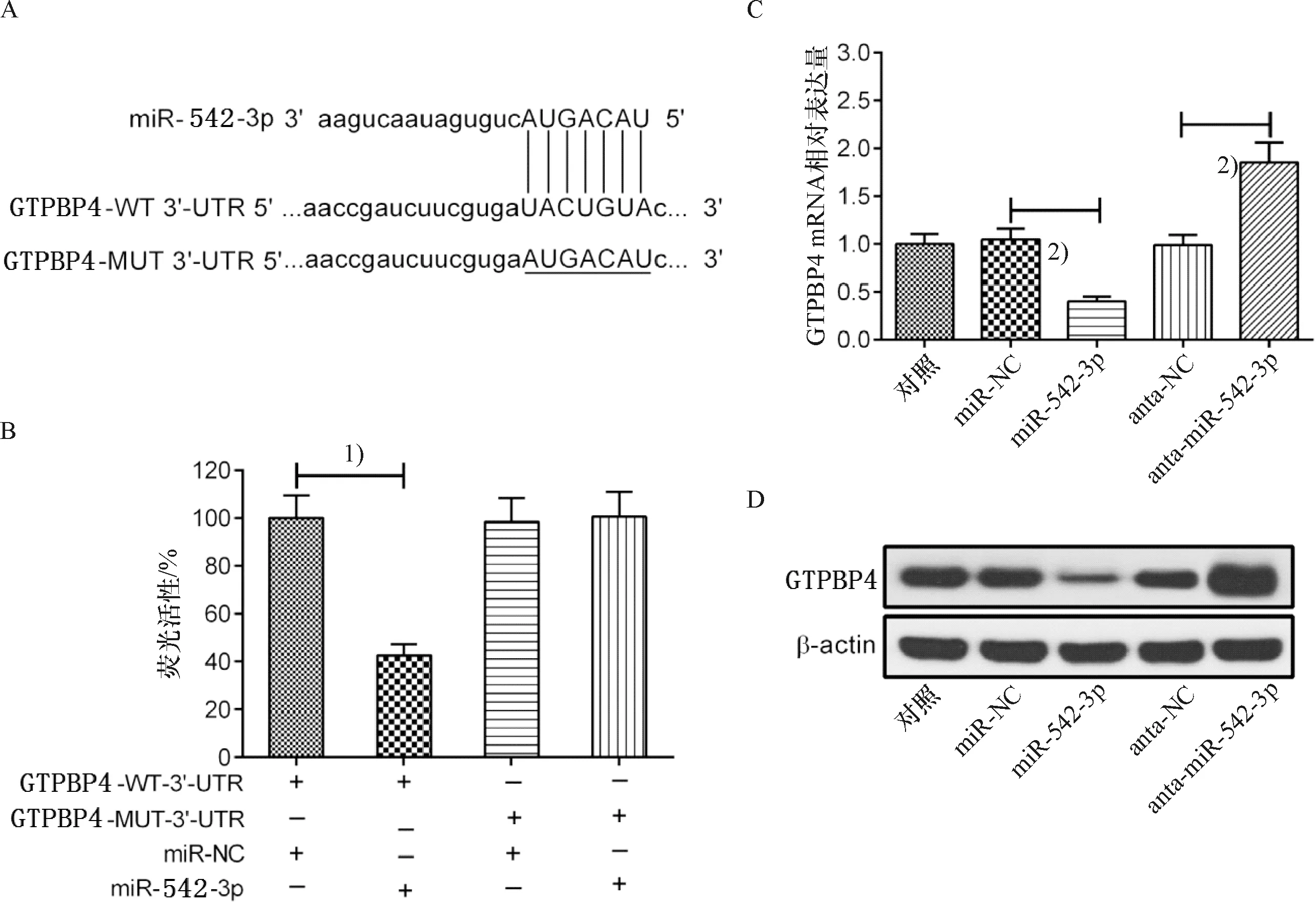
A:在GTPBP4 3′-UTR内存在miR-542-3p的位点.B:测定细胞的荧光素酶活性,1)与pmiR-GTPBP4-MUT质粒相比,P<0.01. C、D:qRT-PCR和Western blot检测GTPBP4的mRNA和蛋白水平,2)与anta-miR-542-3p、anta-NC相比,P<0.01.A: The predicted miR-542-3p binding site within the GTPBP4 3′-UTR is shown. B: the luciferase activity was determined. Compared with pmiR-GTPBP4-MUT,P<0.01. C、D: the mRNA and protein levels of GTPBP4 were evaluated by qRT-PCR and Western blot. 2)Compared with anta- miR-542-3p and anta-NC,P<0.01.图4 miR-542-3p直接靶向GTPBP4对HCC细胞中GTPBP4表达的影响Fig.4 The effect of miR-542-3p directly targeting GTPBP4 on the expression of GTPBP4 in HCC cells
2.5 FGD5-AS1作为miR-542-3p的“分子海绵”竞争性促进GTPBP4在HCC中的表达
使用Starbase v2.0(http://starbase.sysu.edu.cn/)预测FGD5-AS1基因序列上存在miR-542-3p的结合位点(图5A).转染FGD5-AS1的Huh7细胞中FGD5-AS1的表达水平明显高于转染pcDNA的Huh7细胞中FGD5-AS1的表达水平(图5B).将pmiR-FGD5-AS1-WT、pmiR-FGD5-AS1-MUT与miR-542-3p、miR-NC、anta-miR-542-3p、anta-NC共转染Huh7细胞.Huh7细胞的FGD5-AS1-WT的荧光素酶活性在转染miR-542-3p后减弱,而在转染anta-miR-542-3p后增强,但miR-542-3p、miR-NC、anta-miR-542-3p、anta-NC对pmiR-FGD5-AS1-MUT荧光素酶活性无明显影响(图5C).使用pcDNA-FGD5-AS1-WT、pcDNA-FGD5-AS1-MUT、pcDNA、si-FGD5-AS1或si-NC转染Huh7细胞,通过qRT-PCR检测miR-542-3p的表达变化.结果表明野生型FGD5-AS1的过表达可显著降低miR-542-3p的表达水平,而野生型FGD5-AS1的表达沉默可显著升高miR-542-3p的表达水平(图5D).野生型FGD5-AS1上调可促进GTPBP4 mRNA和蛋白质水平升高,而沉默野生型FGD5-AS1则可以导致GTPBP4 mRNA和蛋白质水平降低.突变型FGD5-AS1的上调对GTPBP4 mRNA和蛋白质水平没有影响(图5E、5F).由此可见,FGD5-AS1可作为miR-542-3p的“分子海绵”竞争性上调Huh7细胞中GTPBP4的表达.
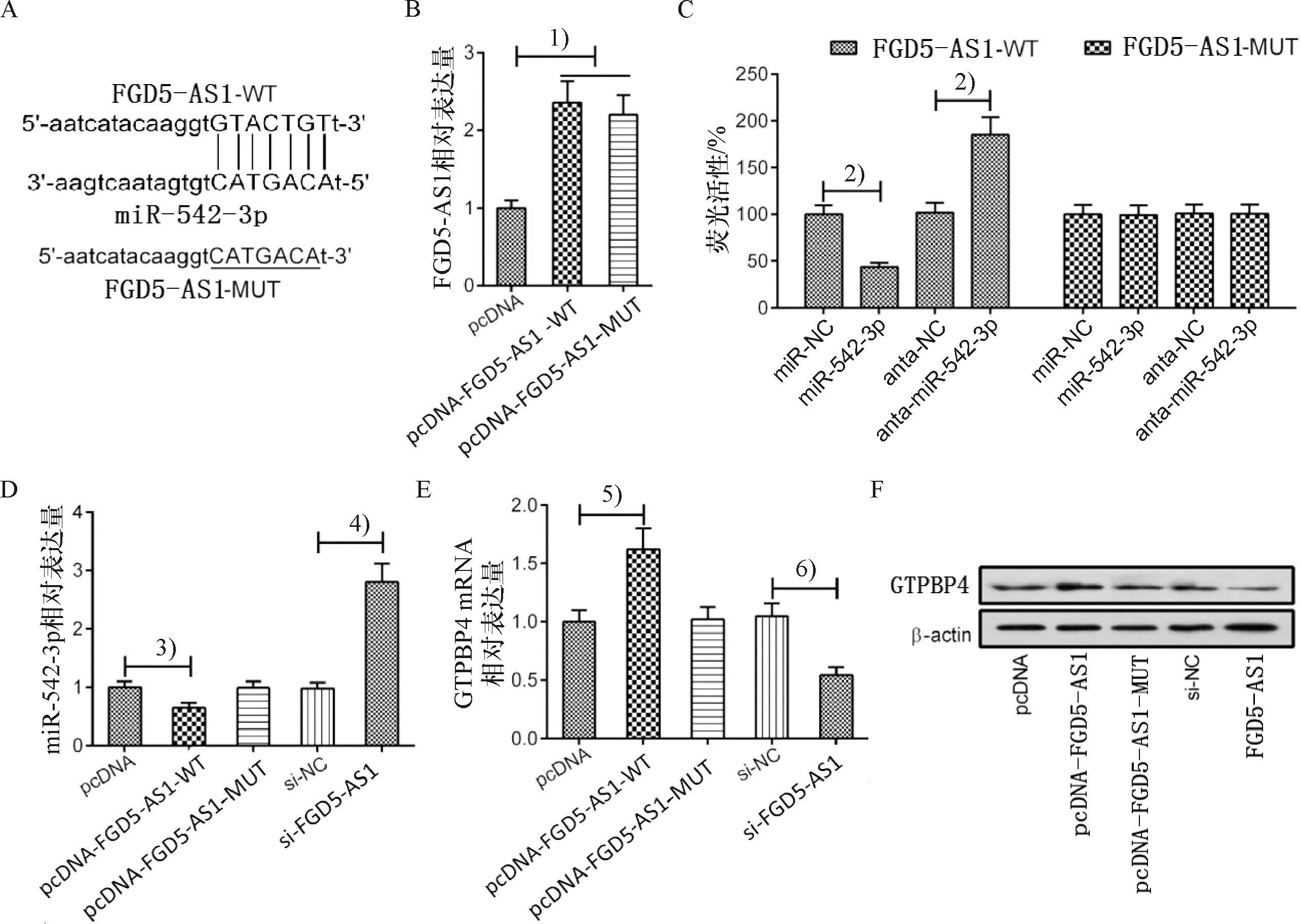
A:在FGD5-AS1的3′-UTR内存在miR-542-3p的位点.B:qRT-PCR检测FGD5-AS1表达水平,1)与FGD5-AS1-MUT相比较,P<0.01.C:FGD5-AS1-WT荧光素酶活性,2)与FGD5-AS1-WT和anta-miR-542-3p共转染相比较,P<0.01.D:qRT-PCR检测miR-542-3p的表达水平,3)与pcDNA相比较,P<0.01;qRT-PCR检测miR-542-3p的表达水平,4)与si-NC组相比较,P<0.01.E、F:qRT-PCR和Western blot检测GTPBP4的mRNA和蛋白表达水平,5)与pcDNA相比较,P<0.01;qRT-PCR和Western blot检测GTPBP4的mRNA和蛋白表达水平,6)与si-NC组相比较,P<0.01.A:The predicted binding sites of FGD5-AS1 and miR-542-3p is shown.B:the FGD5-AS1 expression level was confirmed by qRT-PCR 1) Compared with pcDNA- FGD5-AS1-MUT,P<0.01.C: the luciferase activity of FGD5-AS1-WT was measured 2)Compared with the cells were co-transfected with FGD5-AS1-WT and anta- miR-542-3p,P<0.01 D: the expression of miR-542-3p was examined by qRT-PCR 3) Compared with pcDNA,P<0.01. the expression of miR-542-3p was examined by qRT-PCR 4)Compared with si-NC,P<0.01. E、F: the mRNA and protein expression levels of GTPBP4 were determined by qRT-PCR and Western blot 5)Compared with pcDNA,P<0.01. the mRNA and protein expression levels of GTPBP4 were determined by qRT-PCR and Western blot 6)Compared with si-NC,P<0.01.图5 FGD5-AS1作为miR-542-3p的“分子海绵”对GTPBP4在HCC细胞中表达的影响Fig.5 The effect of FGD5-AS1 as a “molecular sponge” of miR-542-3p on the expression of GTPBP4 in HCC cells
2.6 FGD5-AS1依赖于miR-542-3p影响HCC细胞对放射的敏感性
为了进一步探讨FGD5-AS1在影响HCC细胞放射敏感性中的作用机制,在HuH7和PLC5细胞中进行了恢复实验.将si-FGD5-AS1、si-NC和anta-miR-542-3p、anta-NC共转染HuH7和PLC5细胞后进行放射线照射.克隆形成实验结果表明,下调miR-542-3p可以减轻si-FGD5-AS1对HuH7和PCL5细胞的克隆形成能力的抑制作用(图6A、6B).此外,共转染si-FGD5-AS1和anta-miR-542-3p的HuH7和PCL5细胞的凋亡细胞百分比明显低于共转染si-FGD5-AS1和anta-NC的HuH7和PCL5细胞的凋亡细胞百分比(图6C、6D).由此可见,FGD5-AS1对HCC细胞放射敏感性的影响依赖于miR-542-3p.
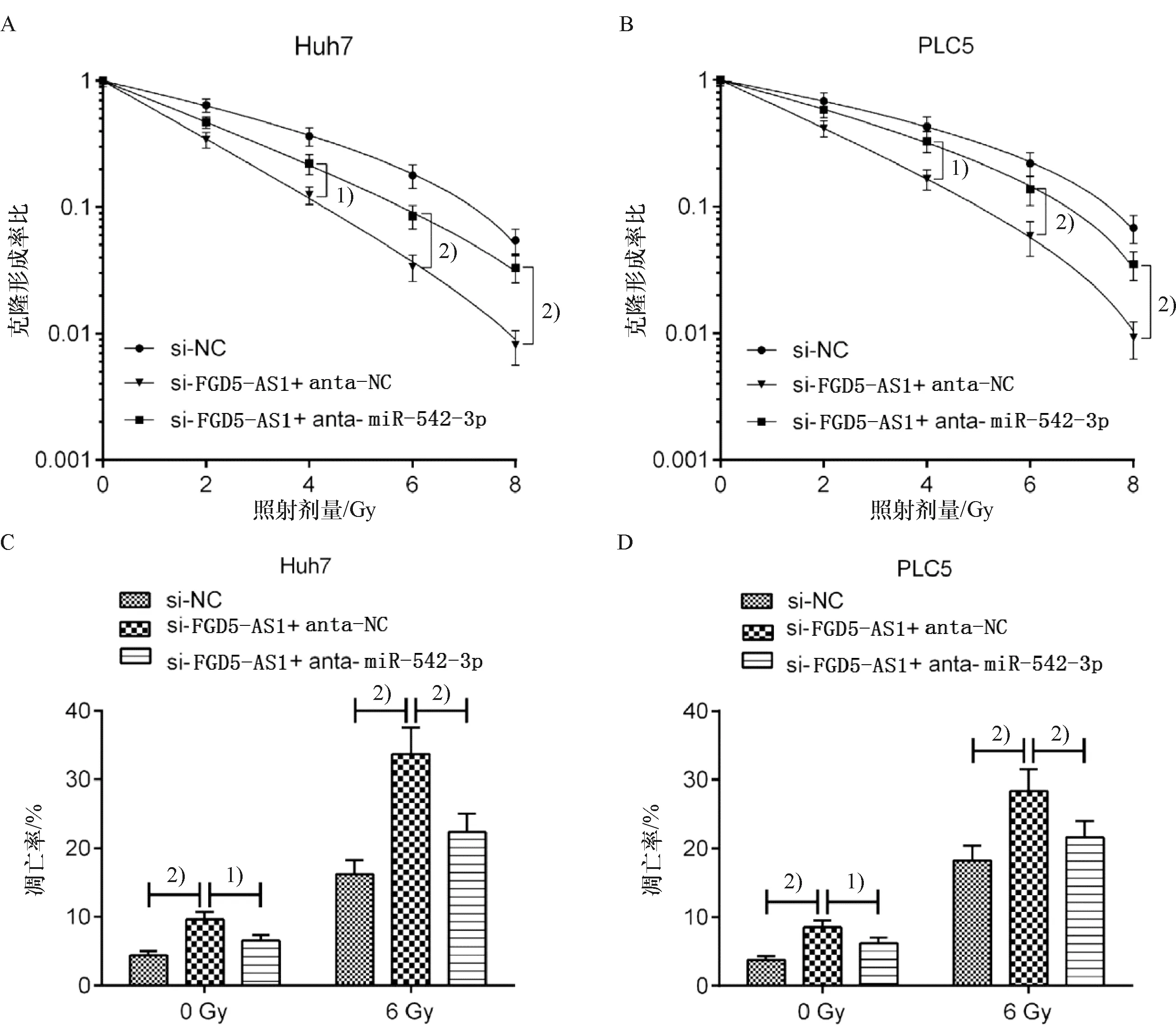
与si-FGD5-AS1和anta-NC共转染组比较,1)P<0.05,2)P<0.01Compared with the cells were co-transfected with si-FGD5-AS1 and anta-NC,1)P<0.05,2)P<0.01A、B:Huh7和PLC5细胞的克隆形成能力,C、D: Huh7和PLC5细胞的凋亡情况.A、 B: Clonogenic survivals of Huh7 and PLC5 cells were assessed after radiation, C、D: The apoptosis of Huh7 and PLC5 cells was analyzed by flow cytometry图6 FGD5-AS1对HCC细胞放射敏感性的影响依赖于miR-542-3pFig.6 The role of FGD5-AS1 in the radiosensitivity is dependent on miR-542-3p
3 讨论
lncRNA FGD5-AS1位于染色体11q13.1上,可以作为miRNA的“分子海绵”调控基因的表达.研究表明,FGD5-AS1参与多种癌症的发展,例如乳腺癌、前列腺癌、非小细胞肺癌和胃癌[8,15-16].有研究发现,FGD5-AS1在乳头状甲状腺癌组织中的表达水平明显高于正常组织[17].沉默FGD5-AS1可以上调miR-106b-3p的表达,抑制ATAD2的表达,进而抑制K1和TPC1细胞的增殖、迁移和侵袭,诱导K1和TPC1细胞凋亡[18].近年来,多项研究证明,FGD5-AS1在肿瘤细胞辐射抗性的发生发展中起着重要作用.沉默FGD5-AS1可以通过下调Bcl-2表达,上调caspase-3的表达,降低鼻咽癌细胞的克隆形成能力,诱导细胞凋亡,增强细胞对辐射的敏感性.此外,沉默FGD5-AS1可以通过调控miR-204/ZEB1的表达,逆转上皮-间质转化表型,增强鼻咽癌细胞的放射敏感性[19].然而,FGD5-AS1在HCC细胞放射敏感性中的作用尚不清楚.在本研究中,FGD5-AS1在HCC组织和细胞中表达上调.此外,下调FGD5-AS1可以降低Huh7和PLC5细胞的克隆形成能力,诱导细胞凋亡,增强肝癌细胞的放射敏感性.
近年来,多项研究发现miR-542-3p在人类癌症的发展中起着重要的调节作用[20-21].miR-542-3p在胶质瘤组织和细胞中表达下调,且其表达水平与胶质瘤患者的肿瘤分级和预后不良呈负相关[22].过表达miR-542-3p可以通过靶向MALAT-1抑制PI3K/Akt信号通路,进而抑制非小细胞肺癌细胞的增殖、迁移和侵袭[23].此外,在腺样囊性癌中,过表达miR-542-3p可以抑制Pim-1的表达,进而抑制SACC-83和SACC-LM细胞的增殖和侵袭,诱导细胞凋亡,增强细胞对顺铂的敏感性[24].在本研究中,miR-542-3p在肝癌组织和细胞中表达下调.FGD5-AS1的过表达可显著降低miR-542-3p的表达水平,而FGD5-AS1表达沉默则可显著升高miR-542-3p的表达水平.下调miR-542-3p又可以减弱FGD5-AS1沉默对肝癌细胞放射敏感性的增强作用,此提示FGD5-AS1对HCC细胞放射敏感性的影响作用依赖于miR-542-3p.
GTPBP4是一种属于Ser/Thr蛋白激酶家族的酪氨酸激酶,是细胞周期的重要调节因子,可通过抑制细胞进入有丝分裂来调节细胞大小[25].学者认为GTPBP4是一个潜在的恶性肿瘤治疗靶点[26].GTPBP4抑制剂AZD1775可以减轻由辐射诱导的肝癌细胞G2的阻滞,并增强Hep3B、Huh7和HepG2细胞对辐射的敏感性[25].此外,AZD1775治疗可以抑制同源重组修复活性,上调γ-H2AX的表达,进而增强奥拉帕利介导胰腺癌细胞对辐射的增敏作用[27].在本研究中,GTPBP4在HCC组织及细胞中表达上调,沉默GTPBP4可以降低Huh7和PLC5细胞的克隆形成能力,诱导细胞凋亡,增强肝癌细胞的放射敏感性.荧光素酶报告实验发现,GTPBP4是miR-542-3p的靶基因,上调miR-542-3p可明显降低GTPBP4的mRNA和蛋白水平,而转染anta-miR-542-3p可明显升高GTPBP4的mRNA和蛋白水平,miR-542-3p可靶向抑制GTPBP4的表达.
FGD5-AS1上调可以促进GTPBP4 mRNA和蛋白质水平升高,而沉默FGD5-AS1则可以导致GTPBP4 mRNA和蛋白质水平降低.FGD5-AS1可作为miR-542-3p的“分子海绵”竞争性上调GTPBP4的表达进而影响肝癌细胞的放射敏感性的结论.
本研究证实FGD5-AS1和GTPBP4在肝癌组织和细胞中表达上调,而miR-542-3p在肝癌组织和细胞中表达下调.功能分析发现FGD5-AS1沉默可以通过调节miR-542-3p/GTPBP4轴增强肝癌细胞的放射敏感性.本研究表明靶向FGD5-AS1可能成为肝癌放射治疗的新靶点.

