腹腔镜超声引导下微波消融治疗肝癌的预后因素分析
黄雪梅, 牟培源, 白媛媛, 姜婷婷, 雷磊, 段伟宏
(1. 锦州医科大学 火箭军特色医学中心 研究生培养基地, 辽宁 锦州 121000; 2. 中国人民解放军火箭军特色医学中心 超声诊断科,北京 100088; 3. 中国人民解放军火箭军特色医学中心 肝胆外科,北京 100088)
原发性肝癌是全球致死率最高的疾病之一,肝细胞肝癌(hepatocellular carcinoma, HCC)占原发性肝癌的75%,是亚洲和非洲致死率最高的疾病[1].2018年全球有接近84万新发HCC病例和78万死于HCC病例[2],且由于肝炎病毒感染和慢性肝脏疾病等因素影响,新发和死亡病例数量均有增长趋势[3].尽管手术切除及肝移植是肝癌治疗的可能治愈方式[4],但其受益群体有限,术后复发率高,远期疗效仍不满意[5].随着医学设备和技术的进步,腹腔镜超声引导下微波消融(laparoscopic ultrasound-guided microwave ablation,LUS-MWA)在非手术切除肝癌患者治疗中有举足轻重的地位[6],特别是在位置较深及经皮超声引导不易到达的肿瘤中应用更多[7-8].近年来,LUS-MWA治疗肝癌的疗效存在争议,其生存预后研究较少,本文旨在研究LUS-MWA治疗肝癌的生存率等指标,对其相关预后因素进行分析探讨.
1 资料与方法
1.1 入选标准
(1)因各种原因不能或不宜直接根治性切除或经皮消融手术困难的肝肿瘤患者;(2)肿瘤数量少于3个;(3)肿瘤最大径小于8 cm;(4)肝功能Child-Pugh C级以外的所有肝癌患者;(5)血小板分子浓度>40×109/L,血红蛋白的质量浓度>70 g/L;(6)无血管、胆管癌栓,无肝外转移.
1.2 研究对象
选取2014年1月1日至2017年7月30日在北京火箭军特色医学中心肝胆外科进行LUS-MWA治疗的肝癌患者81例,共103个病灶,所有病例均符合肝癌诊断标准,其中穿刺活检病理诊断63例,符合美国肝病研究协会(AASLD)和欧洲肝脏研究协会(EASL)[9]的临床诊断18例.国际抗癌联盟(union for international cancer control, UICC)分期Ⅰ、Ⅱ、Ⅲ、Ⅳ期患者分别20、17、11、7例,复发癌26例.其中男64例,女17例;年龄27~80岁,平均(56.35±1.27)岁.S1段病灶1个,S2段7个,S3段13个,S4段10个,S5段14个,S6段23个,S7段8个,S8段10个,单段病灶17个,其中单发病灶61例,2个病灶15例,3个病灶4例;瘤体最大径平均(3.20±1.46)cm,中位数3.0 cm,范围1.0~7.0 cm.患者基本资料及肿瘤特征见表1,2.

表1 81例肝癌患者临床资料及肿瘤基本特征Table 1 Patients’ clinical data and basic features of tumor
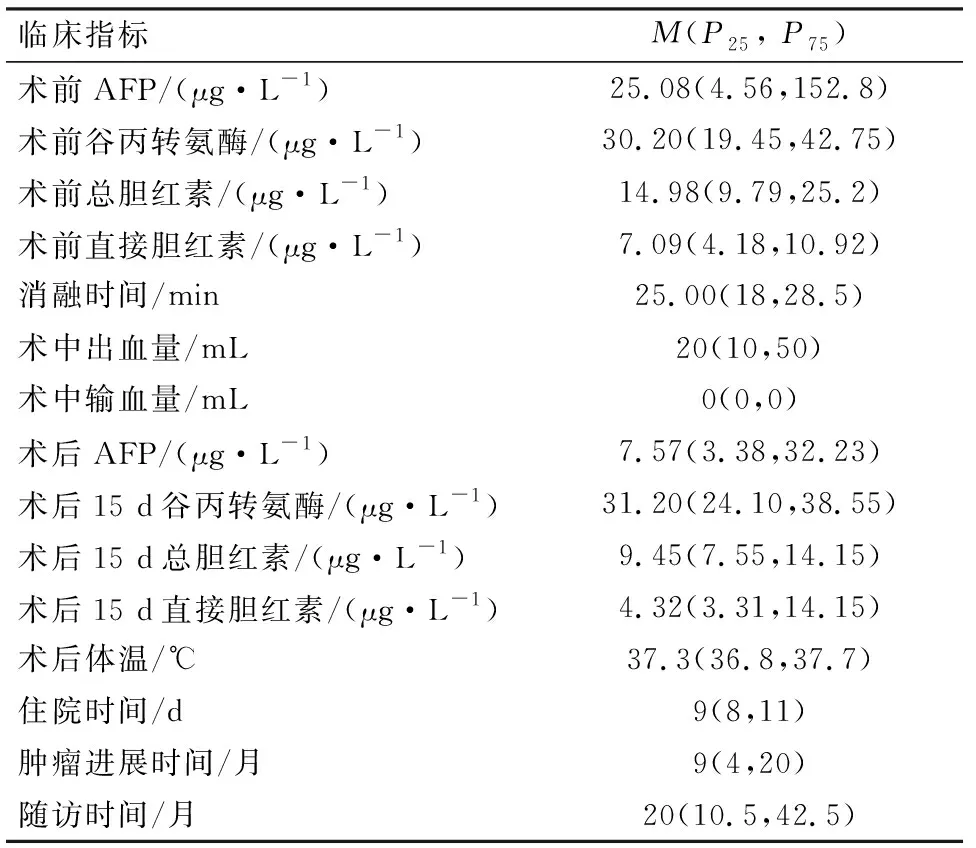
表2 81例肝癌患者手术前后各临床指标
1.3 仪器与方法
采用日本产阿洛卡超声诊断仪(Aloka SSD-3500型),腹腔镜超声探头频率:5~10 MHz;国产微波消融仪(EOO-100A112型).所有患者均由肝胆外科手术经验超过10年及超声科主任医师组成的专业团队进行手术,超声科医师负责超声引导,肝胆外科医师进行相关手术操作.患者全身麻醉(简称全麻),于脐部做一个1 cm切口,置套管针用于腹腔镜观察,气腹后于适当的位置另做两个1 cm切口,分别置入超声探头及消融针.在腹腔镜超声引导下进针,将微波消融针刺入结节深部开始消融,消融功率60~70 W,当肿瘤最大径≤2 cm时采用单针消融,当肿瘤最大径>2 cm时,部分结节进行多针重叠消融,必要时一次消融完成后,退针1~2 cm后再次消融.超声直视下病灶强回声覆盖肿瘤边缘,并用彩色多普勒超声显示结节及周边,未见血流信号时缓慢退出消融针并消融通道.
1.4 疗效评估
消融后1个月复查增强CT或MRI及血清甲胎蛋白(alpha fetoprotein, AFP)以评估疗效.消融完全:病灶增强CT动脉期、门脉期无明显强化及消退且AFP值较术前降低;消融不完全:CT显示:病灶内或周边强化或AFP值较术前升高.治疗成功:同一病灶一次或连续两次消融完全.若消融两次后肿瘤仍有活性,则治疗失败并进行其他治疗.肿瘤进展:随访期间CT显示:邻近消融区再次出现组织强化或远离消融区再生肿瘤.术后严重并发症:需要全麻干预的手术、内镜手术或放射治疗或影响生命安全的并发症;轻微并发症:不需要手术、手术内镜或放射治疗的并发症.
随访期间,所有患者均于术后1个月行AFP及生化检查,并进行增强CT或MRI扫描,第1年每3个月检查一次,第2年起每3个月至半年检查一次.
1.5 统计学方法
2 结果
2.1 治疗成功率及术后并发症
81例肝癌患者中72例患者一次治疗成功,9例患者术后1月复查时进行2次消融,其中3例消融完全,6例患者消融不完全,治疗成功率 92.6%;消融不全者在消融后进行了肝动脉化疗栓塞治疗.术中及术后均未出现严重并发症,轻微并发症52例,包括发热40例、腹腔及胸腔积液21例、肝功能损害15例、脓肿2例、肺部感染2例、复发性胆管炎1例、胆瘘1例,所有并发症经干预治疗后均痊愈.
2.2 生存率随访结果
消融后随访3~72个月,中位期20个月,生存曲线见图1.随访截止时35例患者死于疾病进展(43.2%),46例患者荷瘤生存(56.8%);22例患者无复发转移(27.2%),59例患者肿瘤进展 (72.8%),包括6例肝外转移(7.5%),53例肝内肿瘤复发或转移(65.4%).术后1、2、3、5年累积总体生存率分别为79.1%、63.5%、52.3%、43.1%;术后无进展中位随访期10个月(1~72个月),1、2、3、5 年累计无进展生存率分别为 50.7%、37.2%、24.0%、12.0%.首发癌Ⅰ期和Ⅱ期患者治疗后1、2、3、5年生存分别是94.1%、90.6%、78.8%、67.1%,Ⅲ期和Ⅳ期1、2年生存率分别是60.0%、28.0%,两组比较有统计学差异(2=18.349,P=0.000);复发癌1、2、3、5年生存率分别是84.0%、49.0%、32.7%、0.0%,与首发癌比较有统计学差异(2=4.193,P=0.041),与Ⅲ期和Ⅳ期比较无统计学差异.
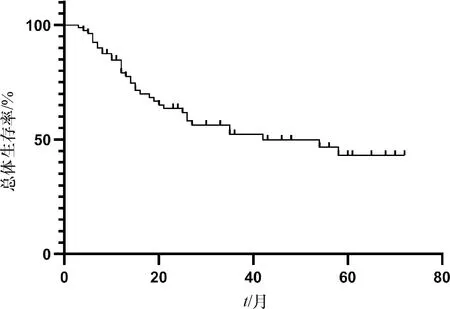
图1 81例患者Kaplan-Meier总体生存曲线Fig.1 Kaplan-Meier analysis of the overall survival curve of 81 patients
2.3 预后因素分析
将24项因素进行单因素分析,结果显示基础疾病、肝癌类型、UICC分期、肿瘤分化程度、组织学类型、Child-Pugh分级、病灶个数、病灶跨多段、瘤体大小、AFP水平、术后AFP水平、消融状态、肿瘤进展性、肿瘤进展时间共14项因素与患者生存时间有关,差异具有统计学意义(表3),性别、年龄、门脉高压、治疗方式等10项因素与患者生存期无相关性,差异无统计学意义.将14项与患者生存期有关的因素进行多因素分析,结果表明影响患者生存期的独立因素有组织学类型、Child-Pugh分级、病灶跨多段、术后AFP水平、肿瘤进展时间,各因素与患者预后的关系(表4,图2).
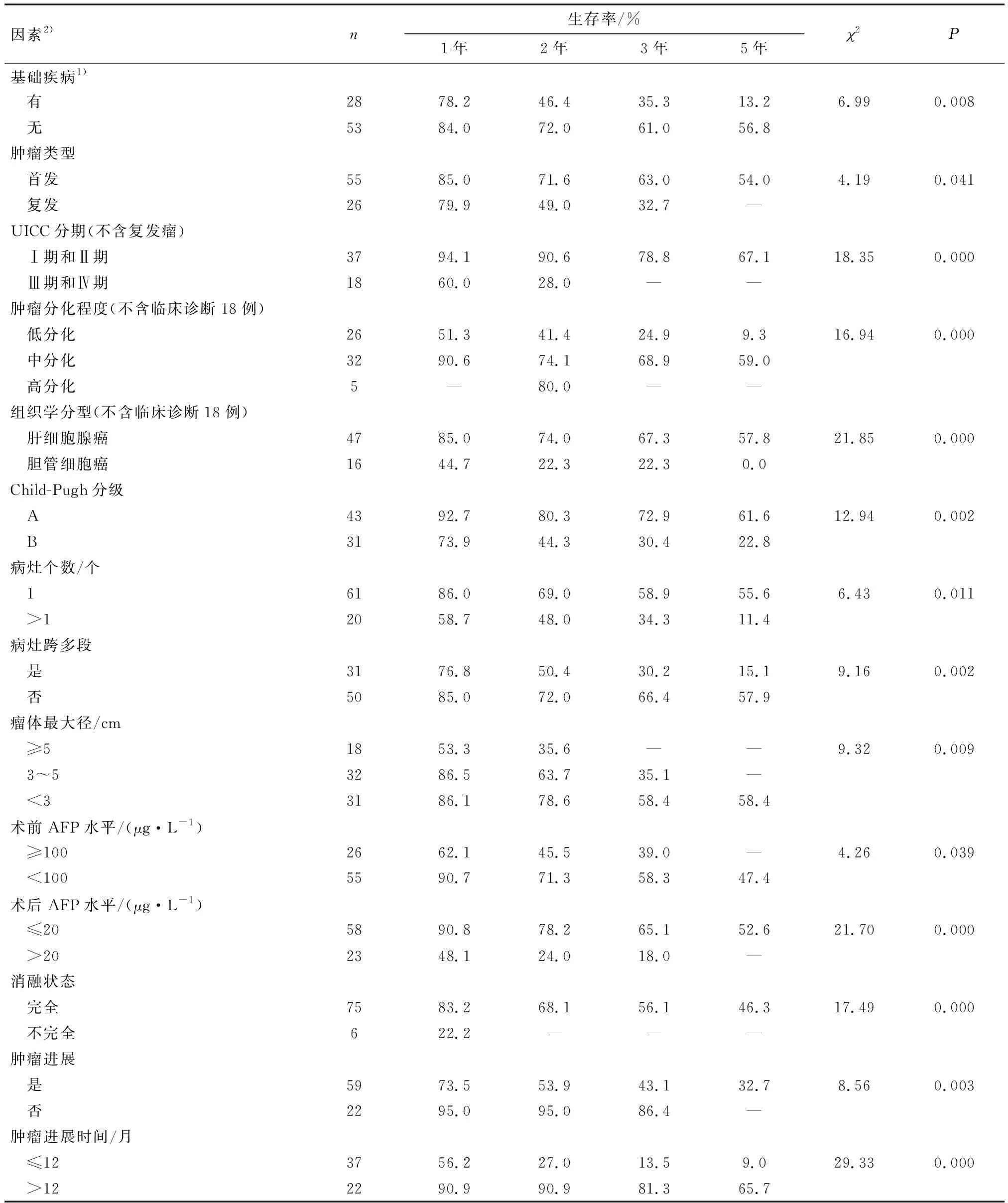
表3 影响肝癌患者总体生存的单因素分析Table 3 Univariate analysis of overall survival in patients with primary liver cancer

表4 影响肝癌患者术后总体生存预后的多因素分析Table 4 Multivariate analysis of prognostic factors in patients with primary liver cancer
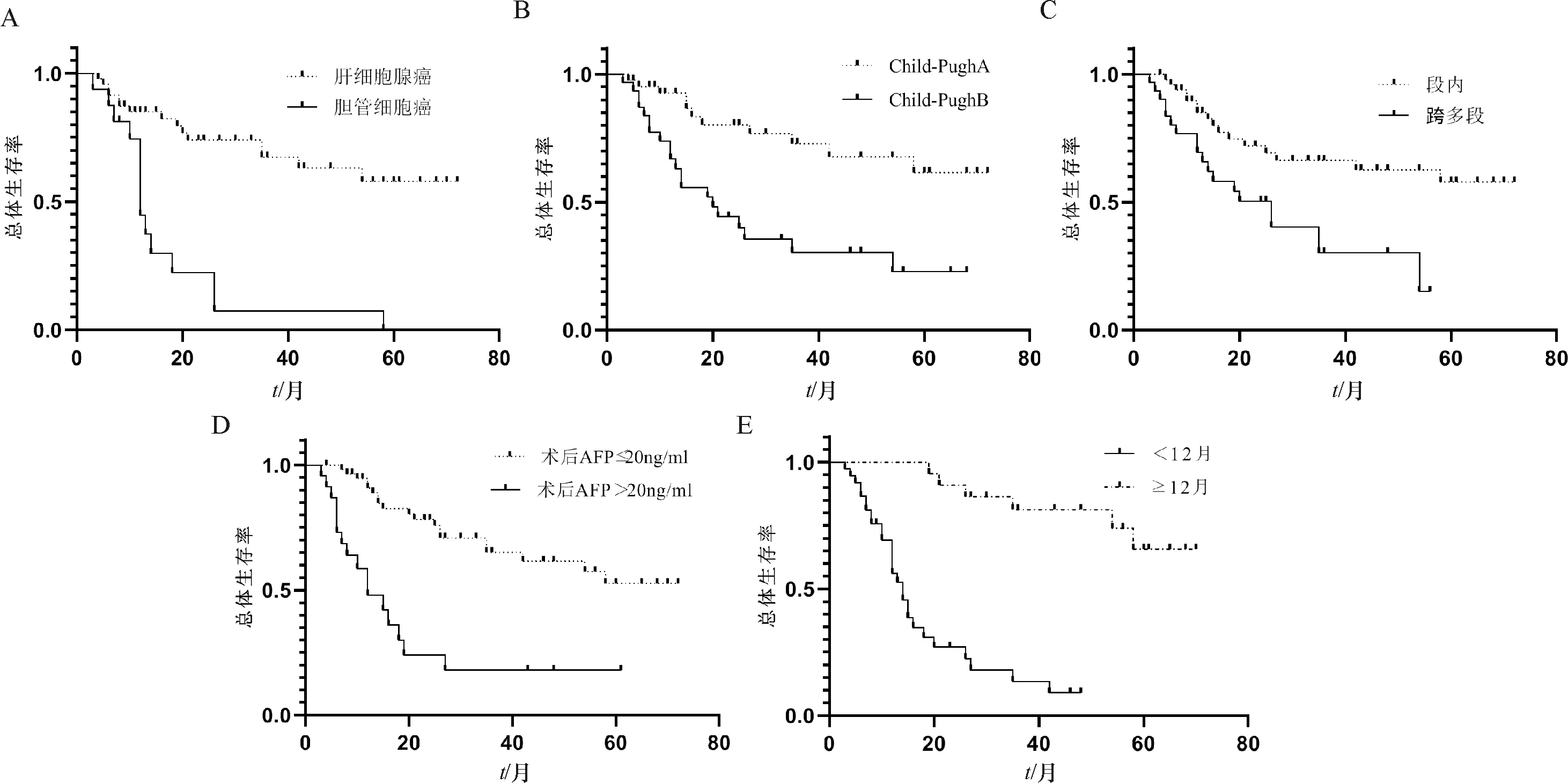
图2 影响患者预后的不同独立因素生存曲线图Fig.2 Survival curves of different independent factors influencing the prognosis of patients
3 讨论
手术切除和肝移植是治疗肝癌、减少术后复发的最佳手术方式[10],但是仅有1/3的患者可以接受手术切除[11],而更多肝癌患者由于肝硬化程度高、肿瘤位置不佳、肿瘤晚期或同时存在的临床情况而被判定为不可手术切除治疗的患者,一项前瞻性研究指出这部分患者采用LUS-MWA治疗取得了不错的疗效,2年生存率达到81%[12].以往针对LUS-MWA治疗肝癌的预后研究较少,有文献指出影响患者预后的独立因素有术前AFP水平[13]、肝功能分级[14]、门脉高压、治疗目的方案[15]、肿瘤大小、血管接近程度[12]等因素,本研究部分结果与上述相同.腹腔镜超声提供了比经皮超声更好的分辨率,更安全的消融空间,术中应用腹腔镜超声引导能对毗邻胃肠道、第一肝门、第二肝门、胆囊和胆管附近的病变进行更精确地定位,最大程度减少邻近损伤,提高疗效[10,12].
有研究指出糖尿病是肝硬化患者腹水产生、细菌感染及发展为肝癌的独立影响因素[16],与肝癌的复发以及死亡也有关[17].高血压是肝癌自发破裂的危险因素,其原因可能为高血压导致肿瘤内压增高而破裂[18],肝癌破裂可致出血性休克,死亡率高[19].本研究中伴有高血压、糖尿病等基础疾病的患者28例,其中位生存期为14个月,余53例患者中位生存期为25个月,单因素分析中两组间比较有统计学差异(2=6.69,P=0.008),说明有高血压、糖尿病的肝癌患者治疗后预后更差.
本研究中复发癌的生存期较首发癌Ⅰ期和Ⅱ期短,因为复发癌在入组之前进行的手术或消融治疗的生存期未统计在本研究中,其随访起点为此次治疗日,故两组比较差异具有统计学意义,而Ⅲ期和Ⅳ期是肝癌晚期,生存期短,因此生存时间与复发癌比较差异无统计学意义.
文献报道肿瘤低分化是影响肝癌患者治疗后预后的独立危险因素[20],是肝癌复发和转移的危险因素[21],本研究单因素及多因素分析结果与其相似,肿瘤高、中、低分化的患者中位生存期逐步降低,分别为54、25、12个月,其差异具有统计学意义,肿瘤分化程度越低,恶性程度越高,生存期越短.有研究报道肝细胞肝癌的复发率显著低于胆管细胞癌,生存质量明显更优[22],胆管细胞癌临床症状不明显,少伴肝硬化, AFP多不升高, 且易于发生淋巴结转移,因此其预后较差[23].
Child-Pugh分级是影响患者生存的独立预测因素[12],本研究中Child-Pugh A级、Child-Pugh B级的患者中位生存期分别为27个月、14个月,两者差异有统计学意义(2=12.405,P=0.000).
肿瘤大小、数目在多项研究中被认为是影响患者生存预后的独立危险因素[13-15],Bai等[14]研究报道肿瘤直径≥3 cm是乳腺癌肝转移进行经皮射频消融治疗后肿瘤进展的危险因素,另有文献指出肿瘤直径≥2.5 cm的患者预后较肿瘤直径<2.5 cm的患者差[24],而更多的研究显示肿瘤>5 cm是HCC患者肿瘤复发和患者死亡的1个独立不良因素[25-26].本研究中肿瘤最大径<3 cm、3~5 cm及≥5 cm的患者中位生存期递减,分别是36、22、10个月,差异有统计学意义.有文献指出肿瘤数量与肝癌患者消融后预后有关[27],单个肿瘤消融后生存期较多发肿瘤更长.本研究中肿瘤跨多段与肿瘤大小和数量均有关,跨多段肿瘤的平均最大径为4.05 cm,段内肿瘤的平均最大径为3.06 cm,两组比较差异有统计学意义;多病灶肿瘤中跨多段与段内肿瘤的比例为3∶1,单因素方差分析结果显示两组比较有统计学差异,本研究单因素及多因素分析均显示病灶跨多段与患者的生存预后有关,但是否受瘤体大小及数量的影响尚未可知,该因素在LUS-MWA肝癌治疗的预后判断中是否具有临床意义还需要进一步探讨.
Ma 等[28]发现术前AFP质量浓度>400 ng/mL是肿瘤进展和患者总体生存率的危险因素,本研究分析结果显示术前AFP水平与预后有关,但非患者预后的独立影响因素,术后AFP是否下降到正常值是影响预后的独立因素.肿瘤侵犯微血管可导致AFP水平升高但在增强影像学可显示无强化,在既往文献中AFP水平升高被认为是微血管侵袭的预测指标,提示较高的肿瘤侵袭性[14],术后若AFP仍高则提示微血管侵袭,肿瘤易复发或转移.
以往研究显示肿瘤不完全消融是影响肝癌患者治疗后生存预后的独立危险因素[26],消融不完全致肿瘤仍存在活性,更易发生复发或转移,本研究中肿瘤消融不完全与消融完全的患者中位无进展生存期分别为2个月与11个月,中位总体生存期分别为9个月和24个月,两组比较有统计学差异.
肿瘤复发或转移是肿瘤进展的指标,进展的肿瘤生存期较不进展的肿瘤更短,早期进展的肿瘤较晚期进展的肿瘤预后更差,早期进展多为消融时不完全或癌细胞经门静脉播散的结果,有研究指出血管浸润是肝癌早期进展的独立影响因素,进展后再次治疗损害肝功能或累及周边血管使患者预后差[29],而晚期肝癌进展多与肝炎活动、肝硬化情况有关,患者预后相对较好.本研究中肿瘤进展与不进展两组比较,中位生存期分别为19个月与24.5个月,差异有统计学意义;早期进展与晚期进展两组比较,中位生存期分别为12个、51个月,差异有统计学意义.
本研究尚存在一些不足,本课题为单中心回顾性研究,不可避免存在选择偏差;由于样本量小,可能导致结果存在偏倚;许多参与本研究的患者在术前或术后都进行了切除或其他治疗,这可能对患者生存率评估产生影响,部分消融术前进行过肝胆切除的患者可能因为手术导致粘连,限制了自由进出肝脏的通道,并延长手术时间增加了损伤其他结构的风险,此外,深度肿瘤的治疗仍存在一定的技术难度,对于操作者的经验具有一定的要求.因此,需通过扩大样本含量、采用前瞻性研究方法、进行多中心样本采集等方式来进一步研究验证与预后相关的更多因素.
LUS-MWA治疗肝癌较手术切除和经皮消融治疗有更多优越性[30],其优点包括微创、直观、对组织深度、层次、结构性质敏感,可以防止腹壁的热灼伤等,且患者满意度和接受度均较高,依从性好.本研究通过对81例肝癌患者行LUS-MWA治疗,消融率达到92.6%,疗效肯定,患者术后1、2、3、5年累积总体生存率分别为79.1%、63.5%、52.3%、43.1%.影响肝癌患者LUS-MWA治疗生存预后的独立因素有:(1)肿瘤因素:组织学类型及瘤体是否跨多段生长;(2)患者及其他因素:Child-Pugh分级、术后AFP水平及术后肿瘤进展时间.因此,在临床诊疗中充分了解肿瘤特征,在围手术期做好患者短期疗效评估,及时发现肿瘤进展征象并采取相应干预措施,可提高患者的远期生存率.

