miR-664b-3p调控Caspase-1介导细胞焦亡在深静脉血栓形成中的作用
褚楚,刘文,郭红,赵霖,魏然,张振,郭强,朱肖肖,王彬,李霞
1 山东第一医科大学基础医学院(基础医学研究所),济南250062;2 山东德升生物工程有限公司;3 山东中医药大学附属医院
深静脉血栓形成(DVT)是临床常见的周围血管疾病,因血液在深静脉内不正常凝固导致静脉回流障碍[1]。目前DVT 的发病机制尚不清楚,探讨其发病机制对于寻找有效的防治措施具有重要意义。细胞焦亡是一种炎性程序性细胞死亡,由两种半胱氨酸天冬氨酸蛋白酶(Caspase)介导,包括经典的Cas⁃pase-1和非经典的Caspase-4/5/11。其中,Caspase-1可激活白细胞介素(IL)1β 和IL-18 前体产生成熟的IL-1β 和IL-18,同时裂解焦孔素D(GSDMD)形成具有成孔作用的活性片段GSDMD-N 以诱导细胞焦亡[2]。微小核糖核酸(miRNAs)通过与其靶基因3′非翻译区(3′UTR)结合抑制基因转录或翻译[3]。越来越多的研究表明,miRNAs 参与了DVT 的发生和发展,但其调控细胞焦亡在DVT 中的作用尚未见报道。2020 年2 月—10 月,我们通过检测DVT 患者外周血细胞焦亡相关蛋白及miR-664b-3p 水平变化,探讨miR-664b-3p 通过靶向调控Caspase-1 介导细胞焦亡在DVT 发病中的作用,为临床治疗DVT 提供新的靶点与依据。
1 资料与方法
1.1 临床资料 将2019 年1 月—2020 年1 月收治的急性期DVT 患者纳入研究。纳入标准:①符合第3 版《深静脉血栓形成的诊断和治疗指南》[4]中的诊断标准,属于急性期混合型单纯下肢DVT;②单侧肢体发病,病程<15 d;③年龄18~80 岁;④尚未采用溶栓等药物治疗。排除标准:①合并活动性下肢溃疡;②合并心、脑、肺疾病及肝、肾功能异常;③有出血性疾病或出血倾向;④妊娠期妇女。本研究共收集DVT 患者30 例(DVT 组),男18 例、女12 例,年龄(56.8 ± 6.2)岁;选取同期健康志愿者30 例(健康对照组),男14例、女16例,年龄(54.8 ± 7.6)岁。两组性别、年龄具有可比性。本研究经山东中医药大学附属医院伦理委员会批准,研究对象均签署知情同意书。
1.2 标本采集与试剂准备 受试对象均于清晨空腹抽取静脉血6 mL,分离血清用于ELISA 检测,经人外周血淋巴细胞分离液分离单个核细胞(PBMC)用于qPCR 和Western blotting 检测。实验主要试剂:人外周血淋巴细胞分离液、RIPA 裂解液购于索莱宝科技有限公司;TRIzol Reagent、UItraSYBR Mixture均购于北京康为世纪生物科技公司;miRNA 1st Strand cDNA Synthesis Kit 购于南京诺唯赞生物科技有限公司;293T 细胞购于南京科佰生物科技有限公司;Lipofectamine2000 购于美国Invitrogen 公司;人IL-1β、IL-18 蛋白ELISA 试剂盒购自杭州联科生物技术有限公司;miR-664b-3p mimics(上游序列为5′-UUCAUUUGCCUCCCAGCCUACA-3′,下游序列为5′-UAGGCUGGGAGGCAAAUGAAUU-3′)、阴性对照(NC,上游序列为5′-UUCUCCGAACGUGUCAC⁃GUTT-3′,下 游 序 列 为5′-ACGUGACACGUUCG⁃GAGAATT-3′)及miR-664b-3p、内参U6 引物由上海吉玛公司设计合成,引物序列见表1;Caspase-1 抗体、GAPDH 抗体购自英国Abcam 公司;GSDMD-N 抗体购于美国Novus Biologicals 公司;辣根过氧化物酶标记的山羊抗兔IgG 抗体购于北京中杉金桥公司;野生型与突变型Caspase-1 3′UTR 载体均由美国Promega公司设计合成。
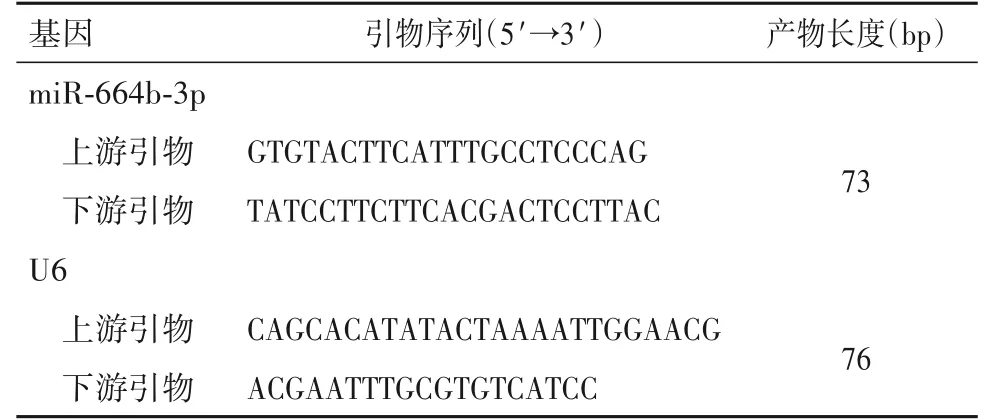
表1 miR-664b-3p、U6基因引物序列及产物片段
1.3 PBMC 中活化的Caspase-1(Cleaved Caspase-1)、GSDMD-N及miR-513c-5p检测
1.3.1 Cleaved Caspase-1、GSDMD-N 蛋白检测 采用Western blotting 法。 用RIPA 裂解液提取各组PBMC 总蛋白,SDS-聚丙烯酰氨凝胶电泳,转膜;5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜;1×PBST 洗膜(10 min×4 次),二抗室温摇床孵育1 h;1×PBST 洗膜(10 min×4 次),加入显影液显影,化学发光法染色;Image J 软件分析蛋白条带灰度值,以目的条带与GAPDH灰度值比值作为目的蛋白相对表达量。
1.3.2 miR-664b-3p 检 测 采 用qPCR 法。 用TRIzol 法进行提取各组PBMC 中的RNA,紫外分光光度仪测定RNA 浓度与纯度。 按照miRNA 1st Strand cDNA Synthesis Kit 说明书进行miRNA 的cD⁃NA 合成,选用UltraSYBR Mixture PCR 反应体系进行PCR扩增,以2-ΔΔCt计算miR-664b-3p相对表达量。
1.4 血清IL-1β、IL-18 蛋白检测 取离心所得血清,以ELISA 法检测IL-1β、IL-18 蛋白,按照试剂盒说明书操作。使用酶标仪测定双波长(450 nm、630 nm)处的光密度(OD)值,依据标准品OD 值绘制标准曲线,计算IL-1β、IL-18蛋白水平。
1.5 miR-664b-3p 与Caspase-1 的关系预测 采用Target Scan7.2 生物信息学软件,预测miR-664b-3p与Caspase-1 mRNA 3′UTR 之间是否存在直接结合位点。
1.6 miR-664b-3p 靶向调控Caspase-1 情况观察以pmirGLO为载体构建包含结合位点的野生型及突变型Caspase-1 mRNA 3′UTR 质粒,然后转染293T细胞,同时分别转染miR-664b-3p mimics 及NC,24 h后收集细胞并检测双荧光素酶报告基因活性。
1.7 统计学方法 采用GraphPad Prism7.0 统计软件。计数资料以表示,两组数据比较行配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组PBMC 中Cleaved Caspase-1、GSDMD-N 蛋白及miR-664b-3p表达水平比较 由表2可见,DVT组较健康对照组PBMC中Cleaved-Caspase-1、GSDMD-N蛋白表达升高而miR-664b-3p表达降低(P均<0.05)。
表2 两组PBMC中Cleaved Caspase-1、GSDMD-N蛋白及miR-664b-3p表达比较()
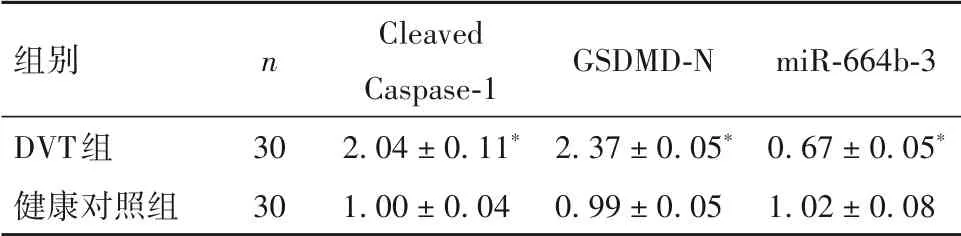
表2 两组PBMC中Cleaved Caspase-1、GSDMD-N蛋白及miR-664b-3p表达比较()
注:与健康对照组相比,*P<0.05;
组别DVT组健康对照组n 30 30 Cleaved Caspase-1 2.04 ± 0.11*1.00 ± 0.04 miR-664b-3 0.67 ± 0.05*1.02 ± 0.08 GSDMD-N 2.37 ± 0.05*0.99 ± 0.05
2.2 miR-664b-3p 与Caspase-1 关系的生物信息学预测结果 miR-664b-3p 与Caspase-1 mRNA 3′UTR之间具有潜在的互补结合位点,提示miR-664b-3p可能通过结合Caspase-1 mRNA 的3′UTR 进而抑制其表达。
2.3 miR-664b-3p 对Caspase-1 mRNA 3′UTR 荧光素酶报告基因活性的影响 由表3 可见,转染miR-664b-3p mimics 可以降低野生型Caspase-1 mRNA 3′UTR 荧光素酶报告基因活性(P<0.05),但对突变型Caspase-1 mRNA 3′UTR 报告基因活性无显著影响(P>0.05)。
表3 miR-664b-3p对Caspase-1 mRNA 3′UTR荧光素酶报告基因活性的影响()

表3 miR-664b-3p对Caspase-1 mRNA 3′UTR荧光素酶报告基因活性的影响()
注:与转染NC的细胞相比,*P<0.05。
转染物Caspase-1 mRNA 3′UTR荧光素酶报告基因活性野生型0.74 ± 0.00*1.00 ± 0.04 miR-664b-3p mimics NC突变型1.00 ± 0.08 0.99 ± 0.03
2.4 两组血清IL-1β、IL-18 蛋白水平比较 由表4可见,DVT 组较健康对照组外周血IL-1β 及IL-18 蛋白水平升高(P均<0.05)。
表4 两组血清IL-1β、IL-18蛋白水平比较()

表4 两组血清IL-1β、IL-18蛋白水平比较()
注:与健康对照组相比,*P<0.05。
组别健康对照组DVT组IL-18 123.00 ± 15.55 526.00 ± 16.03*n 30 30 IL-1β 1.45 ± 0.13 5.56 ± 0.17*
3 讨论
DVT 是因静脉壁损伤、静脉血流滞缓、血液高凝状态引起的周围血管疾病,其急性期导致的肺栓塞及慢性期血栓形成后的综合征严重危害患者生命安全及生活质量[5]。因此,DVT 的发病机制具有重要的研究意义。内皮细胞损伤和功能障碍是DVT发生的重要因素,然而导致血管内皮细胞损伤的机制尚未完全阐明。
细胞焦亡是一种炎性程序性细胞死亡,其特征是GSDMD 介导的细胞膜肿胀破裂和IL-1β、IL-18引起的炎症反应[6]。当炎症小体被激活时,Caspase-1和其他非经典Caspase 将其GSDMD 切割成N-端和C-端,从而破坏蛋白之间的抑制作用。游离的GSD⁃MD-N 末端能够与质膜结合,并在细胞膜上产生内径12~14 nm 的孔隙,导致细胞肿胀、裂解,并成为释放炎症因子(如IL-1β、IL-18)的通道[7]。炎症反应是区别细胞焦亡与细胞凋亡的重要标志。适当的细胞焦亡及炎症反应对于阻断病原体复制、直接杀灭胞内菌及维持机体内环境稳定具有重要作用,但细胞焦亡不足或过度将导致细胞增殖失控或组织损伤,引起疾病的发生和发展[8]。研究发现,细胞焦亡减少可导致肿瘤细胞增殖、侵袭、迁移能力增强,而细胞焦亡过度导致的组织损伤参与了动脉粥样硬化、肥胖、糖尿病等疾病的病理过程[9-10]。然而,目前细胞焦亡在静脉血栓性疾病中的作用和调控机制尚未见报道。本研究发现,DVT 患者外周血细胞焦亡相关蛋白Cleaved Caspase-1、GSDMD-N、IL-1β、IL-18表达均上调,提示Caspase-1介导的细胞焦亡引起内皮细胞损伤参与了DVT 的发病。探索DVT 发病过程中细胞焦亡的调控机制,可能为DVT 的临床治疗提供新的有效靶点。
miRNAs 是非编码RNA 领域研究的热点。越来越多的证据表明,miRNAs 参与细胞增殖、分化、凋亡、信号转导等生理过程的调控,以及多种疾病的发生发展[11]。近年来,miRNAs 在血管内皮损伤和DVT 发展中的作用越来越受到重视。研究发现,miR-195-5p表达升高,促进血管内皮细胞凋亡,从而参与DVT 发病[12]。我们前期研究发现,miR-338-5p表达降低导致的IL-6 表达升高,以及miR-374a-5p、miR-374b-5p 表达升高导致的IL-10 表达降低,均与DVT 的发生发展有关[13-14]。同时,有研究发现miR⁃NAs 对细胞焦亡有调节作用。例如,miR-590-3p 通过靶向NLRP1/NOX4 信号通路抑制细胞焦亡从而减轻糖尿病视网膜病变[15];miR-214 可通过抑制Caspase-1 介导的细胞焦亡,抑制胶质瘤细胞的增殖和迁移[16]。尽管已有上述发现,但miRNAs 影响细胞焦亡在DVT发病中的作用仍不清楚。
有研究报道,miR-664b-3p 参与了喉鳞状细胞癌、胰腺癌等肿瘤发生发展[17]。本研究发现,DVT组患者外周血PBMC 中miR-664b-3p 表达较健康对照组降低,细胞焦亡相关蛋白Cleaved Caspase-1、GSDMD-N 及IL-1β、IL-18 蛋白表达升高。生物信息软件Target Scan预测显示,miR-664b-3p与Caspase-1 mRNA 的3′UTR 之间存在潜在碱基互补结合位点。双荧光素酶报告基因系统证实,miR-664b-3p能够与Caspase-1 mRNA 3′UTR 之间通过碱基互补配对直接结合,进而抑制Caspase-1的转录与翻译。以上结果提示,miR-664b-3p表达降低能够解除其对靶基因Caspase-1表达的抑制,Caspase-1活性增强可通过切割GSDMD形成有活性的N片段,进而在细胞膜上形成孔道,导致细胞焦亡及炎症因子释放,损伤血管内皮功能,最终导致DVT。
总之,本研究进一步阐释了DVT 的发病机制,提示miR-664b-3p调控Caspase-1介导的细胞焦亡参与了DVT 的发生发展;因此,靶向上调miR-664b-3p表达以抑制Caspase-1及血管内皮细胞焦亡、保护血管内皮功能可能成为临床治疗DVT新的有效方式。

