不同离心条件所制PRF的生长因子释放水平及促成纤维细胞增殖、迁移作用比较
贺波,霍继武,熊竹友,蒋邦红,陈宇,李光早
1 蚌埠医学院第一附属医院,安徽蚌埠233000;2 组织移植安徽省重点实验室
富血小板纤维蛋白(PRF)作为新一代血小板制品,因其制作简单、具有独特三维纤维网状结构[1]、能够携带多种促生长因子[2]、不含富血小板血浆(PRP)所需的抗凝剂等优点,被用于多种领域,如创面愈合[3]、口腔种植医学等[4]。PRF 制备方法多种多样,基于不同离心条件可制得不同的PRF 制品,如可注射型PRF、富白细胞PRF(L-PRF)、高级PRF(A-PRF)、高级PRF+(A-PRF+)等[5-7]。不同的PRF制品生长因子含量也有所差异。成纤维细胞作为皮肤真皮层的重要组成细胞,在创面愈合的新生肉芽组织形成及胶原蛋白分泌过程中发挥至关重要的作用[8]。2020 年5 月—9 月,本研究观察了L-PRF、A-PRF、A-PRF+三种制品中血小板衍生生长因子(PDGF-AB)、转化生长因子β(TGF-β)、血管内皮生长因子(VEGF)释放水平及各PRF 制品对皮肤成纤维细胞增殖、迁移的作用,深入了解不同PRF 制品对成纤维细胞生长能力影响的差异性。
1 材料与方法
1.1 实验动物与主要材料 健康成年雄性SD大鼠30 只,SPF 级,体质量300~400 g,购于济南朋悦实验动物繁育有限公司,动物许可证编号为SCXK(鲁)2019003。动物实验流程已通过蚌埠医学院动物伦理委员会批准(2020 第145 号)。特级胎牛血清(FBS)购自CLARK 公司。DMEM/F12 培养基、PBS缓冲液均购自HyClone 公司。青霉素—链霉素双抗、胰酶细胞消化液、CCK-8 试剂、FITC 标记山羊抗兔荧光二抗均购自Biosharp 公司。Ⅰ型胶原酶购自Yeason 公司。4% 多聚甲醛、DAPI 试剂、5% BSA 封闭液购自Solarbio 公司。波形蛋白(Vimention)一抗购自武汉三鹰生物公司。Transwell 嵌套购自Cron⁃ing 公司。TritionX-100 购自BioFRoxx 公司。大鼠PDGF-AB、TGF-β、VEGF 的ELISA 试剂盒均购自酶联生物公司。
1.2 不同PRF 制品制备及条件培养基的获取 以10% 水合氯醛腹腔注射麻醉大鼠,75% 乙醇消毒左胸部皮肤,采血针于心尖搏动明显处穿刺采血,用10 mL不含抗凝剂的采血管采集大鼠血液9~10 mL,置于离心机中。分别以708 g 离心12 min、208 g 离心14 min、208 g 离心8 min 制备得到L-PRF、A-PRF、A-PRF+。弃去上层较清亮的贫血小板血浆层及下层的红细胞层,保留中层胶冻状的PRF 及少量PRF与红细胞交界层,置于超净台内无菌纱布上。将取出的PRF 制品放于两层无菌纱布之间,压平后分别置于24 孔板内,加入等量含10% FBS 及1% 双抗的DMEM/F12 培养基约2 mL,置于细胞培养箱内孵育。分别于操作后1 h、6 h、1 d、3 d、5 d 收集孔板内条件培养基,-20 ℃保存备用。每次收集后重新加入等量培养基继续孵育。
1.3 PRF 析出液中生长因子检测 取出各组条件培养基,待溶解后,置入离心机中,2 000 r/min 离心5 min,分离杂质内容物,收集上清液,采用ELISA 法检测PDGF-AB、TGF-β、VEGF。
1.4 PRF对成纤维细胞增殖、迁移作用观察
1.4.1 成纤维细胞的分离培养及鉴定 取健康成年SD 大鼠,背部取皮区剔毛备皮,碘伏及75% 乙醇消毒,取得2 cm×2 cm 的背部皮肤,置于75% 乙醇中浸泡约20 min。将标本放入超净台中,于含双抗的PBS 中浸泡10 min。用无菌刀片剔除表皮层及皮下组织,PBS 缓冲液漂洗干净后剪成2 mm×2 mm 组织颗粒,放入含0.25% Ⅰ型胶原酶的离心管内消化。将离心管放入37 ℃、CO2培养箱中消化5 h,每隔30 min 摇晃震荡1 次。待组织基本消化后,经70 µm 细胞滤器过滤去除杂质,置于离心机内2 000 r/min 离心6 min。弃去管内液体,用含10% FBS的DMEM 培养基吹打后分装入T25培养瓶内,置于培养箱培养,待细胞贴壁后,3 d 换1 次液。待细胞生长至融合度80%~90% 时进行传代,将P3 细胞以9×103/孔接种于12 孔板的2 孔中,待细胞生长至铺满孔径的90%时,进行Vimentin 免疫荧光实验鉴定。成纤维细胞在倒置显微镜下多数呈长梭形,部分呈扁平星形或三角形分布,细胞突起明显。细胞抗Vimentin 染色呈绿色,均为阳性表达,细胞核呈椭圆形,被DAPI染液染成蓝色,胞质透明不着色。
1.4.2 细胞增殖能力检测 取P3 代成纤维细胞,以2×103/孔接种于96 孔板中预培养24 h,取不同PRF 条件培养基,使用总体积的20%[9]。将细胞分为L-PRF 组、A-PRF 组、A-PRF+组、空白组,每组设3个复孔,分别以L-PRF、A-PRF、A-PRF+条件培养基和10% FBS 培养基培养。分别于培养后1、3、5 d 加入10 µL 的CCK-8 试剂,孵育2 h 后,酶标仪测定450 nm波长处的光密度(OD)值表示细胞增殖能力。
1.4.3 细胞迁移能力检测 取P3 代成纤维细胞,消化离心后,PBS 清洗2 次,用不含PBS 的培养基重悬,调整细胞密度,取200 µL 约4×104个细胞的悬液加入上层室,下层室分别加入L-PRF、A-PRF、A-PRF+条件培养基和10% FBS培养基各600 µL,每组设3 个复孔。24 h 后,用镊子夹出上室,内表面用棉棒轻柔刮擦以去除内侧面细胞,PBS清洗2次,稍作风干后,以4%多聚甲醛(上室200 µL、下室500 µL)固定15 min,PBS 清洗2 次。加入500 µL 的0.1% 结晶紫染色液于下室内,染色20 min。PBS 清洗2 次,置于新孔,小室内加100 µL PBS,镜下观察拍照。
1.5 统计学方法 采用Graphpad Prism8.0软件进行统计分析。多组间比较采用单因素方差分析(One-Way ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 各PRF 条件培养基中生长因子释放水平比较 L-PRF 培养基中PDGF-AB 水平于6 h 时达最高值,之后缓慢下降;A-PRF及A-PRF+培养基前3 d呈上升趋势,后开始下降;A-PRF、A-PRF+培养基制备1 d 后PDGF-AB 释放水平高于L-PRF,且A-PRF+培养基制备1、3 d时PDGF-AB 释放水平高于A-PRF(P均<0.05)。L-PRF 培养基中TGF-β 释放水平于1 d前均呈上升趋势,后开始下降,A-PRF、A-PRF+总体呈上升趋势;制备6 h 后,L-PRF、A-PRF、A-PRF+培养基TGF-β 释放水平依次增高(P均<0.05)。各PRF 培养基中的VEGF 于制备后6 h 释放达最高值,后 明显 降 低;A-PRF、A-PRF+ 培 养 基 制备1 d 后VEGF 释放水平高于L-PRF,A-PRF+ 培养基制备6 h、5 d 后VEGF 释放水平高于A-PRF(P均<0.05)。制备5 d内A-PRF、A-PRF+培养基PDGF-AB、TGF-β、VEGF 总体释放水平高于L-PRF 培养基(P均<0.05)。见表1、表2。
2.2 各组细胞增殖能力比较 见表3。
2.3 各组细胞迁移能力比较 空白组、L-PRF 组、A-PRF 组、A-PRF+组培养24 h 后穿膜细胞数分别为(24.01 ± 2.41)、(40.81 ± 2.61)、(66.91 ± 2.21)、(74.51 ± 3.55)个。L-PRF 组、A-PRF 组、A-PRF+组穿膜细胞数高于空白组,且A-PRF 组、A-PRF+组穿膜细胞数高于L-PRF组(P均<0.05)。
表1 各PRF条件培养基制备不同时点PDGF-AB、TGF-β、VEGF释放水平比较()
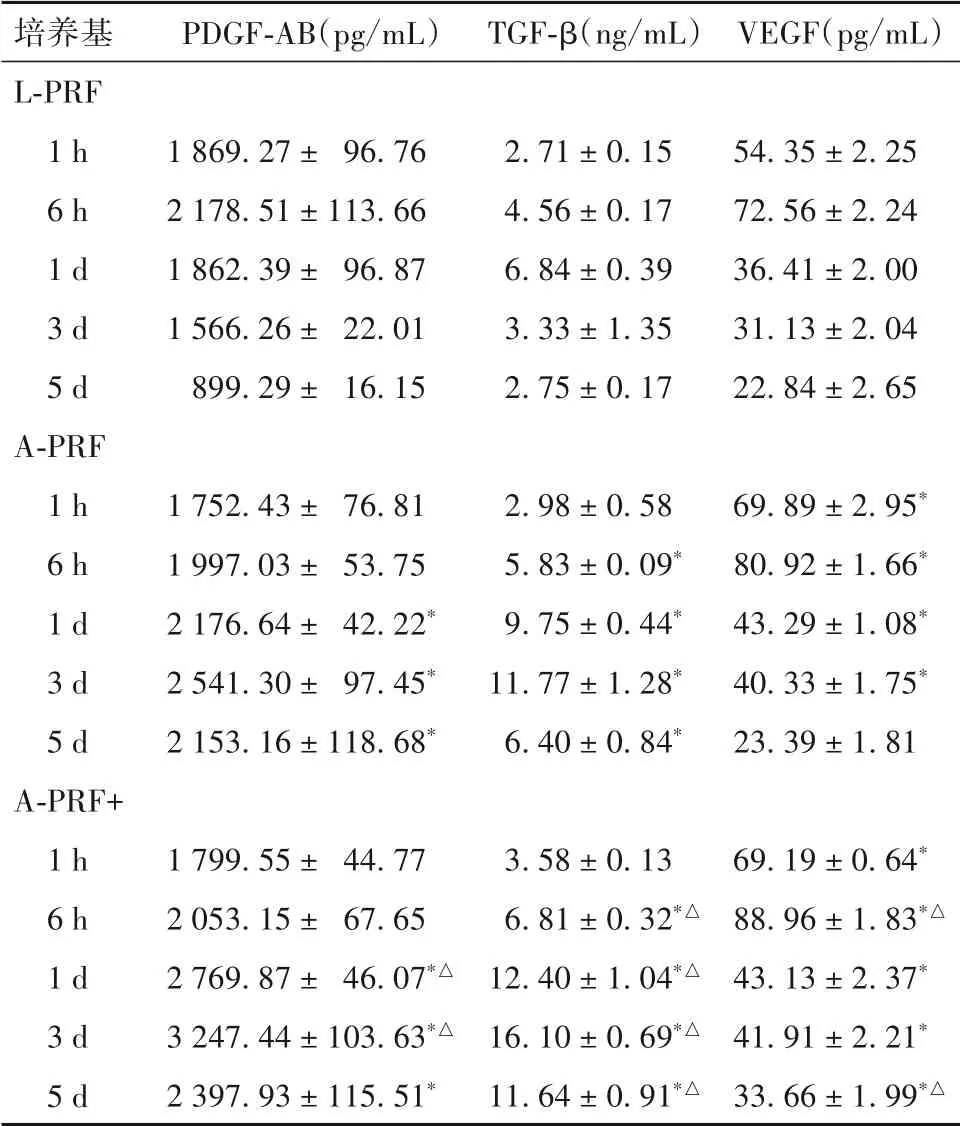
表1 各PRF条件培养基制备不同时点PDGF-AB、TGF-β、VEGF释放水平比较()
注:与L-PRF相比,*P<0.05;与A-PRF相比,△P<0.05。
培养基L-PRF 1 h 6 h 1 d 3 d 5 d A-PRF 1 h 6 h 1 d 3 d 5 d A-PRF+1 h 6 h 1 d 3 d 5 d PDGF-AB(pg/mL)TGF-β(ng/mL)VEGF(pg/mL)1 869.27 ± 96.76 2 178.51 ± 113.66 1 862.39 ± 96.87 1 566.26 ± 22.01 899.29 ± 16.15 2.71 ± 0.15 4.56 ± 0.17 6.84 ± 0.39 3.33 ± 1.35 2.75 ± 0.17 54.35 ± 2.25 72.56 ± 2.24 36.41 ± 2.00 31.13 ± 2.04 22.84 ± 2.65 1 752.43 ± 76.81 1 997.03 ± 53.75 2 176.64 ± 42.22*2 541.30 ± 97.45*2 153.16 ± 118.68*2.98 ± 0.58 5.83 ± 0.09*9.75 ± 0.44*11.77 ± 1.28*6.40 ± 0.84*69.89 ± 2.95*80.92 ± 1.66*43.29 ± 1.08*40.33 ± 1.75*23.39 ± 1.81 69.19 ± 0.64*88.96 ± 1.83*△43.13 ± 2.37*41.91 ± 2.21*33.66 ± 1.99*△1 799.55 ± 44.77 2 053.15 ± 67.65 2 769.87 ± 46.07*△3 247.44 ± 103.63*△2 397.93 ± 115.51*3.58 ± 0.13 6.81 ± 0.32*△12.40 ± 1.04*△16.10 ± 0.69*△11.64 ± 0.91*△
表2 各PRF条件培养基制备5 d内PDGF-AB、TGF-β、VEGF总释放水平比较()
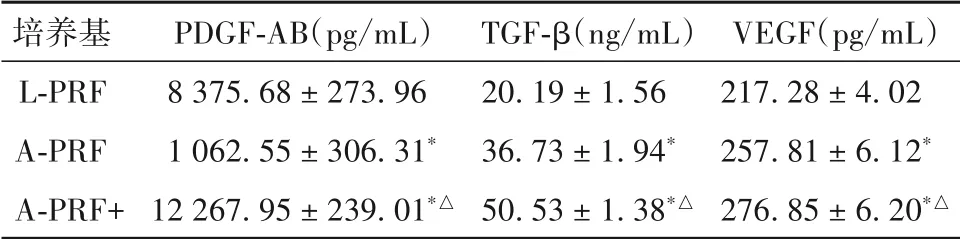
表2 各PRF条件培养基制备5 d内PDGF-AB、TGF-β、VEGF总释放水平比较()
注:与L-PRF相比,*P<0.05;与A-PRF相比,△P<0.05。
培养基L-PRF A-PRF A-PRF+VEGF(pg/mL)217.28 ± 4.02 257.81 ± 6.12*276.85 ± 6.20*△PDGF-AB(pg/mL)8 375.68 ± 273.96 1 062.55 ± 306.31*12 267.95 ± 239.01*△TGF-β(ng/mL)20.19 ± 1.56 36.73 ± 1.94*50.53 ± 1.38*△
表3 各组培养不同时间细胞增殖能力比较()
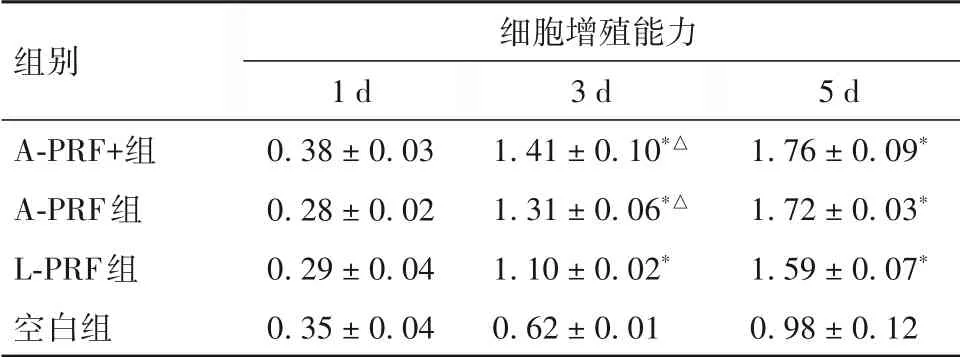
表3 各组培养不同时间细胞增殖能力比较()
注:与空白组相比,*P<0.05;与L-PRF组相比,△P<0.05。
组别A-PRF+组A-PRF组L-PRF组空白组细胞增殖能力5 d 1.76 ± 0.09*1.72 ± 0.03*1.59 ± 0.07*0.98 ± 0.12 1 d 0.38 ± 0.03 0.28 ± 0.02 0.29 ± 0.04 0.35 ± 0.04 3 d 1.41 ± 0.10*△1.31 ± 0.06*△1.10 ± 0.02*0.62 ± 0.01
3 讨论
随着整复学科的迅速发展,自体血液提取物开始推广应用。PRF 作为第二代血富血小板制品,相较于PRP,其无需使用如抗凝剂等的添加剂,三维空间网状结构可容纳更多生长因子,制备简单,并且还提供了三维纤维蛋白基质,可用作多种程序的支架,在引导性骨再生和引导性组织再生程序中发挥屏障膜功能[10]。鉴于这些优点,PRF 已被广泛应用于创面修复、齿槽裂骨修复等领域[11-12]。
PRF 富含多种生长因子,血小板内的α 颗粒被激活后,会缓慢释放多种生长因子,包括PDGF-AB、TGF-β、VEGF,PDGF 和TGF-β 可刺激成纤维细胞迁移并上调整联蛋白受体的表达,而VEGF 在创面愈合过程中可刺激新生血管生长[13]。这些因子之间相互平衡制约,在组织愈合过程中都发挥着重要的作用[14]。近年研究报道,低速离心条件制备的A-PRF、A-PRF+更有利于纤维蛋白内多种生长因子的释放。研究发现,L-PRF、PRP、A-PRF+三者比较,以A-PRF+的生长因子释放量更高[15]。也有学者报道,减少相对离心力则PRF生长因子释放能力更强[16]。GHANAA⁃TI等[7]认为,过高的离心速度会导致白细胞和其他生长因子损失,利用较低的离心速度有助于提高白细胞和生长因子的数量。然而DOHAN EHRENFEST等[17]的研究表明,较高离心力制备出的L-PRF的结构更加稳定,所释放的生长因子含量更高。上述实验结果的差异可能与PRF制作工艺的选择有关。
本研究利用不同相对离心力及离心时间分别制备得到L-PRF、A-PRF、A-PRF+,并将其置于不同的培养基中获得PRF 条件培养基,利用ELISA 法测定各时间段的培养基生长因子释放情况及累计释放总量,结果显示,制备5 d 内A-PRF、A-PRF+培养基PDGF-AB、TGF-β、VEGF 总体释放水平高于L-PRF培养基,提示A-PRF、A-PRF+培养基的PDGF-AB、TGF-β、VEGF 释放能力强于L-PRF 培养基,且以APRF+培养基作用最强。进一步利用富含PRF 渗出液的培养基培养成纤维细胞,观察其增殖、迁移能力的变化。A-PRF+组、A-PRF 组、L-PRF 组培养3、5 d时细胞增殖能力均高于空白组,且培养3 d 时A-PRF+组、A-PRF 组细胞增殖能力高于L-PRF 组;L-PRF 组、A-PRF 组、A-PRF+组穿膜细胞数高于空白组,且A-PRF 组、A-PRF+ 组穿膜细胞数高于L-PRF 组。这提示在组织修复的过程中,较低的离心力制备得到的PRF 能够更加有效地促进成纤维细胞于创口处大量募集与增殖,促进创面愈合。
结合上述研究结果,我们认为,通过降低相对离心力制备得到的A-PRF+和A-PRF的生长因子释放性能、促进成纤维细胞增殖和迁移的作用明显强于L-PRF,且适当缩短离心时间得到的A-PRF+作用更强。

