超顺磁性聚乙烯亚胺纳米粒的制备及其骨肉瘤细胞、组织靶向转染效果观察
岑超德,张永,罗聪,陈韬,杨晓兰,曹永飞,刘承伟
1 贵州省骨科医院,贵阳550000;2 贵阳市第一人民医院;3 重庆医科大学附属儿童医院;4 重庆医科大学
骨肉瘤是儿童和青少年最常见的恶性骨肿瘤之一,传统治疗方法并未使患者生存率得到明显改善[1],基因治疗的兴起给骨肉瘤的治疗带来了新的希望[2-3]。基因治疗的关键在于选择安全有效的基因载体。由于病毒载体可引发机体炎症反应和基因突变等,目前对非病毒载体研究较多[4]。然而,绝大部分的非病毒载体并不能很好地转染骨肉瘤细胞,非病毒基因载体的非特异性转染对健康细胞的毒性较大。探寻一种简单、快速、可控的方法使治疗基因进入靶细胞内高效表达对于提高基因治疗的效果和特异性有重要意义。磁辅助转染技术由于其对细胞伤害小、转染效率高而备受研究者的青睐[5]。骨肉瘤的配体靶向治疗及免疫治疗是研究热点,但价格昂贵、效果差异大[6-7]。目前,将治疗基因与磁转染结合的磁靶向基因治疗技术相关报道较少。2019年8 月—2020 年8 月,本研究将低分子量聚乙烯亚胺(PEI)修饰超顺磁性氧化铁纳米粒(SPION),赋予PEI 磁靶向性,制备超顺磁性聚乙烯亚胺纳米粒(PEI-SPION-NPs),观察其体内外对骨肉瘤细胞和组织的靶向转染效果。
1 材料与方法
1.1 主要实验材料 雄性BALB/C 裸鼠30 只(6~8周龄,15~18 g),购自中国重庆医科大学动物中心,饲养于IVC 无菌、温度可控环境。 骨肉瘤细胞MG-63 和pReceiver-M29-VEGF165/DH5a 由 重 庆 医科大学附属儿童医院儿科研究所905 干细胞实验室提供。SPION、分子量为20 000 的PEI 粉末及Hoch⁃est33324 试 剂 购 自 美 国Sigma 公 司。 Lipo⁃fectamine2000 购自美国Stemcell 公司。商业化磁转染试剂PolyMag-200、24 孔培养磁板购自Chemicell公司。EDC和NHS购自西亚试剂公司。CCK-8测试盒购自七海生物科技有限公司。RBIIC 购自上海阿拉丁试剂有限公司。Lyso-Tracker-Green DND-26 购自上海伟进生物科技有限公司。Endo-free Plasmid Max Kit25试剂盒购自美国OMEGA 公司。振动样品磁强计及Zetasizer2000 型Zeta 电势粒径分析仪购自英国马尔文公司。原子力显微镜由重庆大学电气工程学院自主研发。激光共聚焦显微镜购自德国Leica 公司。透射电镜购自日本Hitachi 公司。流式细胞仪购自美国BD 公司。活体成像仪购自美国Caliper公司。
1.2 PEI-SPION-NPs 的制备及表征检测 配制PEI溶液(1 mg/mL)和SPION溶液,参照NAMGUNG 等[8]的方法制备PEI-SPION-NPs。具体方法:调节SPION溶液pH 为5,搅拌下加入EDC 0.1 g 和NHS 0.5 g 活化纳米颗粒表面的羧基,然后加入等体积的PEI 溶液,室温条件下持续搅拌4~6 h。最后经截留分子量为20 000 的透析袋持续透析2 d,收集PEI-SPIONNPs,部分冷冻干燥备用。用原子力显微镜分析PEI-SPION-NPs 的分子结构,透射电镜观察粒径,振动样品磁强计测饱和磁化强度,电势粒径测量仪测定Zeta电位。
1.3 PEI-SPION-NPs 对pDNA 结合及保护作用观察 取适量PEI-SPION-NPs 溶液与定量pDNA(2µg)分别按N∶P 为1∶5、1∶1、5∶1、10∶1、15∶1、20∶1、25∶1 及30∶1 的比例于37 ℃、5% CO2条件下混合孵育20 min。配制1% 琼脂糖凝胶于90 mV 条件下电泳30 min,观察PEI-SPION-NPs 的DNA 结合能力。参照上述方法,在PEI-SPION-NPs 溶液中加入1/10体积的反应缓冲液,然后加入DNase-Ⅰ(2 U/µL)2 µL于37 ℃、5% CO2条件下孵育30 min 消化pDNA。向复合物中加入EDTA 溶液至终浓度为2.5 mmol/L,65 ℃加热10 min 使DNase-I 失活。最后,在复合物中加入肝素钠(1 mg/mL)4 µL 并室温放置3 h,使pDNA 从PEI-SPION-NPs 中释放,1% 琼脂糖凝胶电泳观察pDNA的完整性。
1.4 PEI-SPION-NPs 对MG-63 细胞毒性作用观察MG-63 细胞以4×103/孔接种于96 孔板中,于37 ℃、5% CO2、95% 相对湿度条件下培养直至细胞完全贴壁生长。转染前将培养基吸走,PBS 清洗2 遍,每孔加入无添加培养基100 µL。将细胞分为4个组。实验1 组加入无添加培养基配制的PEI-SPION-NPs/pDNA(N∶P 为10∶1)各50 µL;实 验2 组 加 入PolyMag200/pDNA;实验3 组加入无添加培养基配制的PEI/pDNA(N∶P 为10∶1)50 µL;对照组只加入pDNA。空白孔加入生理盐水50 µL。实验1组和实验2组的培养板于磁场上作用20 min,实验3组和对照组不经磁场作用。各组转染4~6 h 后用100 µL 的PBS(100 mmol/L,pH 7.4)清洗2 遍,弃掉未被吞噬的复合物。每孔加入培养基总体积10% 的CCK-8溶液继续培养2 h,用采用ELISA 法检测450 nm 波长处的光密度(OD)值。用公式计算细胞存活率。细胞存活率=(实验组OD 值-空白组OD 值)/(对照组OD值-空白组OD值)×100%。
1.5 PEI-SPION-NPs/pDNA 转染MG-63 细胞观察MG-63 细胞以3.0×105/孔接种于24 mm 的玻底皿中,加入含10% 血清培养基2 mL 于37 ℃、5% CO2、95% 相对湿度条件下培养。行示踪实验前1 h,将培养孔中血清培养基弃掉,加入无添加培养基1 mL。将细胞分为4 个组。实验1 组在避光条件下每孔加入RBITC 标记的PEI-SPION-NPs 200 µL,实验2 组加入PolyMag200/pDNA,实验3 组加入RBITC-PEI/pDNA 200 µL,对照组只加入pDNA。实验1 组、实验2组给予静磁场干预30 min,实验3组和对照组不进行静磁场干预。继续培养3 h 后用PBS 清洗2 遍,加入含10% 血清新鲜培养基2 mL。分别于6、12、24 h后吸走培养基,PBS清洗2遍,用Hochest3342进行细胞核染色5 min,PBS轻轻洗涤2遍,然后加入含0.5 µmol/L LysoTracker Green DND-26 的荧光探针工作液孵育1 h,PBS 洗涤2 遍后用激光共聚焦显微镜在激发光与发射光波长下观察细胞。于12 孔板中培养MG-63 细胞,分组操作参考“1.4”。转染4~6 h后用PBS缓冲液清洗3遍,弃掉未被吞噬的纳米颗粒;继续培养至24 h,收集细胞,用流式细胞仪检测转染率,实验重复3次。
1.6 PEI-SPION-NPs/pDNA 转染裸鼠骨肉瘤组织观察 BALB/C 裸鼠背部皮肤以碘伏消毒后,于皮下注入1.0×106个MG-63 细胞制作骨肉瘤模型,注射部位1 个月左右长成直径为10 mm 的肿瘤包块。将裸鼠分为Control 组、PEI-SPION-NPs 组、PEI-NPs组,每组6只。PEI-SPION-NPs组、PEI-NPs组分别向肿瘤组织内注射5% 葡萄糖溶液配制的PEI-SPIONNPs/pGL3-Luc 复合物、PEI/pGL3-Luc 复合物各100µL,Control 组向肿瘤组织内注射生理盐水100 µL,于肿瘤表面粘贴小磁块,磁场作用30 min(磁场强度为2 000 Gs)。48 h 后经裸鼠腹腔内注射荧光素酶底物luciferin(2 µg/µL)200 µL,异氟烷气体麻醉裸鼠,快速用活体成像仪观察注射部位的荧光强度。分别于造模第5、6、7、8、9周测量各组裸鼠体质量。
1.7 统计学方法 采用SPSS19.0 统计软件。计量资料以表示,多组比较采用方差分析,组间两两比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 PEI-SPION-NPs 的表征 原子力显微镜下,PEI-SPION-NPs 氨基基团与pDNA 脱氧核苷酸链中磷酸基团通过静电吸附的方式进行结合。PEI-SPI⁃ON-NPs 的饱和磁化强度为(21.5 ± 1.6)emu/g,剩磁接近0.0 emu/g,说明静磁场可促进其快速有效浓聚,而退出磁场后纳米粒无磁性,不会发生团聚。透射电镜下可见PEI-SPION-NPs呈类圆形,粒径为(32 ±3.6)nm;而PEI-SPION-NPs/pDNA 由多个铁核组成的不规整状,粒径为(115 ± 21.7)nm(图1A、B)。PEI-SPION-NPs 的Zeta 电位为(31.2 ± 1.5)mV,可作为基因载体携载负电荷的pDNA 转染细胞,纳米颗粒间因相同电荷而相互排斥,避免纳米颗粒团聚,有利于维持其稳定性。
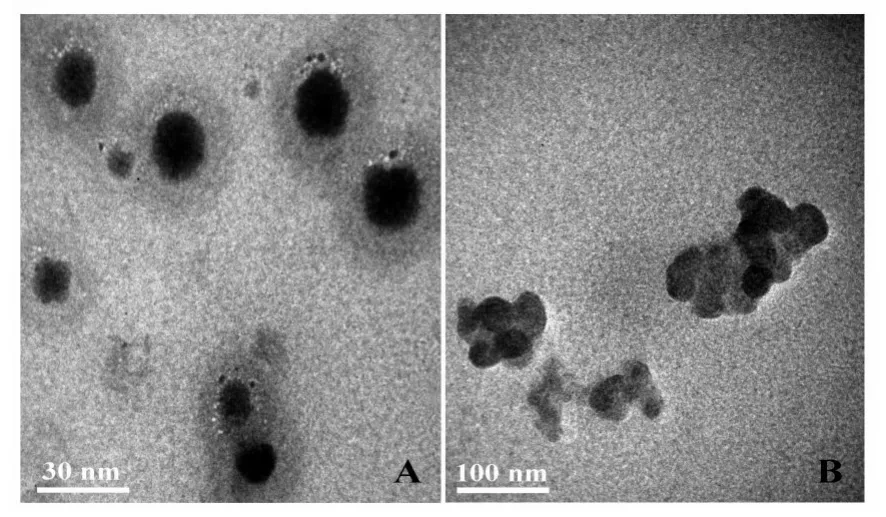
图1 透射电镜下PEI-SPION-NPs及PEI-SPION-NPs/pDNA复合物的形状和大小
2.2 PEI-SPION-NPs 对pDNA 的结合及保护作用当N∶P 高于5∶1 时,pDNA 的条带消失,PEI-SPIONNPs 完全结合质粒。见图2。当N∶P 高于5∶1 时,核酸酶降解过程终止后,被PEI-SPION-NPs完全结合的pDNA 在肝素钠作用下释放,显示条带完整。PEISPION-NPs可保护pDNA不被核酸酶降解。见图3。

图2 PEI-SPION-NPs与pDNA结合实验结果
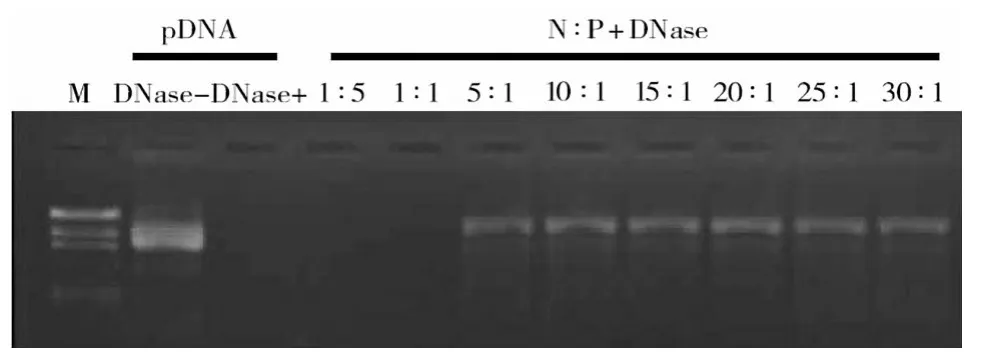
图3 PEI-SPION-NPs对pDNA的保护作用实验结果
2.3 PEI-SPION-NPs的细胞毒性 见表1。
表1 转染后不同时点各组MG-63细胞的存活率(%)
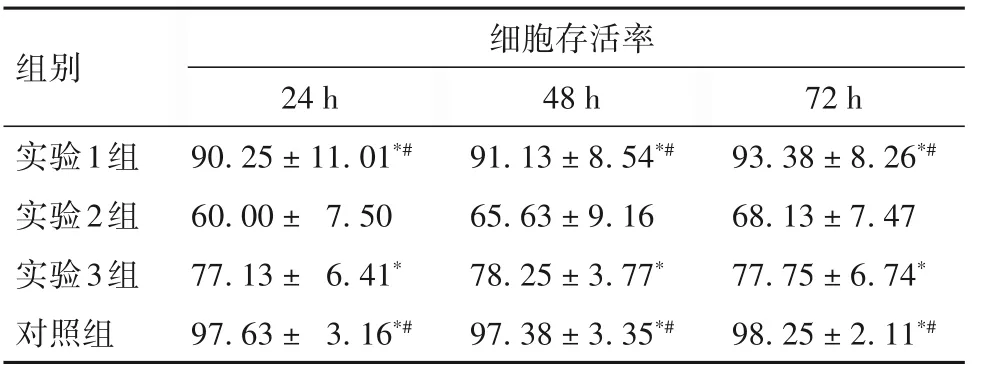
表1 转染后不同时点各组MG-63细胞的存活率(%)
注:与实验2组相比,*P<0.05;与实验3组相比,#P<0.05。
组别实验1组实验2组实验3组对照组细胞存活率72 h 93.38 ± 8.26*#68.13 ± 7.47 77.75 ± 6.74*98.25 ± 2.11*#24 h 90.25 ± 11.01*#60.00 ± 7.50 77.13 ± 6.41*97.63 ± 3.16*#48 h 91.13 ± 8.54*#65.63 ± 9.16 78.25 ± 3.77*97.38 ± 3.35*#
2.4 PEI-SPION-NPs/pDNA 转 染MG-63 细 胞效果转染后6 h,实验1 组较实验3 组出现较多的红色荧光(RBITC 标记的PEI-SPION-NPs 或PEI-NPs)与绿色荧光(pDNA 表达)重叠后产生的黄色荧光区域(共定位区域)。转染后12 h,大部分的红色荧光从绿色荧光中扩散,出现在代表细胞核的蓝色荧光区域周围,其中实验1 组较实验3 组明显[9]。转染后24 h,可见某些细胞核中出现少许红色荧光,细胞中绿色荧光达到高峰,实验1组较实验3组绿色荧光表达更强。实验1组、实验2组、实验3组、对照组转染24 h 后 转 染 率 分 别 为18.8% ± 2.4%、17.3% ±1.3%、4.0% ± 1.2%、0.1% ± 0.05%,实验1 组转染效率高于实验3组和对照组(P均<0.05)。
2.5 PEI-SPION-NPs/pDNA 转染裸鼠骨肉瘤组织效果 PEI-SPION-NPs/pGL3-Luc 与PEI-NPs/pGL3-Luc 均可在裸鼠骨肉瘤组织中成功转染。PEI-SPI⁃ON-NPs 组较PEI-NPs 组荧光更为集中。见图4。PEI-SPION-NPs 组和Control 组造模第5、6、7 周裸鼠体质量逐渐增长,造模第7 周体质量逐渐下降。而PEI-NPs 组造模第6 周体质量达到高峰,6 周后开始下降。造模第7 周后PEI-SPION-NPs 组裸鼠体质量高于PEI-NPs组(P均<0.01)。见表2。
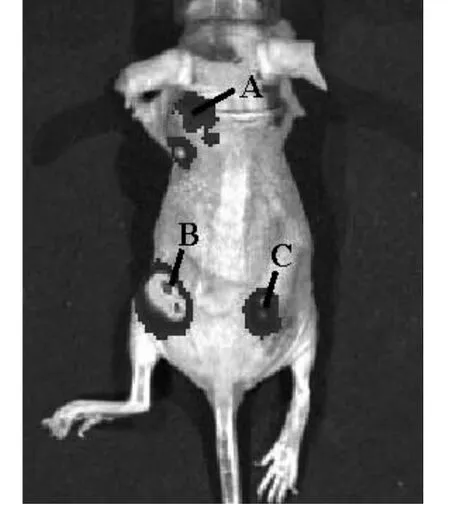
图4 PEI-SPION-NPs/pGL3-Luc转染裸鼠骨肉瘤组织效果
表2 造模不同时间各组裸鼠体质量比较(g,)
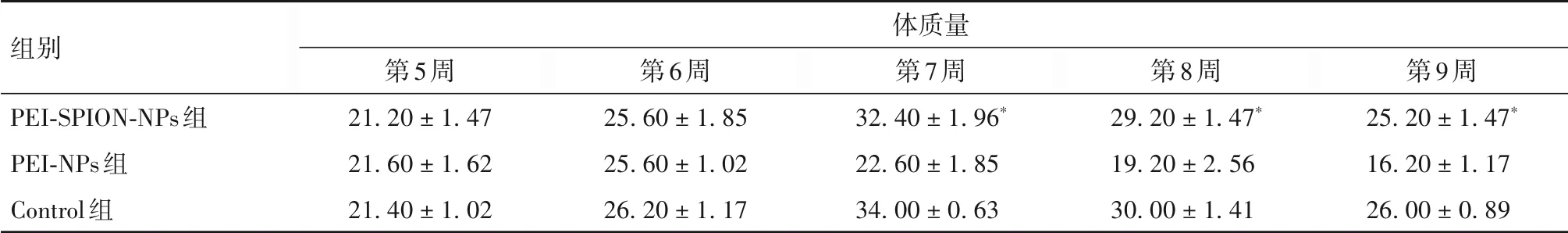
表2 造模不同时间各组裸鼠体质量比较(g,)
注:与造模相同时点的PEI-NPs组相比,*P<0.01。
组别PEI-SPION-NPs组PEI-NPs组Control组体质量第9周25.20 ± 1.47*16.20 ± 1.17 26.00 ± 0.89第5周21.20 ± 1.47 21.60 ± 1.62 21.40 ± 1.02第6周25.60 ± 1.85 25.60 ± 1.02 26.20 ± 1.17第7周32.40 ± 1.96*22.60 ± 1.85 34.00 ± 0.63第8周29.20 ± 1.47*19.20 ± 2.56 30.00 ± 1.41
3 讨论
骨肉瘤的治疗方法主要包括外科保肢手术治疗、新辅助化疗、分子靶向治疗及免疫治疗[10]。随着分子生物学研究进展,学者们开展了抗肿瘤血管生成、促进肿瘤细胞凋亡等多种基因治疗的研究[11]。基因治疗的关键是选择安全有效的基因载体,其难点是缺乏靶向性。靶向基因输送载体具有使基因靶向性地输送至特定器官或组织、减少组织不良反应、提高基因利用率的优势。常用的肿瘤靶向基因治疗技术主要包括配体靶向、超声微泡靶向及磁转染等[12-13]。
高效结合并保护核酸、体积小、可通过细胞膜进入细胞有效表达是基因载体的必要条件。本实验制备的PEI-SPION-NPs 具备粒径小、正电位、可结合并保护负电位的质粒DNA 免受核酸酶降解的特性。此外,经过SPION 修饰的PEI-SPION-NPs 具备一定的磁响应性。磁响应性是靶向的前提,也是提高转染率的关键。本研究体外细胞转染结果表明,PEISPION-NPs 在外加磁场的情况下比PEI 具有更高的转染效率。转染示踪实验结果显示,PEI-SPION-NPs主要是通过快速沉积基因载体、提高细胞表面有效载体浓度、增加单位面积细胞内吞载体数量从而推动细胞转染进程,提高核酸及载体的利用率。
本研究各组细胞存活率和裸鼠体质量变化结果表明,PEI-SPION-NPs的细胞毒性与PEI的细胞毒性存在明显差异,磁化后PEI-NPs 的细胞毒性降低,可见SPION 的修饰是安全的。研究表明,PEI 的细胞毒性主要是由“质子海绵效应”产生的[14],带正电荷的PEI 可增加细胞膜的通透性,破坏线粒体和核膜的完整性,促进线粒体质子释放,以剂量和时间依赖性的方式抑制电子传递链[15]。此外,PEI 的细胞毒性可能与其诱导的“细胞自噬”有关[16]。SPION 表面带负电荷的羧基部分中和了PEI 的正电荷,因此降低了其细胞毒性。PEI-SPION-NPs 良好的细胞相容性初步体现了其在体内的适用价值。
以往的研究显示,PEI 可携载基因在动物体内表达,但对其磁靶向输送方面的研究甚少[17]。本研究体内转染实验结果显示,PEI-SPION-NPs 可携载基因在裸鼠骨肉瘤组织中成功表达,磁场作用下表达的荧光比较集中,说明外加磁场可抑制基因载体的扩散,促进基因的区域高效表达,降低基因载体的全身反应性。因此,PEI-SPION-NPs 具有粒径小、低毒性及磁响应性,可实现将基因安全地靶向输送到细胞和组织的目的,有望成为一种新的基因载体投入应用。下一步我们将对PEI-SPION-NPs 进行表面改性,增加其组织相容性、循环隐蔽性及立体稳定性,探究其在全身循环中的主动靶向应用性能。

