长链非编码RNA DDX11-AS1对肝癌细胞增殖、侵袭能力的影响及其机制
羊丹,徐菁,陈保银,马竹芳
三二〇一医院,陕西汉中723000
肝细胞癌(HCC)是肝脏肿瘤最常见的类型[1-2]。现有的治疗方法对晚期HCC患者的疗效有限[3]。增殖和转移被认为是恶性肿瘤两个最重要的生物学特征,是肿瘤进展的重要原因[4]。研究HCC 进展相关机制将有助于进一步探索新的治疗靶点。长链非编码RNA(lncRNA)已被证明与HCC 的进展有关,随着高通量测序等技术的发展,越来越多新的lncRNA被发现[5]。DEAD/DEAH 盒解旋酶11 反义RNA1(DDX11-AS1)是与肿瘤密切相关的lncRNA之一,在胃癌、食管癌和骨肉瘤等多种肿瘤中高表达[6-8]。SHI 等[9]研究发现,DDX11-AS1 在HCC 中表达上调,与患者预后不良相关,可能是HCC 治疗的潜在靶点。但DDX11-AS1是否与HCC的增殖和侵袭相关,目前仍不明确。2018 年8 月—2020 年1 月,本研究观察了DDX11-AS1对HCC细胞增殖和侵袭的影响,并探讨可能机制。现报告如下。
1 材料与方法
1.1 细胞与主要实验材料 人HCC 细胞HepG2、Huh-7、SK-hep-1 及正常肝细胞LO2 购自中国科学院。DMEM 高糖培养基和胎牛血清购自美国Gibco公司。TRIzol 试剂购自日本TaKaRa 公司。ULtraRT一步法RT-PCR 试剂盒购自北京百奥莱博公司。DDX11-AS1 siRNA 购自广州锐博生物生物技术有限公司。MTS 试剂购自美国Biovision 公司。Tran⁃swell小室购自美国Coring公司。蛋白裂解液和蛋白浓度检测试剂盒购自上海碧云天生物有限公司。PI3K、pPI3K、AKT、pAKT 和GAPDH 抗体购自英国Abcam 公司。PI3K/AKT 信号通路激活剂SC79购自皓元生物技术有限公司。
1.2 不同HCC 细胞DDX11-AS1 检测 将HepG2、Huh-7、SK-hep-1 及LO2 细胞接种于含10% 胎牛血清的基础培养基中,于37 ℃、5% CO2全湿培养箱中培养。细胞长满时弃掉培养基,PBS 洗3 次,加入TRIzol 试剂,完全裂解细胞,并依次加入氯仿、异丙醇和无水乙醇离心后获取细胞中总RNA。按照RTPCR 试剂盒说明书将RNA 逆转录为cDNA,并继续进行扩增。PCR 反应体系包括2×ULtraRT one step Buffer 25 µL、ULtraRT one step EnzymeMix 1 µL、上下游引物各2 µL、RNA 1 µL,用无RNA 酶的双蒸水补足50 µL。反应条件:逆转录45 ℃30 min,PCR 预变性95 ℃5 s,变性94 ℃5 s,退火65 ℃30 s,延伸72 ℃30 s,变性、退火、延伸共40 个循环。以2-∆∆Ct计算DDX11-AS1 相对表达量。DDX11-AS1 上游引物序列为5"-TTAGGAGGACAACGAATCACCTC-3",下游引物序列为5"-GTCATCTCCCAGAACCAGACTTT-3"。内参GAPDH 上游引物序列为5"-TGAAGGTCG⁃GAGTCAACGGATTT-3",下游引物序列为5"-GCCATG⁃GAATTTGCCATGGGTGG-3"。
1.3 干扰DDX11-AS1 表达对HCC 细胞增殖、侵袭能力的影响观察
1.3.1 细胞分组及转染 取“1.2”中DDX11-AS1表达水平相对较高的HCC 细胞,以1.0×105/孔铺至6孔板中,培养至细胞贴壁。将HCC细胞分为对照组和实验组,分别转染NC siRNA和DDX11-AS1 siRNA,于培养箱中继续培养。转染48 h后,采用qRT-PCR法测得对照组、实验组细胞中DDX11-AS1 相对表达量分别为1.02 ± 0.04、0.35 ± 0.08,提示DDX11-AS1 siRNA可以抑制HCC细胞中DDX11-AS1的表达。
1.3.2 细胞增殖能力观察 细胞增殖率测算:收集两组细胞,以2×103/孔接种于96孔板中,每组设置5个复孔,放置培养箱中培养;48 h后每孔更换培养基100 µL,并加入MTS 试剂20 µL,在培养箱中孵育2 h,酶标仪检测各孔490 nm 处的光密度(OD)值;以实验组OD 值/对照组OD 值×100% 计算细胞增殖率。细胞克隆形成率测算:收集两组细胞,以2×103/孔接种于6 孔板中,每组设置3 个复孔,在培养箱中培养,每隔2 d 更换1 次新鲜培养基;待肉眼可见的细胞克隆团形成时终止细胞培养,PBS 洗3 次,甲醇溶液固定10 min,吉姆萨染色,干燥后计数细胞克隆团;以实验组克隆团数/对照组克隆团数×100% 计算细胞克隆形成率。
1.3.3 细胞侵袭能力观察 收集两组细胞,以无血清培养基洗3 次,制备为1×106/mL 的无血清细胞重悬液,每组设置3 个复孔。取细胞重悬液100 µL 加至Transwell 小室的上室膜上,含10% 胎牛血清的培养 基500 µL 加 至Transwell 小 室 的 下 室 中,并 将Transwell小室放入下室中。放置细胞培养箱中培养10 h 后终止培养,PBS 将未穿膜的细胞洗去,甲醇溶液固定10 min,吉姆萨染色,显微镜下计数穿膜细胞数表示细胞侵袭能力。
1.3.4 细胞中PI3K/AKT 信号通路蛋白检测 收集两组细胞,加入RIPA 蛋白裂解液,冰上震荡裂解30 min。4 ℃、14 000 r/min 离心30 min,去除细胞碎片,获得细胞总蛋白。检测蛋白浓度,加入上样缓冲液煮沸变性,80 V 电压下行蛋白电泳分离2 h,于350 mA将蛋白转至PVDF膜上,5% 脱脂牛奶常温孵育1 h。加入PI3K、pPI3K、AKT、pAKT 和GAPDH 一抗4 ℃孵育过夜,加入兔二抗室温孵育2 h。TBST洗3次后,采用ECL 超敏化学发光曝光条带,Image J软件分析蛋白灰度值。
1.4 SC79对DDX11-AS1作用的干预观察
1.4.1 HCC 细胞分组及处理 将HCC 细胞分为NC 组、si-DDX11-AS1 组 和SC79 组,NC 组转染NC siRNA,si-DDX11-AS1 组 和si-DDX11-AS1+SC79 组转染DDX11-AS1 siRNA。SC79组细胞加入5 µmol/L的SC79 10 µL,NC 组 和si-DDX11-AS1 组 加 入DMSO 10 µL,作用48 h后进行后续实验。
1.4.2 细胞增殖能力观察 收集三组细胞,采用MTS法检测各组细胞增殖能力。方法参照“1.3.2”。
1.4.3 细胞侵袭能力观察 收集三组细胞,采用Transwell 实验检测细胞侵袭能力。 方法参照“1.3.3”。
1.5 统计学方法 采用SPSS17.0 统计软件。计量资料以表示,两组比较采用t检验,多组比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 HCC 细胞中DDX11-AS1 表达变化 HepG2、Huh-7、SK-hep-1、LO2 细胞中DDX11-AS1 相对表达量分别为7.28 ± 0.78、3.55 ± 0.54、5.08 ± 0.12、1.00 ± 0.02,HepG2、Huh-7、SK-hep-1 细 胞 中DDX11-AS1 表达高 于LO2 细 胞,其中HepG2 细胞DDX11-AS1表达量最高(P均<0.05)。
2.2 干扰DDX11-AS1 表达对HCC 细胞增殖、侵袭能力的影响 实验组细胞增殖率、克隆形成率、穿膜细胞数及细胞中pPI3K、pAKT 蛋白表达均低于对照组(P均<0.05)。见表1、表2。
2.3 SC79 激 活PI3K/AKT 通路 对si-DDX11-AS1 组HCC 细胞增殖、转移能力的影响 SC79 组、si-DDX11-AS1 组细胞增殖率和穿膜细胞数低于NC组,SC79 组细胞增殖率和穿膜细胞数高于si-DDX11-AS1组(P均<0.05)。见表3。
表1 实验组与对照组细胞增殖、侵袭能力指标比较()
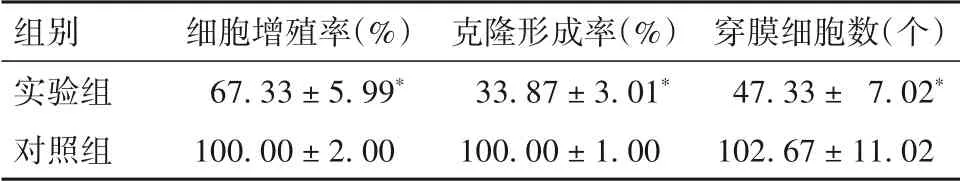
表1 实验组与对照组细胞增殖、侵袭能力指标比较()
注:与对照组相比,*P<0.05。
组别实验组对照组穿膜细胞数(个)47.33 ± 7.02*102.67 ± 11.02细胞增殖率(%)67.33 ± 5.99*100.00 ± 2.00克隆形成率(%)33.87 ± 3.01*100.00 ± 1.00
表2 实验组与对照组细胞中PI3K/AKT信号通路蛋白表达比较()
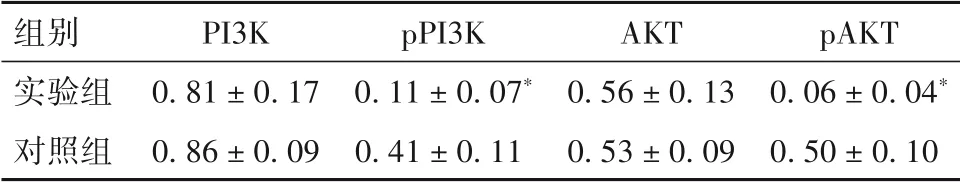
表2 实验组与对照组细胞中PI3K/AKT信号通路蛋白表达比较()
注:与对照组相比,*P<0.05。
组别实验组对照组pAKT 0.06 ± 0.04*0.50 ± 0.10 PI3K 0.81 ± 0.17 0.86 ± 0.09 pPI3K 0.11 ± 0.07*0.41 ± 0.11 AKT 0.56 ± 0.13 0.53 ± 0.09
表3 SC79组、si-DDX11-AS1组、NC组细胞增殖、侵袭能力指标比较()

表3 SC79组、si-DDX11-AS1组、NC组细胞增殖、侵袭能力指标比较()
注:与NC组相比,*P<0.05;与si-DDX11-AS1组相比,#P<0.05。
组别SC79组si-DDX11-AS1组NC组穿膜细胞数(个)72.67 ± 7.51*#39.33 ± 15.01*112.33 ± 19.08细胞增殖率(%)76.20 ± 5.92*#60.21 ± 8.06*100.00 ± 5.00
3 讨论
HCC 是病死率很高的消化系统恶性肿瘤,发病率呈逐年上升趋势[1]。肝切除、肝移植、局部消融治疗和经动脉化学栓塞等疗法广泛用于HCC 的治疗[10],但HCC 的恶性程度较高,常复发和转移,导致HCC 患者的预后较差[3]。HCC 的发病机制很复杂,涉及多种因素,包括乙型或丙型肝炎病毒感染、黄曲霉毒素等暴露、饮酒过量、遗传和表观遗传学等改变[11-12],确切的发病机制仍不明确。深入研究HCC发生发展的分子机制,对于开发有效治疗干预措施、改善HCC患者预后至关重要。
lncRNA 是一种长度超过200 个核苷酸的RNA,由于其缺少完整的开放阅读框,不具有编码蛋白质的功能[13]。lncRNA 参与人体多个生理过程的调节,其表达失调与肿瘤的发生和发展有关,这使得ln⁃cRNA 有望成为恶性肿瘤诊断和治疗的靶点[14]。DDX11-AS1 是DDX11 的反义RNA,DDX11 是一种DNA 依赖性的ATPase 和解旋酶,参与DNA 复制和姐妹染色单体的内聚,而DDX11-AS1 可以调节DDX11 的活性,因此DDX11-AS1 是DNA 复制和细胞周期进程所必需的[15]。研究发现,DDX11-AS1 的异常表达可导致肿瘤的恶性进展。SHI 等[9]采用生物学信息分析技术发现HCC 组织中DDX11-AS1 高表达,并预示较差的预后,与HCC 恶性进展相关。本研究首先检测了DDX11-AS1 在HCC 细胞中的表达 情 况,发 现HepG2、Huh-7、SK-hep-1 细 胞 中DDX11-AS1 表达均高于正常肝细胞,与大数据分析的结果一致[9]。选择DDX11-AS1 表达相对较高的HepG2 细胞转染DDX11-AS1 siRNA,检测结果发现,抑制DDX11-AS1 表达后,HCC 细胞的增殖能力和转移能力均降低,与膀胱癌和结直肠癌等肿瘤中DDX11-AS1 表达的相关研究结果一致[16-17]。这表明DDX11-AS1表达上调可促进HCC的恶性进展。
现已证实DDX11-AS1 可以被癌基因MYC 激活,同时被抑癌基因p53负调控,参与肿瘤的发生发展[14]。FENG 等[18]报道,DDX11-AS1通过激活PI3K/AKT 信号通路促进非小细胞肺癌的进展。PI3K/AKT 信号通路对细胞分化、增殖、凋亡等均具有重要的调控作用,且PI3K/AKT 信号通路与HCC 发病关系密切。PI3K 是一种细胞内磷脂酰肌醇激酶,其磷酸化水平的提高与肿瘤的发生发展有关。而其下游信号分子AKT 在HCC 中处于激活状态[19]。抑制PI3K/AKT 信号通路激活,肿瘤的增殖和转移受到抑制,因此PI3K/AKT 信号通路被认为是抗肿瘤治疗的有效靶点。本研究发现,抑制DDX11-AS1 表达后,HCC 细胞中pPI3K 和pAKT 蛋白表达降低,表示PI3K/AKT 信号通路的激活受到抑制。 SC79 是PI3K/AKT 信号通路激活剂,可以增加PI3K 磷酸化水平。为了进一步研究DDX11-AS1是否通过PI3K/AKT 信号通路促进HCC 细胞的增殖和侵袭能力,我们以SC79 处理DDX11-AS1 表达受到抑制的HCC 细胞,观察结果显示,SC79 可以使因DDX11-AS1 表达降低而导致增殖、侵袭能力受抑制的HCC 细胞的恶性生物学行为得到部分恢复,提示DDX11-AS1 可能通过激活PI3K/AKT 信号通路促进HCC 的恶性进展。
综上所述,HCC 细胞中DDX11-AS1 表达上调;干扰DDX11-AS1 表达可抑制HCC 细胞的增殖和侵袭能力,其机制可能与调控PI3K/AKT 信号通路有关。DDX11-AS1有望成为抗HCC治疗的新靶点。

