长链非编码RNA MAFG-AS1通过靶向miR-143-3p/AKT2轴促进胃癌的进展
陈军芳,岳新荣,贺大春
胃癌(gastric cancer,GC)是一种常见的消化系统肿瘤,也是全球第4大最常见的恶行肿瘤[1]。近年来,尽管GC在手术治疗、靶向治疗和免疫治疗方面取得了重大进展,由于大多数GC患者首次诊断位于晚期,治疗方案有限,预后仍然很差[2]。由于GC的转移复发率较高,全球GC患者的5年生存率不足20%[3]。因此,迫切需要为GC的早期诊断和治疗寻找新的靶点。
长链非编码RNA(long non-coding RNA,lncRNA)是一种长度超过200个核苷酸的非编码RNA,近年来其在人类生理病理中的作用引起了越来越多的关注[4]。LncRNAs已被确定为癌症发展过程的关键调节因子,并参与调控肿瘤细胞的增殖、侵袭、分化和凋亡等[5]。多种失调的lncRNAs,包括HOXC-AS3、ARAP1-AS1、TRPM2-AS和GCAT18均被证明与GC的发生和进展有关[6-9]。同属于lncRNAs家族的lncRNA MAFG-AS1(后续简称为MAFG-AS1)已经被证实在多种癌症组织中发挥促癌作用,如促进肝癌和乳腺癌的增殖和转移[10-11]。重要的是,MAFG-AS1在GC中表达上调,并与患者不良预后相关[12]。然而MAFG-AS1在GC中的生物学功能和作用机制尚待研究,因此在本研究中将探究MAFG-AS1在GC中生物学功能和可能的作用机制。
本研究首次发现MAFG-AS1在GC组织中上调,并与GC患者的预后不良相关。基于此,进一步探讨MAFG-AS1在GC组织中通过调控微(microRNA,miRNA,miR)-143-3p/AKT2(AK mouse plus Transforming or Thymoma 2)轴在GC中发挥的生物学作用及其机制,以期为GC患者的临床治疗提供一条新的思路。
1 材料与方法
1.1 临床样本
收集经本院医院病理确诊的39例GC患者的癌及其配对的癌旁正常组织(距原发灶边缘3~5 cm以上的相应癌旁组织)。所有组织均在手术切除后,立即放入-80 ℃低温冰箱中保存,用于提取总RNA。所有患者均未接受放疗、化疗或靶向药物治疗。本研究已获得医院伦理委员会批准,所有患者均已签署知情同意书。
1.2 细胞、试剂及仪器
人胃黏膜正常上皮细胞GES-1和人GC细胞系BGC-823、SGC-7901和MGC-803细胞均购自美国模式菌种保藏中心(American Type Culture Collection,ATCC)。
RPMI 1640培养液购自美国Gibco公司。定点突变试剂盒购自上海玉博生物科技有限公司。荧光素酶报告基因载体pGL3-basic、携带有MAFG-AS1的重组过表达质粒及其对照空载体、miR-143-3p-模拟物(miR-143-3p-mimics)及其阴性对照-模拟物(NC-mimics)和特异性针对AKT2基因的siRNA(siAKT2)均购自美国Promega公司。TRIzol试剂和LipofectAMINETM2000试剂购自美国Invitrogen公司,反转录试剂盒和SYBR预混剂EXTAQⅡ购自日本TaKaRa公司。CCK-8试剂盒、青霉素、链霉素、胰蛋白酶、RIPA蛋白裂解液、BCA蛋白定量试剂盒和电化学显影试剂盒均购自中国上海碧云天生物技术有限公司,Transwell小室购自美国Corning公司。兔抗人AKT2和GAPDH(内参照)单克隆抗体以及辣根过氧化物酶标记的羊抗兔IgG购自英国Abcam公司。ABI7500型荧光定量PCR仪为美国ABI公司产品。
1.3 生物信息学分析
采用GEPIA(Gene Expression Profiling Interactive Analysis)(http://gepia.cancer-pku.cn/)分析MAFG-AS1在GC组织中的表达情况;使用Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/index.php)分析MAFG-AS1的表达与GC预后的关系;采用StarBase数据库(http://starbase.sysu.edu.cn)预测与MAFG-AS1结合的miRNA以及miR-143-3p下游的mRNA。
1.4 细胞培养
人胃黏膜上皮细胞GES-1细胞和人GC细胞系BGC-823、SGC-7901和MGC-803均用含10%胎牛血清和1%青霉素/链霉素的RPMI 1640培养液,置于37 ℃、CO2体积分数为5%的培养箱中进行培养。在细胞处于对数生长期时采用0.25%胰蛋白酶消化后传代,以1×106个/孔的密度接种于6孔板上,待细胞生长稳定后进行细胞转染。
1.5 细胞转染
取处于对数生长期的MGC-803细胞,按照LipofectAMINETM2000转染试剂说明书提供的流程,将空载体(对照组)和MAFG-AS1过表达重组质粒分别转染MGC-803细胞,转染48 h后采用实时荧光定量PCR法检测转染效率。
1.6 实时荧光定量PCR检测
组织处理:收集GC组织及相应癌旁正常组织,称取组织标本约100 mg置于EP管中,加入1 mL TRIzol试剂裂解组织,使用匀浆器充分研磨组织,在低温下提取组织中的总RNA。细胞处理:收集大约1×106个转染后的MGC-803细胞,用TRIzol试剂提取细胞总RNA。
采用TRIzol试剂常规提取组织和细胞的总RNA后,检测其纯度后,取部分RNA反转录为cDNA。在ABI 7500系统上,采用SYBR预混剂EXTAQⅡ进行实时荧光定量PCR扩增。以GADPH和U6作为内参照。各实验组目的基因的表达量相对于对照组的表达量变化倍数用2-ΔΔCt法计算,引物序列见表1。
1.7 CCK-8法检测细胞的增殖能力
将空载体(对照组)和MAFG-AS1过表达重组质粒(MAFG-AS1组)MGC-803细胞接种于96孔板中,每孔1×103个细胞。分别于培养24、48、72和96 h加入10 μL的CCK-8溶液,将培养板在培养箱内继续孵育4 h,随后在酶联免疫酶标仪波长450 nm处检测各孔细胞的D值。
1.8 EdU染色法检测细胞的增殖能力
实验分组同1.7节。取转染后的MGC-803细胞分别接种于24孔板中,待细胞生长至对数生长期时,每孔加入200 μL浓度为50 μmol/L的EdU染色液,于细胞培养箱内孵育2 h,PBS清洗。随后,采用4%多聚甲醛溶液固定细胞,室温孵育10 min。加入200 μL浓度为2 mg/mL的甘氨酸孵育5 min后,摇床上PBS清洗5 min。每孔中加入100 μL含0.5%的TritonX-100的PBS溶液,摇床上脱色孵育10 min,PBS洗涤2次,每次5 min。加入Apollo室温下避光染色30 min,再用DAPI染色液室温避光孵育20 min。PBS清洗后在荧光显微镜下拍照计数,分析结果。蓝色荧光标记细胞总数,绿色荧光标记增殖的细胞,细胞增殖率(%)=绿色荧光细胞数/蓝色荧光细胞数×100%。
1.9 Transwell小室实验
实验分组同1.7节。取对数生长期的MGC-803细胞,用胰蛋白酶消化后,用含1%胎牛血清的培养液重悬细胞且计数,单细胞悬液的密度为2×106个/mL,取200 μL细胞悬液接种于小室的上室中,小室的下室中则加入600 μL完全培养液。细胞接种24 h后,将小室直接浸泡于甲醇溶液中室温固定 20 min。待细胞固定后,吸除小室上室中的培养液,用棉签小心擦去剩余培养液和未穿过小室膜的细胞。将小室放入含1%结晶紫的染色液中,室温染色10 min,流动水冲洗小室,晾干水分,在光学显微镜下(放大倍数为200倍)观察细胞形态并计数,拍照保存检测结果。

表1 实时荧光定量PCR引物序列Table 1 The primer sequence of real-time fluorescent quantitative PCR
1.10 双荧光素酶报告基因检测
采用定点突变试剂盒对预测的结合位点进行突变。将MAFG-AS1和AKT2 mRNA 3’-非翻译区(3’-untranslated region,3’-UTR)中含有预测miRNA结合位点的序列片段插入到荧光素酶报告基因载体pGL3-basic中,从而分别构建野生型(wild type,WT)和突变型(mutant type,MUT)荧光素酶报告质粒(MAFG-AS1-WT、MAFG-AS1-MUT、AKT2-WT和AKT2-MUT)。
将MGC-803细胞以1×105个/孔的密度接种于24孔板中,培养至融合度为70%时,收集细胞。采用转染试剂LipofectAMINETM2000将MAFGAS1-WT、MAFG-AS1-MUT与miR-143-3p-mimics或NC-mimics两两组合共转染MGC-803细胞,验证MAFG-AS1和miR-143-3p的相关性;将AKT2-WT、AKT2-MUT和miR-143-3p-mimics或NCmimics两两组合共转染MGC-803细胞,验证miR-143-3p与AKT2的相关性。转染48 h后,按照试剂盒操作说明检测各组细胞的荧光素酶活性。
1.11 蛋白质印迹法检测MAFG-AS1过表达后上调miR-143-3p表达或下调AKT2表达对MGC-803细胞中AKT2蛋白表达水平的影响
实验分为4组:空载体组(对照组)、MAFG-AS1组、MAFG-AS1+miR-143-3p组(共转染MAFG-AS1过表达重组质粒和miR-143-3p-mimics)和MAFG-AS1+siAKT2组(共转染MAFG-AS1过表达重组质粒+siAKT2)。采用RIPA裂解MGC-803细胞,提取细胞中的总蛋白。而后采用BCA法检测蛋白浓度。取适量蛋白行10% SDS-PAGE分离蛋白,电泳结束后将分离后的蛋白转移至PVDF膜上;用含5%脱脂奶粉的封闭液封闭处理1 h,然后加入一抗[兔抗人AKT2单克隆抗体(体积稀释比例为1∶500)]在4 ℃下孵育过夜;用TBST洗膜后,加入二抗[辣根过氧化物酶标记的羊抗兔IgG(体积稀释比例为1∶1 000)]室温孵育1 h。加入电化学发光液发光显影,在凝胶成像系统中进行图像采集,使用Image J分析蛋白质条带。
1.12 功能补偿实验
实验分为4组同1.11节。采用CCK-8法、EdU实验和Transwell小室实验检测MAFGAS1、miR-143-3p和AKT2对细胞增殖和迁移的影响。
1.13 统计学方法
采用SPSS 22.0统计软件和Graphpad Prism 8对实验数据进行分析。计量资料数据以表示,两组间比较采用t检验,多组间比较采用方差分析。计数资料数据采用四格表(或百分率)表示,由于N<40,采用确切概率法进行差异分析。以P<0.05为差异有统计学意义。
2 结果
2.1 MAFG-AS1在GC细胞和组织中过表达且与GC患者预后不良相关
为了探究MAFG-AS1在GC细胞中的表达水平,首先通过GEPIA数据库分析发现,MAFG-AS1在GC组织中高表达(图1A),差异均有统计学意义(P<0.05)。
随后,通过实时荧光定量PCR检测39例GC患者癌及癌旁组织中,以及人胃黏膜上皮细胞GES-1细胞和人GC细胞系BGC-823、SGC-7901和MGC-803细胞中MAFG-AS1的表达水平。结果显示,与癌旁组织相比,MAFGAS1在GC组织的表达水平明显上调(P值均<0.001)(图1B);与人胃黏膜上皮细胞GES-1细胞相比,人GC细胞系BGC-823、SGC-7901和MGC-803细胞中的表达水平均明显上调(P值均<0.001)(图1C)。MAFG-AS1高表达与GC患者是否淋巴结转移(P=0.010 4)和分化程度低(P=0.0150)具有相关性(表2)。
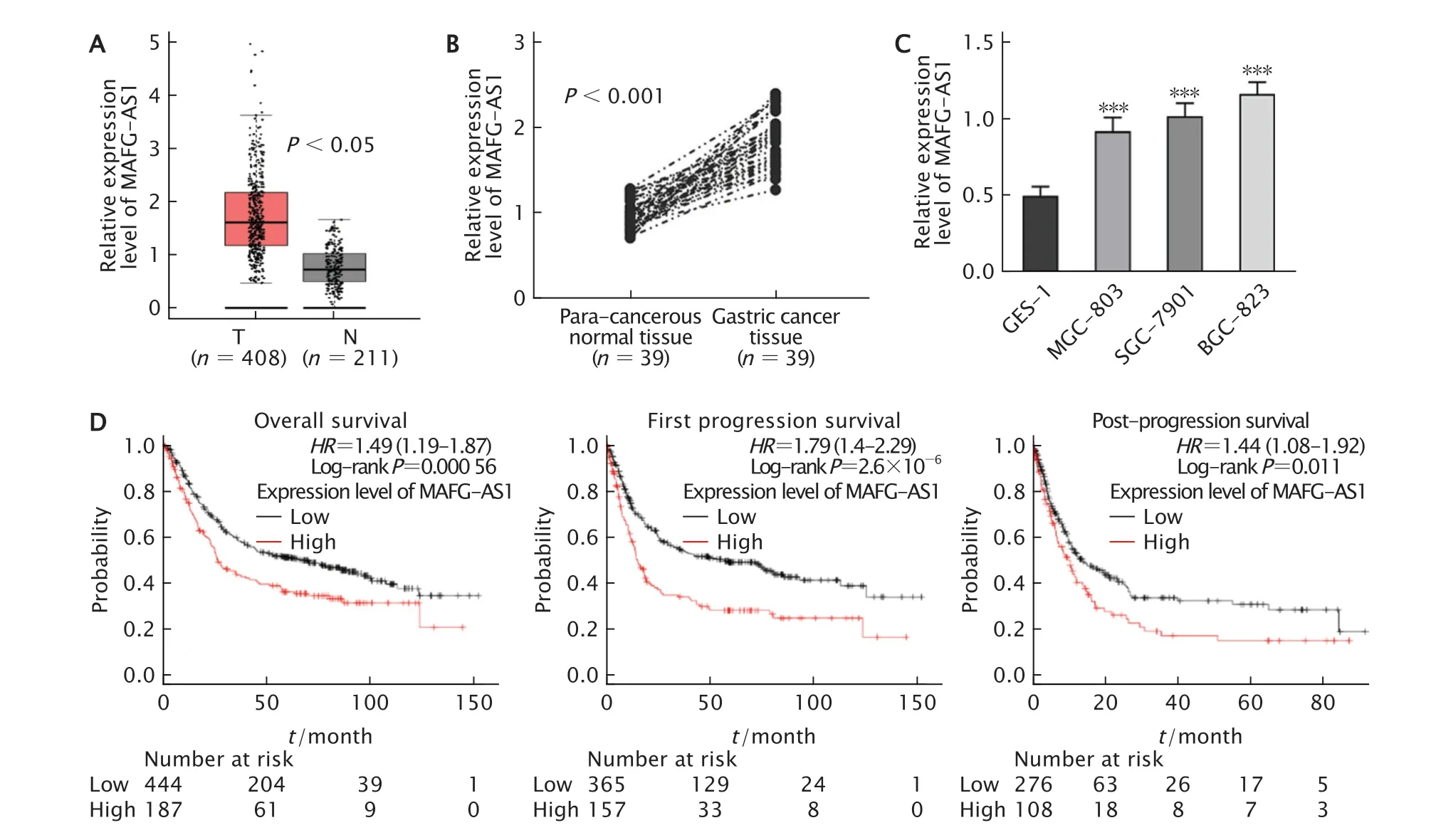
Fig.1 Relationship between the expression of long non-coding RNA (lncRNA) MAFG-AS1 and prognosis of gastric cancer(GC) patients.A:MAFG-AS1 expression from Gene Expression Profiling Interactive Analysis (GEPIA);B-C:MAFGAS1 expression in GC tissues and cells (BGC-823,SGC-7901 and MGC-803 cells,normal gastric epithelial GES-1 cells as the control) was detected by real-time fluorescent quantitative PCR;D:The expression level of MAFG-AS1 was negatively correlated with the overall survival,first progression survival and post-progression survival.T:Tumor tissue;N:Para-cancerous normal tissue;HR:Hazard ratio;**P<0.01,***P<0.001,vs GES-1 cells (n=3).图1 LncRNA MAFG-AS1在GC组织和细胞中的表达水平及与GC患者生存期的关系
通过Kaplan-Meier Plotter数据库分析发现,MAFG-AS1高表达与GC患者的总体生存期(overall survival,OS)和首次进展生存期(first progression survival)以及后进展生存期(postprogression survival)呈负相关(图1D),差异均有统计学意义(P=0.000 56,P=2.6×10-6和P=0.011)。由此可见,MAFG-AS1的表达失调与GC患者预后不良密切相关。
2.2 过表达MAFG-AS1显著促进GC细胞的增殖和迁移
为了验证MAFG-AS1在GC中的作用,将MAFG-AS1过表达质粒转入MGC-803细胞中,随后采用实时荧光定量PCR法检测MAFG-AS1表达水平。结果(图2A)显示,空载体组(对照组)和MAFG-AS1组中MAFG-AS1的表达量分别为1.0±0.14和3.1±0.33,相较于对照组,MAFG-AS1组中MAFG-AS1的表达水平明显上调(P<0.001)。
CCK-8法检测结果(图2B)显示,与对照组相比,MAFG-AS1组的细胞活力明显升高,从48 h时开始,差异具有统计学意义(P值均<0.05)。
EdU实验检测结果(图2C)显示,对照组和MAFG-AS1组细胞EdU染色阳性细胞所占百分比分别为(29.2±3.3)%和(69.5±7.3)%,MAFG-AS1组细胞的阳性率明显高于对照组(P<0.001)。
Transweell小室实验检测结果(图2D)显示,对照组和MAFG-AS1组发生迁移的细胞数分别为(62.4±6.5)个和(152.6±17.3)个,MAFG-AS1组发生细胞的迁移数明显多于对照组(P<0.01)。
2.3 miR-143-3p是MAFG-AS1的下游靶标
通过StarBase数据库预测了MAFG-AS1与miR-143-3p存在结合位点(图3A)。采用实时荧光定量PCR法检测癌及癌旁组织中miR-143-3p的表达水平,结果(图3B)显示,与癌旁组织相比,miR-143-3p表达水平在GC组织中明显下调(P<0.001)。同时,Pearson相关性分析结果(图3C)表明,MAFG-AS1与miR-143-3p的表达呈负相关(R2=0.144 8,P<0.05)。
通过双荧光素酶报告基因系统进一步探究MAFG-AS1与miR-143-3p的关系。结果(图3D)显示,上调miR-143-3p表达可明显抑制MAFG-AS1-WT的荧光素酶活性(P<0.001),而对MAFG-AS1-MUT的荧光素酶活性无明显影响(P>0.05)。随后,采用实时荧光定量PCR法检测发现(图3E),过表达MAFG-AS1可抑制miR-143-3p的表达水平(P<0.01),而上调miR-143-3p表达水平对MAFG-AS1的表达无明显影响(P>0.05)。由此可见,GC中MAFG-AS1直接靶向miR-143-3p,并负调节其的表达。

表2 LncRNA MAFG-AS1表达与GC患者临床病理特征的关系Table 2 Correlation between clinicopathological features and expression of long non-coding RNA(lncRNA) MAFG-AS1 in 39 patients with gastric cancer (GC)N=39,n

Fig.2 Effects of long non-coding RNA (lncRNA) MAFG-AS1 on proliferation and migration of gastric cancer (GC)MGC-803 cells.A:The transfection efficiency was detected by real-time fluorescent quantitative PCR;B-C:The efffect of MAFG-AS1 overexpression on the proliferation of MGC-803 cells was detected by CCK-8 assay and EdU staining,respectively;D:Transwell assay was conducted to evaluate the effect of MAFG-AS1 overexpression on MGC-803 cells migration.MAFG-AS1 group:MGC-803 cells were transfected with recombinant plasmid expressing MAFG-AS1 by liposome.MGC-803 cells were transfected with empty vector by liposome as the control;*P<0.05,**P<0.01,***P<0.001,vs the control group (n=3).图2 过表达MAFG-AS1对MGC-803细胞增殖和迁移的影响
2.4 LncRNA MAFG-AS1通过靶向结合miR-143-3p上调AKT2的表达
通过分析StarBase数据库发现,AKT2与miR-143-3p存在结合位点(图4A)。随后,通过双荧光素酶报告基因实验检测发现(图4B),转染miR-143-3p-mimics可抑制AKT2-WT组的荧光素酶活性(P<0.01),而对AKT2-MUT组的荧光素酶活性无明显影响(P>0.05)。
蛋白质印迹法检测结果(图4C)显示,过表达MAFG-AS1可上调AKT2蛋白的表达水平,而上调miR-143-3p表达或敲低AKT2表达均可抑制AKT2蛋白的表达水平,差异均有统计学意义(P值均<0.001)。
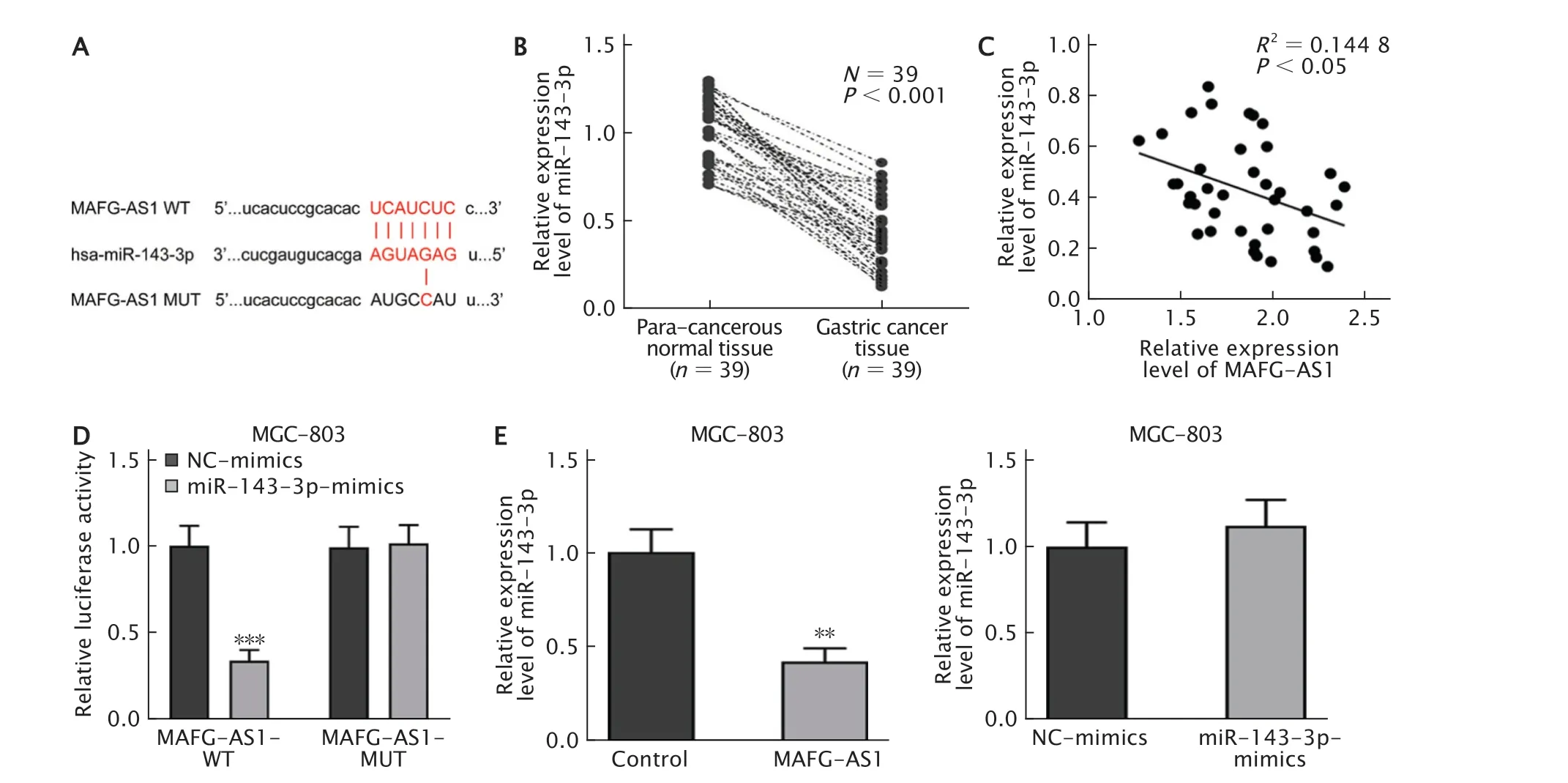
Fig.3 Long non-coding RNA (lncRNA) MAFG-AS1 directly targets miR-143-3p.A:The binding site between MAFGAS1 and miR-143-3p was predicted through the StarBase database;B:The miR-143-3p expression level in gastric cancer(GC) and para-tumor tissues was detected by real-time fluorescent quantitative PCR;C:Pearson correlation analysis was conducted to evaluate the relevance between the expressions of MAFG-AS1 and miR-143-3p.D:Dual-luciferase reporter assay was conducted to detect the relationship between MAFG-AS1 and miR-143-3p;E:MAFG-AS1 and miR-143-3p expression levels in MGC-803 cells were detected by real-time fluorescent quantitative PCR.**P<0.01,***P<0.001 (n=3).图3 分别采用双荧光素酶报告基因系统和实时荧光定量PCR法验证MAFG-AS1和miR-143-3p的靶向关系
采用实时荧光定量PCR检测癌及其癌旁组织中MAFG-AS1、miR-143-3p和AKT2 mRNA的表达水平,再用Pearson进行相关性分析。结果显示,miR-143-3p与AKT2 mRNA的表达水平呈负相关(R2=0.364 0,P<0.001)(图4D),MAFG-AS1与AKT2 mRNA的表达水平呈正相关(R2=0.223 1,P<0.05)(图4E)。此外通过对StarBase数据库分析发现(图4F),AKT2与MAFG-AS1的表达呈正相关(r=0.229,P=7.55×10-6)。由此推测,GC中MAFGAS1通过抑制miR-143-3p表达上调的AKT2的表达水平。
2.5 MAFG-AS1通过调控miR-143-3p/AKT2轴促进MGC-803细胞的增殖和迁移
为了进一步验证MAFG-AS1是否通过调控miR-143-3p/AKT2轴对MGC-803细胞的增殖和迁移产生影响,分别将空载体(对照组)、MAFG-AS1过表达重组质粒(MAFG-AS1组)、MAFG-AS1过表达重组质粒+miR-143-3p-mimics(MAFG-AS1+miR-143-3p组)和MAFG-AS1过表达重组质粒+siAKT2(MAFGAS1+siAKT2组)分别转入MGC-803细胞中。
实时荧光定量PCR法检测结果(图5A)显示,与对照组相比,MAFG-AS1过表达后miR-143-3p的表达水平明显下调(P<0.001);相较与MAFG-AS1组,MAFG-AS1+miR-143-3p组中miR-143-3p的表达水平明显上调(P<0.001),而MAFG-AS1+siAKT2组中miR-143-3p的表达水平没有明显变化(P>0.05)。
CCK-8法检测结果(图5B)显示,与对照组相比,MAFG-AS1组细胞的活力明显提高(P<0.001),而MAFG-AS1+miR-143-3p组和MAFG-AS1+siAKT2组的细胞活力均低于MAFG-AS1组(P<0.01和P<0.001)。
EdU实验检测结果(图5C)显示,对照组和MAFG-AS1组EdU染色阳性细胞所占的百分比分别为(31.5±3.5)%和(71.2±7.6)%,MAFG-AS1组细胞的增殖活性较对照明显提高(P<0.001);MAFG-AS1+miR-143-3p组和MAFG-AS1+siAKT2组细胞的EdU染色阳性细胞所占的百分比分别为(37.5±3.9)%和(33.4±3.6)%,均低于MAFG-AS1组(P值均<0.001)。
Transweell小室迁移实验检测结果(图5D)显示,对照组和MAFG-AS1组发生细胞的迁移数分别为(57.6±6.3)个和(141.2±14.5)个,MAFG-AS1组发生迁移的细胞数明显多于对照组(P<0.001);MAFG-AS1+miR-143-3p组和MAFG-AS1+siAKT2组发生迁移的细胞数分别为(64.3±6.7)个和(61.7±6.3)个,均低于MAFG-AS1组(P值均<0.001)。
上述结果表明,MAFG-AS1可能通过抑制miR-143-3p表达促进GC细胞的增殖和迁移。

Fig.5 The effects of long non-coding RNA (lncRNA) MAFG-AS1 on proliferation and migration of MGC-803 cells by regulating miR-143-3p/AKT2 axis.A:The transfection efficiency was detected by real-time fluorescent quantitative PCR;B-C:The effect of MAFG-AS1 on MGC-803 cells proliferation was detected by CCK-8 assay and EdU staining,respectively;D:Transwell assay was used to detect the effect of MAFG-AS1 on MGC-803 cells migration.**P<0.01,***P<0.001 (n=3).图5 MAFG-AS1可能通过抑制miR-143-3p表达促进MGC-803细胞的增殖和迁移
3 讨论
LncRNA可分为基因内lncRNA、基因间lncRNA、正义lncRNA及反义lncRNA等多种类型,在多个层面调控基因的表达,如调节其附近蛋白编码基因的表达、参与调节其他RNA的加工、作为内源竞争性RNA与miRNA结合进而调控靶基因的表达等[13]。近年来,越来越多的研究表明lncRNAs在包括GC在内的多种肿瘤的生长和转移中发挥关键调节作用[14-15]。有研究报道,MAFG-AS1通过抑制miR-147b的表达而上调NDUFA4的表达水平,进而促进结直肠癌的进展[16]。MAFG-AS1通过调节miR-744-5p/MAFG轴促进肺腺癌细胞增殖[17]。而在乳腺癌中,MAFG-AS1通过调节miR-339-5p/基质金属蛋白酶15(matrix metalloproteinase 15,MMP15)促进肿瘤细胞的侵袭性[18]。GC中MAFG-AS1表达上调,其高表达水平与肿瘤临床分期提高,浸润深度加深和患者生存期短密切相关;敲低MAFGAS1表达可抑制GC细胞的增殖、迁移和侵袭[12],这一结果与本研究结果一致。本研究中,通过分析GEPIA数据库和Kaplan-Meier Plotter数据库发现,MAFG-AS1在GC中表达失调,并与患者不良预后相关;进一步研究表明,过表达MAFG-AS1可促进GC细胞的增殖和迁移,这表明MAFG-AS1在GC中发挥促癌作用。
MiRNAs是一种在许多生物学进程中调节基因表达的非编码RNA,miRNAs通过调节靶基因的表达和下游重要信号转导通路的活性,参与调控癌细胞的增殖、迁移和侵袭、分化和凋亡[19-20]。有研究表明,miR-143-3p可通过靶向结合mRNA的3’-UTR在肿瘤中发挥抑制作用,如miR-143-3p通过靶向结合FOSL2(Foslike antigen 2)抑制骨肉瘤的增殖、迁移和侵袭[19]。类似研究表明,miR-143-3p通过靶向结合K-RAS抑制胰腺导管腺癌的发生[20]。乳腺癌中,miR-143-3p通过靶向丝裂原活化蛋白激酶7(mitogen-activate protein kinase 7,MAPK7)抑制肿瘤的增殖和转移[21]。而在GC中miR-143-3p表达下调,其表达失调与患者是否淋巴结转移密切相关,功能上miR-143-3p通过靶向结合AKT2抑制GC细胞的增殖和转移[22]。本研究中同样发现,miR-143-3p在GC组织中表达下调,随后通过验证发现miR-143-3p通过靶向AKT2在GC细胞的增殖和迁移中发挥抑制作用。
AKT2属于AKT家族,是一种常见致癌基因,其在调节血管生成、肿瘤生长、细胞转移和化学抗性中发挥重要作用[23]。有研究提示,AKT2可促进卵巢癌中丙酮酸激酶的表达,从而诱导体外细胞的迁移和侵袭,以及体内肿瘤细胞转移[24]。在乳腺癌中,AKT2通过调节F-肌动蛋白和波形蛋白的表达,从而促进肿瘤的生长、浸润和肺转移[25]。而在GC中,AKT2表达上调,敲低AKT2表达可抑制GC细胞的生长和转移,促进其凋亡,且AKT2的表达受到miR-143-3p的靶向调控[22]。本研究中,再次验证提示miR-143-3p负调控AKT2的表达,MAFG-AS1正向调控的AKT2水平,这表明MAFG-AS1通过调控miR-143-3p/AKT2调控轴在GC进展中发挥作用。
总之,本研究中发现MAFG-AS1在GC中的表达水平上调,并预示着GC患者的不良预后。进一步研究表明,MAFG-AS1可促进GC细胞的增殖和迁移。相关机制研究表明,MAFGAS1可通过调控miR-143-3p/AKT2轴在GC的进展中发挥作用。本研究结果为GC发病机制提供了新的见解,将有助于GC的早期诊断和治疗。然而,本研究仍有许多不足之处,研究局限于单中心样本,将来需要更大的样本来证实这一结论。

