贝伐珠单抗联合化疗治疗晚期乳腺癌疗效及安全性的Meta分析
杜林娟,刘 霜,李 明,王春光
2018年全球新发癌症1 810万例,统计数据显示女性患者乳腺癌发病率最高,约占总数的1/4,同时也是癌症死亡的主要原因[1]。2015年,中国恶性肿瘤流行分析结果显示,乳腺癌新发病例为30.4万例,死亡为7万例,发病率及死亡率呈逐年上升趋势[2]。乳腺癌俨然已成为危害女性健康的一大公敌。晚期转移性乳腺癌治疗较棘手,已知常规治疗手段为内分泌及化疗等全身治疗,治愈可能性小。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管生成过程中的关键信号分子,阻断该通路是公认的肿瘤治疗靶点[3],贝伐珠单抗是一种可与VEGF结合的人源化单克隆抗体。为此全球展开了多项贝伐珠单抗联合化疗治疗晚期乳腺癌的临床研究。2项随机对照试验AVF2119g研究[4]及E2100研究[5]结果显示,联合治疗可改善患者客观缓解率(objective response rate,ORR),然而对于中位无进展生存期(median progression free survival,mPFS)结果仍存在争议。其后,E2100研究[5]直接促进2008年美国食品药品监督管理局(food and drug administratin,FDA)加快批准贝伐单抗联合化疗用于人类表皮生长因子受体2(human epidermal growth fctor recptor-2,HER-2)阴性晚期转移性乳腺癌的一线治疗,但由于后来对安全性的担忧以及随机临床试验中总体生存率缺乏改善,该批准在2010年被撤销[6]。因此,本研究通过纳入多项随机对照研究以系统评价贝伐珠单抗联合化疗治疗晚期乳腺癌的疗效及安全性,以期为晚期乳腺癌的临床治疗提供更多的循证医学证据。
1 资料与方法
1.1 文献检索
计算机检索PubMed、The Cochrane Library、EMbase、CNKI、维普和万方等数据库中化疗联合贝伐珠单抗治疗晚期乳腺癌的随机对照临床试验(randomized controlled trial,RCT)。英文检索词包括“chemotherapy”、“metastatic breast cancer”、“bevacizumab”、“clinical trial”、“breast cancer”和“avastin”;中文检索词包括“晚期乳腺癌”、“联合化疗”、“贝伐珠单抗”、“临床试验”、“疗效评估”、“安维汀”和“抗血管生成抑制剂”,并根据入选文献的参考文献进一步扩大检索相关数据库如MEDLINE和SpringerLink,检索时限均为各数据库建库起至2020年9月。
1.2 文献纳入与排除标准
1.2.1 纳入标准
研究类型:国内外公开发表的随机对照临床试验,语种限制为中文和英文。研究对象:(1)病理及影像学确诊的Ⅳ期乳腺癌患者;(2)存在可测量病灶者;(3)按美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分标准评为0~2分者,无其他化疗禁忌症,可耐受相关治疗;(4)种族、年龄和性别不限。
治疗方法:(1)试验组为各种静脉及口服化疗药联合贝伐珠单抗;对照组为单用各种静脉及口服化疗药。剂量、用法按照说明书及专家共识推荐为准。
结局指标及疗效判定:结局指标包括(1)ORR;(2)中位总生存期(median overall survival,mOS);(3)mPFS;(4)安全性和耐受性评估根据常见不良事件评价标准(National Cancer Institue-Common Terminology Criteria AdverseEvents,NCI-CTCAE)评估其严重程度。疗效判定:依据实体肿瘤疗效评价标准(Response E-valuation Criteria in Solid Tumors,RECIST)进行疗效判定。
1.2.2 排除标准
(1)相关结局指标缺失;(2)重复发表的文献;(3)非随机对照临床试验。
1.3 文献筛选、资料提取及质量评价
由2名研究者独立按照文献纳入排除标准阅读文献题目及摘要,排除不具备纳入标准的文献,通过阅读全篇文献,确定纳入的文献,并提取相关数据,对存在分歧的地方进行讨论并由第3名研究员判定。如有需要,通过邮件、电话联系原始作者获取未确定但对本研究重要的信息。纳入的文献采用Cochrane Hand book 5.1.0推荐的偏倚风险评估工具评价纳入研究质量。如遇分歧通过讨论或参考第3位研究者意见决定。
1.4 统计学方法
采用RevMan 5.3软件进行Meta分析。结局指标ORR及不良反应事件以比值比(odds ratio,OR)及其95%可信区间(confidence interval,CI)为效应量,mOS和mPFS以风险比(hazard ratio,HR)及95%CI为效应量。首先分析各纳入研究的临床异质性,采用I2检验分析其统计学异质性。当P>0.1,I2<50%时可认为多个同类研究间具有同质性,选用效应固定模型进行分析;当P<0.1,且I2≥50%时,选用效应随机模型合并分析。
2 结果
2.1 纳入文献结果
初检出文献179篇,经逐层筛除最终纳入10篇文献,共计5 210例患者。筛选过程见图1,纳入研究基本信息见表1,质量评价表2。
2.2 Meta分析结果
2.2.1 ORR
共纳入了9项[4-5,7-11,13-14]研究,共计4 231例患者。结果(图3)显示,2组之间I2检验P=0.35,I2=10%,异质性小,选用固定效应模型分析。2组患者间的ORR存在显著差异,有统计学意义(OR=1.79,95%CI为1.56~2.05,P<0.000 01)。
2.2.2 mPFS
共纳入了9项[4-5,7-11,13-14]研究,ROBERT等[8]研究因化疗方案不同又将试验组分为卡培他滨组及紫杉类/蒽环类组,分别与对照组的mPFS进行比较,得出不同HR值及95%CI,故将数据分列2组(a组和b组)再进行合并。结果(图4)显示,I2检验提示异质性较大(P=0.03,I2=50%),应用随机效应模型分析。2组患者的mPFS间差异有统计学意义(HR=0.70,95%CI为0.63~0.78,P<0.000 01)。敏感性分析发现,剔除MILLER等[5](E2100研究)文献后,异质性降低(P=0.73,I2=0%),Meta分析结果仍显示试验组mPFS优于对照组,差异有统计学意义(HR=0.73,95%CI为0.68~0.79,P<0.000 01)。
2.2.3 mOS
共纳入了5项[7-8,10-11,14]研究,异质性分析显示2组的P=0.94,I2=0%,无异质性,选用固定效应模型分析。Meta分析结果(图5)显示,最终2组的mOS间差异无统计学意义(HR=0.94,95%CI为0.84~1.05,P=0.28)。
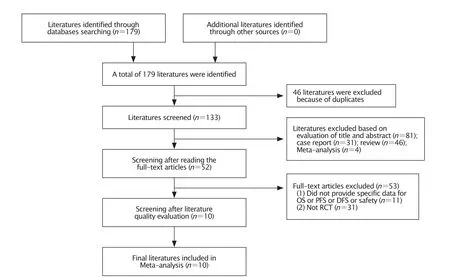
Fig.1 Literature scanning process.OS:Overall survival;PFS:Progression-free survival;DFS:Diseasefree surviva;RCT:Randomized controlled trial.图1 文献筛选流程
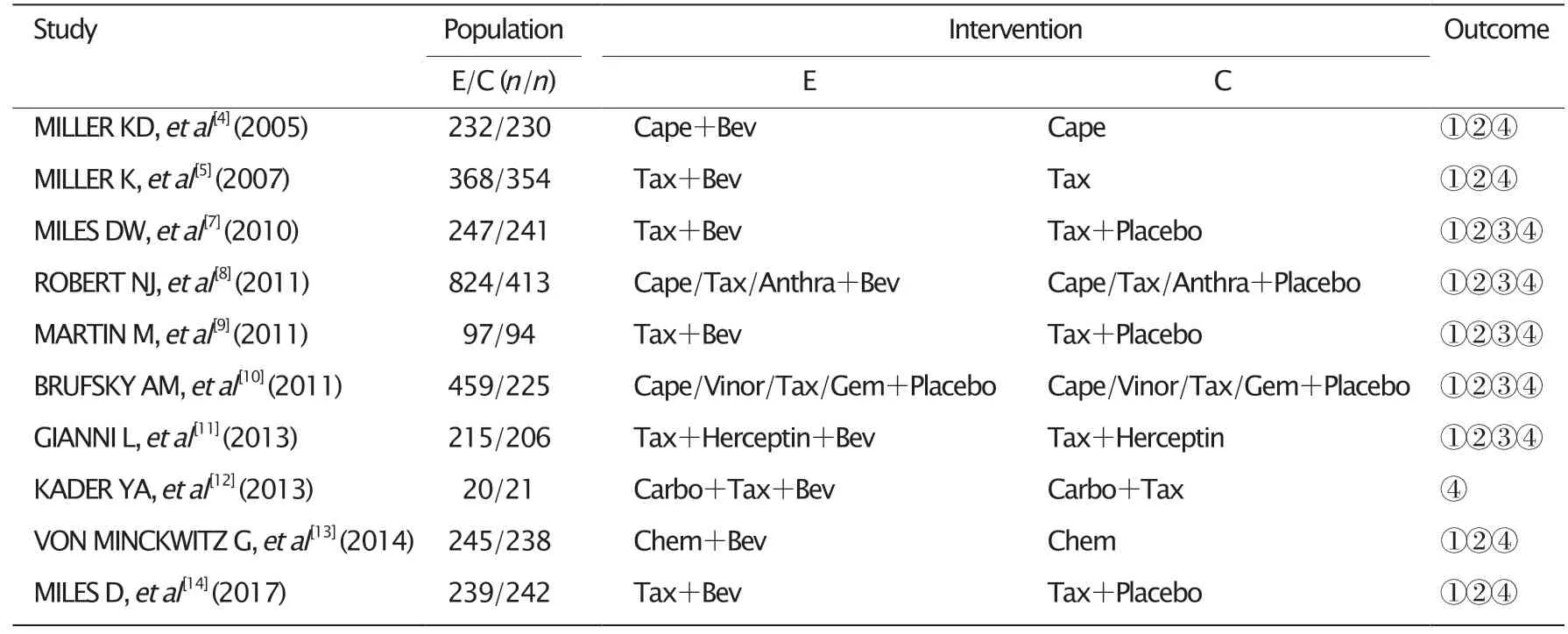
表1 纳入研究基本信息表Table 1 Basic characteristics of the articles included in this study

Fig.2 Quality assessment of included studies.图2 纳入研究的质量评价结果
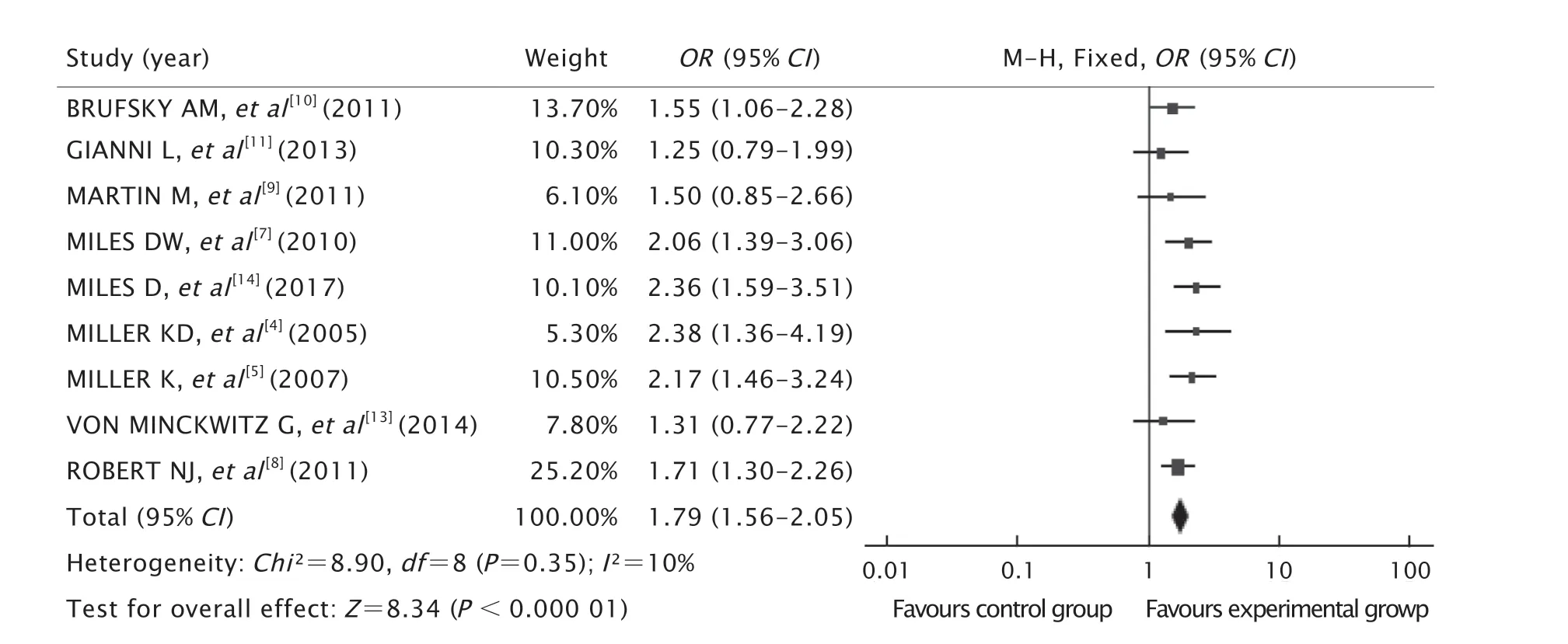
Fig.3 Forest plot of objective response rate (ORR).OR:Odds ratio;CI:Confidence interval.图3 ORR的森林图
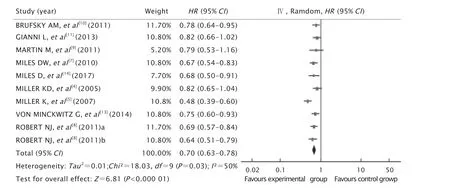
Fig.4 Forest plot of progression-free survival (mPFS).HR:Hazard ratio;CI:Confidence interval.图4 mPFS的森林分析结果图

Fig.5 Forest plot of median overall survival (mOS).HR:Hazard ratio;CI:Confidence interval.图5 mOS期的森林分析结果图
2.2.4 不良反应
根据常见不良事件评价标准评估≥3级不良反应,Meta分析结果(表2)显示,试验组中高血压(OR=8.39,95%CI为3.56~19.78,P<0.000 01)、蛋白尿(OR=10.87,95%CI为4.68~25.22,P<0.000 01)和神经毒性(OR=1.36,95%CI为1.03~1.79,P=0.03)的发生率高于对照组。而在出血事件及粒细胞减少方面,试验组并未显示更高的风险[(OR=1.95,95%CI为0.96~3.95,P=0.07)和(OR=1.25,95%CI为0.95~1.65,P=0.11)]。
2.3 发表偏倚
以mPFS绘制漏斗图评价发表偏倚,结果(图6)显示倒漏斗图左右基本对称,提示发表偏倚可能性较小。

表2 不良反应的Meta分析结果Table 2 Meta-analysis of adverse event
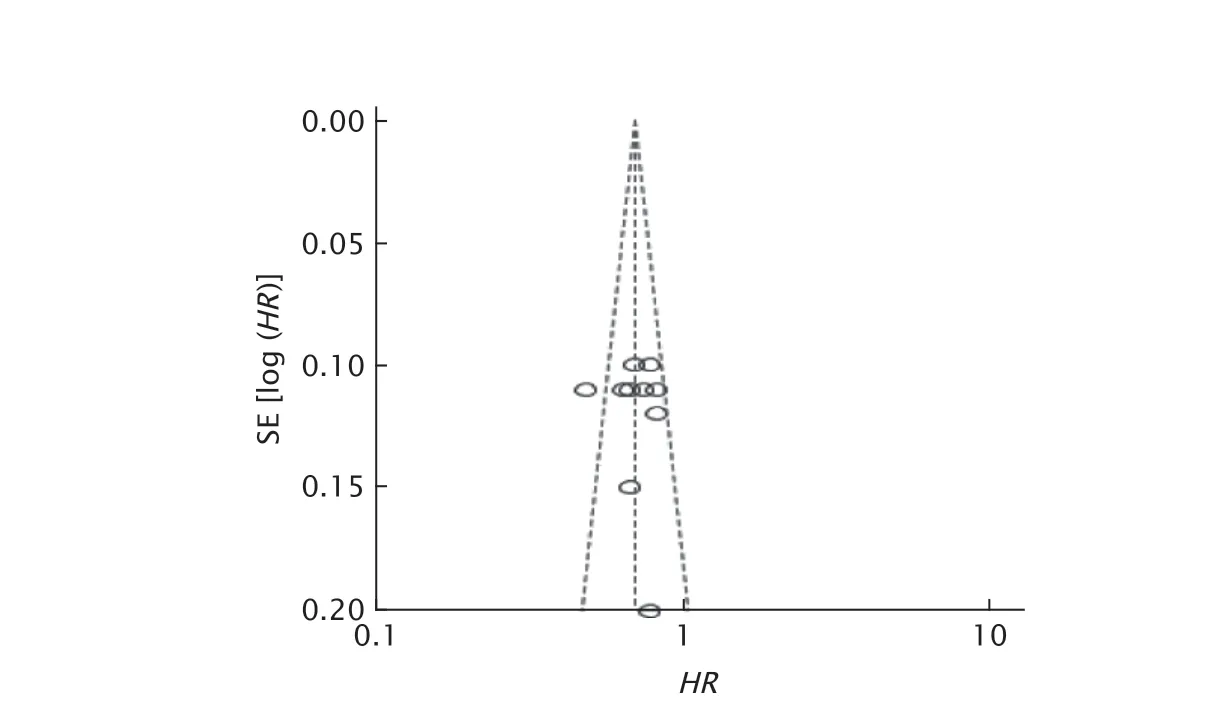
Fig.6 Funnel plot of median progression-free survival (mPFS).SE:standard error;HR:Hazard ratio.图6 mPFS的漏斗图
3 讨论
抗血管生成治疗主要是通过使肿瘤组织异常的脉管系统正常化,改善化学药物和抗肿瘤药物从血液循环到肿瘤组织的运输,以达到增加肿瘤组织内药物浓度、增强抗肿瘤作用的目的[15]。目前抗血管生成药物种类繁多,贝伐珠单抗作为第一个问世的抗血管生成靶向药物[16],其适应症不断拓宽。其在晚期转移性乳腺癌治疗中扮演的角色存在争议,本篇系统评价提取合并10篇随机对照试验数据,结果显示联合治疗组可显著改善ORR及mPFS,而2组患者的mOS差异无统计学意义。≥3级不良反应中,联合治疗组在高血压、蛋白尿、粒细胞减少及周围神经毒性方面发生率更高,出血事件风险未见明显增加。进一步阅读相关的非随机对照试验发现不同结果,日本的一项单臂临床试验[17]结果显示,贝伐珠单抗联合紫杉醇治疗晚期转移性乳腺癌疗效卓越,mOS达到35.8月、1年总生存率为88.9%,且耐受性好,由此贝伐珠单抗获得晚期转移性乳腺癌的适应症。近期一项在日本开展的包括301例HER-2阴性晚期转移性乳腺癌患者的回顾性研究[18]结果公布,无肝转移晚期患者亚组分析,贝伐珠单抗联合化疗对比传统化疗显著改善患者mOS(48.0个月vs27.3个月),差异有统计学意义(P=0.015)。此外,一项从法国流行病学策略和医学经济学(French Epidemiological Strategy and Medical Economics,ESME)数据库获取的紫杉醇联合贝伐珠单抗对比紫杉醇单药治疗共计5 553名HER-2阴性晚期转移乳腺癌患者的回顾性研究[19]结果显示,联合治疗组mOS(27.7个月vs19.8个月)(HR=0.672,95%CI为0.601~0.752)及mPFS(8.1个月vs6.4个月)(HR=0.739,95%CI为0.672~0.813)延长。考虑到回顾性研究存在的偏倚,2者可比性降低,研究结论不如严格随机对照试验严谨可靠。回顾贝伐珠单抗在晚期结直肠癌和肺腺癌中的成功应用,三阴性乳腺癌恶性程度高,治疗手段较匮乏,联合抗血管生成治疗也是一种新的探索。贝伐珠单抗在晚期转移性乳腺癌治疗中的角色仍有待挖掘。本篇系统评价结果还需更大样本量及质量更高的临床试验加以验证。
本研究局限性在于:(1)纳入的研究虽都为随机对照试验,但部分研究未明确提及随机分配方法;纳入文献时间跨度较大,安全性和耐受性评价标准及实体肿瘤的疗效评价标准不同版本内容有所更新,可能影响结果的可靠性及稳定性;(2)纳入研究中贝伐珠单抗用量均为推荐剂量15 mg/kg每3周1次或10 mg/kg 2周1次,试验及对照组中余化疗方案尽可能保持相同,但各项研究中患者前期治疗不尽相同,可能是影响结果的一个因素。

