外泌体及其携带的非编码RNA在卵巢癌诊疗中的研究进展
陈其臻,傅夏燕,焦雨帆,尹 喆,纪亚忠,王炎秋
卵巢癌是3大妇科恶性肿瘤之一,每年全球新发卵巢癌病例约23万例,约15万例女性患者死于卵巢癌,病死率位居妇科恶性肿瘤首位。由于早期卵巢癌患者无特异性临床表现,缺乏有效的早期检测手段,约75%的患者确诊时已是晚期[国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期为Ⅲ期或Ⅳ期],此外,卵巢癌患者易产生化疗耐药,术后容易复发转移,因此晚期卵巢癌患者的5年生存率仅为29%[1-2]。这已严重影响全球女性的身心健康及生活质量,给社会和家庭带来了沉重负担。近年来的研究发现,外泌体(exosomes)非编码RNA有望成为卵巢癌早期诊断及治疗的新靶点。
外泌体是一类直径为40~160 nm的细胞外囊泡,为连续的细胞膜内陷形成的多囊体,其含有细胞特异的DNA、RNA及蛋白质等生物活性物质,并广泛分布于血液、唾液、卵泡液和子宫腔液等各种体液中[3]。大量的研究表明,外泌体在肿瘤的生长和转移、副肿瘤综合征的发生及肿瘤的化疗耐药等过程中发挥着重要作用[4]。目前,人类基因组中仅有2%的基因被翻译为蛋白质,其余均为非蛋白质编码部分,这些非蛋白质编码基因被复制到数千个RNA分子中,即非编码RNA。非编码RNA根据长度可分为长链非编码RNA(长度>200个核苷酸)和短链非编码RNA(长度为18~200个核苷酸)。ENCODE项目组研究发现[5],非编码RNA不仅会参与调节机体的生长和发育等生理过程,还会参与卵巢癌等肿瘤的发生及进展。本文将就外泌体非编码RNA在卵巢癌中的研究进展进行综述,以期为卵巢癌的诊断和治疗提供一些新的思路。
1 外泌体及其生物学功能
外泌体产生过程包括细胞膜的双重内陷和细胞内多囊小体(multivesicular bodies,MVBs)的形成,细胞内多囊小体包含多种腔内囊泡(intraluminal vesicles,ILVs),最终,直径为40~160 nm的腔内囊泡通过细胞内多囊小体质膜融合或胞吐作用以外泌体的形式分泌[6]。外泌体可不断被细胞产生并不断被细胞重吸收,其可能是新生成的外泌体,也可能为内源性外泌体重吸收后的混合物[7]。有研究表明,RAS相关结构域家族(RAS association domain family proteins,RASSF)蛋白、Bcl-2基因家族相关蛋白(Bcl-2 gene family proteins,Bcl-2)和神经酰胺等物质均参与到了外泌体的生物发生过程中,但其在该过程中的精确限速作用和功能仍需进一步研究[8-9]。
外泌体主要通过与靶细胞特异性受体结合、细胞膜融合或胞饮、内吞等内化机制实现细胞间的物质转换与信息交流,如人黑素瘤细胞能通过细胞和细胞之间细胞膜的融合摄取外泌体[10]。然而目前尚不明确靶细胞摄取外泌体的方式是否会影响外泌体的定位、降解及功能等特性。已有大量研究表明,外泌体在免疫反应性疾病、病毒相关疾病、妊娠、心血管疾病、中枢神经系统疾病和恶性肿瘤的发生和进展中均发挥关键作用。
由于外泌体的脂质双分子层结构可防止其内容物被降解或修饰,因此外泌体能够在人体体液中稳定存在并被检测到,其含量的变化可反映外泌体的起源细胞和机体病理生理的改变,这提示外泌体具有作为生物标志物的巨大潜力[11]。由于外泌体的纳米性质,使其可作为化疗药物以及免疫调节剂等药物的载体以进行靶向性治疗,而且其生物利用度更高,药物不良反应较少[3],能在神经退行性疾病、免疫反应性疾病和恶性肿瘤等疾病治疗中发挥作用如。
2 非编码RNA在卵巢癌中的研究进展
根据长度不同,非编码RNA可分为长链非编码RNA(long non-coding RNA,LncRNA)(长度>200个核苷酸)和短链非编码RNA(长度为18~200个核苷酸),其中短链非编码RNA包括微小RNA(microRNA,miRNA)、环状RNA(circular RNA,CircRNA)和PIWI蛋白相互作用RNA(PIWI-interacting RNA,piRNA)等。根据功能性的不同,非编码RNA可分为管家RNA和调节性非编码RNA,调节性非编码RNA包括miRNA、CircRNA和LncRNA等[12]。近年来,有越来越多的研究显示,调节性非编码RNA在卵巢癌发生及进展中发挥关键作用。此外,不同类型的非编码RNA在肿瘤发生和发展中存在相互作用,如CircRNA和LncRNA可作为miRNA的分子海绵,形成庞大且复杂的竞争性内源性RNA网络,通过调控靶基因的表达从而促进或抑制肿瘤的生长与转移。
2.1 LncRNA和miRNA
LncRNA和miRNA调控网络在肿瘤发生和发展过程中发挥重要作用,LncRNA通过竞争结合一个或多个具有相同miRNA反应元件的miRNA,影响miRNA的表达水平,从而间接调控靶基因的表达,促进或抑制肿瘤的发生或进展(图1)。
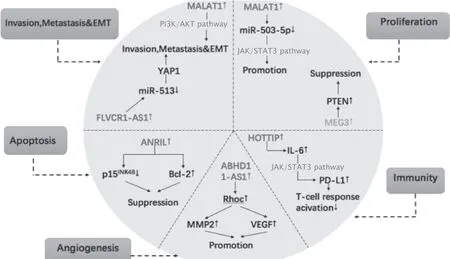
Fig.1 A brief overview of the most-studied and well-documented molecular functions of selected long noncoding RNA (LncRNA) and microRNA (miRNA).Metastasis-associated lung adenocarcinoma transcript 1 (MALAT1) is overexpressed in ovarian cancer (OC) and acts as a sponge for miR-503-5p,promoting cell proliferation through the janus kinase (JAK)/signal transducer and activator of transcription 3 (STAT3) pathway.And MALAT1 can also be the main mediator of tumor invasion and migration,and epithelial-mesenchymal transition (EMT) through phosphoinositide 3–kinase (PI3K)/protein kinase B (PBK,AKT) signaling pathway in OC patients.Maternally expressed gene 3 (MEG3) is elevated in OC,which in turn increases the expression of phosphate and tension homology deleted on chromsome ten (PTEN),thereby inhibiting tumor growth by inhibiting the proliferation of tumor cells.Feline leukemia virus subgroup C receptor antisense RNA 1(FLVCR-AS1) has been reported to enhance the expression of yes-associated protein 1 (YAP1) by reducing miR-513,thereby enhancing cell migration and invasion.ANRIL directly inhibits the apoptosis of OC cells by reducing the level of p15INK4B and inducing the expression of Bcl-2.ABHD11-AS1 is significantly increased in OC and facilitates matrix metalloproteinase 2 (MMP2)-mediated and vascular endothelial growth factor(VEGF)-mediated angiogenesis by targeting RAS homolog gene family member C (RHOC).HOXA terminal transcriptional RNA (HOTTIP) could promote the secretion of IL-6,thereby up-regulating the expression of programmed cell death 1 ligand 1 (PD-L1) in neutrophils,thus inhibiting the activity of T cells and ultimately accelerating the immune escape of OC cells.↑:Up-regulated;↓:Down-regulated.图1 LncRNA和miRNA在卵巢癌中的发病机制
到目前为止,科研人员已进行了大量LncRNA在卵巢癌发病及进展中的机制研究。LncRNA-人肺腺癌转移相关转录本1(metastasisassociated lung adenocarcinoma transcript 1,MALAT1)作为卵巢癌的一种癌基因,可通过调节细胞的增殖和凋亡促进肿瘤生长。SUN等[13]研究发现,LncRNA-MALAT1通过与miR-503-5p相互作用,负向调节miR-503-5p的表达,介导Janus激酶2(janus kinase 2,JAK2)/信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路的激活,从而促进卵巢癌细胞的增殖,并抑制癌细胞凋亡。此外,JIN等[14]研究发现,LncRNA MALAT1可通过磷脂酰肌醇-3激酶(phosphoinositide-3 kinase,PI3K)-蛋白激酶B(protein kinase B,PKB,又称AKT)信号转导通路,强化卵巢癌细胞的侵袭、迁移及上皮-间质转化(epithelial-mesenchymal transition,EMT)功能,从而促进了肿瘤生长。WANG等[15]研究发现,LncRNA-母系表达基因3(maternally expressed gene 3,MEG3)和第10号染色体同源丢失性磷酸酶基因和张力蛋白(phosphate and tension homology deleted on chromsome ten,PTEN)在卵巢癌细胞中表达下调,这提示LncRNA-MEG3可能通过正向调节PTEN的表达,从而抑制肿瘤细胞的增殖,阻断细胞周期进程,促进肿瘤细胞凋亡,最终起到抑制肿瘤生长作用。YAN等[16]研究发现,猫白血病病毒C亚类受体反义RNA1(feline leukemia virus subgroup C receptor antisense RNA1,LncRNA FLVCR1-AS1),其作为一种长链非编码RNA,可通过调控miR-513/Yes相关蛋白1(Yes-associated protein1,YAP1)信号通路促进卵巢癌细胞的迁移、侵袭和EMT过程。LncRNA ABHD11-AS1,位于人类第7号染色体q11.23区域,其通过正向调控RAS同源基因家族成员C(RAS homolog gene family member C,RhoC)的表达,并进一步调控RhoC下游分子基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)的表达,MMP-2可分裂层黏连蛋白-5(laminin 5,LN-5),增加内皮细胞的迁移及血管内皮生长因子(vascular endothelial growth factor,VEGF)的释放,这刺激了癌组织周围新生血管的生成,最终促进了肿瘤生长。HOXA远端转录本(HOXA transcript at the distal tip,HOTTIP)是同源盒基因(homeobox gene,HOX)的LncRNA,其在多种肿瘤进展中发挥重要作用。已有研究发现,HOTTIP的高表达可增加卵巢癌细胞中白细胞介素-6(interleukin-6,IL-6)的表达和分泌,IL-6通过与癌细胞周围中性粒细胞表面的IL-6受体结合,激活STAT3通路,从而增加中性粒细胞表面程序性死亡分子配体1(programmed death ligand-1,PD-L1)的表达,进一步抑制T细胞的活性,加速卵巢癌细胞的免疫逃逸,最终促进了卵巢癌的生长与转移[17]。
2.2 CircRNA和miRNA
CircRNA是一类圆形闭合结构的非编码RNA,是具有高度稳定性、保守性及多样性的RNA分子。CircRNA具有miRNA分子海绵作用、蛋白质海绵作用和调节基因转录与翻译等生物学功能。同时CircRNA的表达情况具有组织特异性及阶段特异性,能够反映机体不同的生理或病理状态[18]。越来越多的研究表明,CircRNA在卵巢癌疾病进展过程中发挥重要作用。NING等[19]对4例卵巢癌组织及正常卵巢组织进行了CircRNA表达谱检测,通过与正常卵巢组织进行对比,发现了4 388个不同程度表达的CircRNA,其中有2 556个CircRNA表达上调,1 832个CircRNA表达下调,采用实时荧光定量PCR法对CircRNA测序数据进行验证,结果证实了其中6个CircRNA(CircBNC2、CircEXOC6B、CircFAM13B、CircN4BP2L2、CircRHOBTB3和CircCELSR1)的表达水平存在差异。ZHAO等[20]研究发现,小脑变性相关蛋白1反义RNA(cerebellar degeneration-related 1 antisense,CircRNA CDR1as),主要存在于人类和小鼠的大脑中,通过调节miR-1270/肿瘤细胞侵袭抑制因子(suppressor of cancer cell invasion,SCAI)信号通路可使卵巢癌对顺铂增敏,并发现CDR1as在顺铂耐药患者的血清外泌体中表达下调。CHEN等[21]研究发现,hsa_circ_0061140通过发挥miR-370分子海绵的作用,可上调叉头框蛋白M1(forkhead box protein M1,FOXM1)的表达以促进卵巢癌的发生与发展。ZHANG等[22]研究发现,卵巢癌组织中hsa_circ_0051240表达明显上调,hsa_circ_0051240通过抑制miR-637/人组织激肽释放酶(kallikreins4,KLK4)轴促进卵巢癌细胞的增殖、迁移和侵袭,因此hsa_circ_0051240/miR-637/KLK4轴可作为卵巢恶性肿瘤治疗的有效靶点。ZOU等[23]通过实时荧光定量PCR技术对78例卵巢癌组织及正常卵巢组织行Circ LARP4表达检测,发现卵巢癌组织中Circ LARP4表达下调,此外ZOU等[23]还发现Circ LARP4的表达情况与FIGO分期及淋巴结转移有显著相关性,并通过COX风险比例回归模型验证了Circ LARP4表达下调为卵巢癌预后的独立危险因素。
3 外泌体非编码RNA在卵巢癌中的作用机制
随着外泌体和非编码RNA在肿瘤中的作用不断被发掘,科研人员也注意到外泌体及其携带的非编码RNA在卵巢癌发生和发展过程中的作用。同时还发现,癌细胞来源的外泌体不仅数量多于正常细胞,内容物也不尽相同[24]。现已有大量研究证实,外泌体通过参与肿瘤细胞增殖、EMT、调节免疫状态、肿瘤周围血管生成和转移前肿瘤微环境形成等过程促进卵巢癌的发生与进展。

Fig.2 Schematic diagram of the role of ovarian cancer (OC)-secreted microRNA (miR)-205 in tumour angiogenesis.Cancer-derived miR-205 can be transported to endothelial cells via exosomes,while exosomal miR-205 promotes angiogenesis in vitro and in vivo by regulating the phosphate and tension homology deleted on chromsome ten (PTEN)/protein kinase B (PBK,also known as AKT) pathway.图2 卵巢癌分泌的外泌体miR-205在肿瘤血管生成中的作用示意图
目前的相关报道主要集中在miRNA和CircRNA。HE等[25]通过共培养和外泌体标记实验发现了miR-205以外泌体形式由卵巢癌细胞分泌至细胞外液中,并高效转移到邻近的内皮细胞中,此外脂筏蛋白相关通路在调节靶细胞对外泌体miR-205的摄取过程中起到重要作用。HE等[25]发现miR-205在卵巢癌患者血清中显著富集,并且循环系统中富集的外泌体miR-205通过调控PTEN/AKT途径诱导血管生成及肿瘤生长(图2)。ZONG等[26]将卵巢癌细胞注入裸鼠腹腔,并分为实验组与对照组,实验组每隔2 d注射外泌体Circ WHSC1,对照组注射相同剂量的磷酸缓冲盐溶液,结果显示实验组裸鼠腹腔的周长较对照组增长迅速,腹腔转移结节灶数目较对照组显著增多,腹腔间皮细胞原有的紧密结构消失。ZONG等[26]通过蛋白质印迹法检测到,相较于对照组,实验组腹膜间皮细胞黏蛋白1(mucin1,MUC1)的表达水平显著升高,由此认为外泌体Circ WHSC1可被腹膜间皮细胞吸收,并诱导其发生EMT,同时MUC1高表达,可促进卵巢癌细胞与腹膜的黏附及转移。
4 外泌体非编码RNA在卵巢癌诊疗中的应用前景
4.1 外泌体非编码RNA在卵巢癌早期诊断及判定预后的应用
早期卵巢癌无特异性症状且缺乏有效的检查手段,这使得大多数患者在初次就诊时就已为卵巢癌晚期(Ⅲ/Ⅳ期),卵巢癌晚期患者的5年生存率仅为29%,而早期卵巢癌患者(Ⅰ/Ⅱ期)5年生存率可高达92%。目前,针对晚期卵巢癌的常用治疗手段为瘤体减灭术合并以铂类药物为基础的化疗治疗,大部分患者在应用一线化疗药之后产生耐药,并且复发率高。因此,寻找一个高效灵敏且方便快捷的早期检测手段对卵巢癌的有效治疗具有重大意义。
近期的研究表明,外泌体的磷脂双分子层可保护其内容物非编码RNA不被核酸酶降解,使其具有较高的稳定性,同时相较于循环肿瘤细胞(circulating tumor cells,CTCs)检测,其在体液中含量更为丰富,这些优点均为利用外泌体对卵巢癌的早期诊断创造了条件[27]。MENG等[28]研究发现,上皮性卵巢癌患者的血清中外泌体miR-373、miR-200a、miR-200b和miR-200c的浓度明显高于健康妇女,在有淋巴结转移的晚期(Ⅲ~Ⅳ期)患者中,外泌体miR-200b和miR-200c的表达水平也均高于早期患者(Ⅰ~Ⅱ期),由此提示外泌体非编码RNA可作为卵巢癌早期诊断的指标。VAKSMAN等[29]通过实时荧光定量PCR法对86例上皮性卵巢癌患者胸腔积液中的外泌体miRNA进行检测,研究结果显示,胸腔积液中外泌体miRNA-21、miRNA-23b和miRNA-29a的表达水平与患者的无进展生存期呈负相关(P=0.01,P=0.015和P=0.009),而外泌体miRNA-21的表达水平与患者预后总生存期呈负相关(P=0.017);此外,通过COX风险比例回归模型验证了外泌体miRNA-21高表达为卵巢癌患者预后的独立危险因素(P=0.017)。虽然,目前关于外泌体非编码RNA在卵巢癌中的研究仍相对较少,但非编码RNA具有稳定性高、丰度大和组织特异性强等优势,这使得外泌体非编码RNA非常适合作为卵巢癌早期诊断及预后评估的生物标志物。
4.2 外泌体及其携带的非编码RNA在卵巢癌治疗中的应用
鉴于外泌体非编码RNA以多种途径参与了恶性肿瘤的发生和发展过程,可以此为切入点将外泌体非编码RNA应用于肿瘤的治疗中。目前已证实的途径包括:(1)减少外泌体的产生和释放;(2)清除外周血中存在的外泌体;(3)利用外泌体增强机体免疫能力;(4)作为药物载体靶向传送药物。
AU YEUNG等[30]研究发现,外泌体miR-21可以从基质细胞转移至卵巢癌细胞中,并通过靶向凋亡蛋白酶激活因子-1(apoptotic protease activating factor-1,APAF1)诱导卵巢癌细胞对紫杉醇的化疗耐药,由此提示抑制外泌体miR-21的产生及释放可改善卵巢癌细胞对紫杉醇治疗的敏感性,但该方法仍需进一步在体内实验予以验证。ALVAREZERVITI等[31]给小鼠注射了携带有针对β位淀粉样前体裂解酶-1(β-site APP cleaving enzyme protein,BACE1)基因siRNA的外泌体后,小鼠脑中β-淀粉样蛋白表达水平下调。虽然该方法目前在卵巢癌耐药研究中尚无相关报道,但由此提示通过外泌体包裹siRNA下调卵巢癌相关耐药基因表达将有望成为一个治疗途径。MARLEAU等[32]开发了一种类似于血液透析设备的装置,其含有一种与外泌体高亲和力的纤维物质,该机器以类透析机制达到去除循环系统中存在的外泌体。外泌体用于制备疫苗是肿瘤免疫治疗的一个新方向,肿瘤细胞来源外泌体(tumor-derived exosomes,TEX)表面可负载主要组织相容性负荷体Ⅰ类分子(major histocompatibility complex Ⅰ,MHCⅠ)和肿瘤抗原,并可有效诱导T淋巴细胞反应;TEX的抗肿瘤作用很大程度上依赖树突性细胞(dendritic cells,DCs),其作为无细胞性结构,具有容易制备及量产等优势,是一种理想的肿瘤疫苗载体。TAGHIKHANI等[33]通过电穿孔的方法将miR-142装载在TEX上,结果发现修饰后的TEX可以诱导DCs的成熟,强化其免疫功能,并对免疫抑制的肿瘤微环境起到一定程度的抗肿瘤作用。这一研究提示,TEX既可作为药物或基因的载体对卵巢癌进行靶向治疗,又可以作为一种肿瘤疫苗抑制肿瘤生长。KIM等[34]通过体外实验证实,TEX包裹的紫杉醇可直接作用于耐药的肿瘤干细胞,其对耐药肿瘤细胞的细胞毒性为游离紫杉醇的50倍。总之,TEX作为药物载体具有免疫原性低、药物损耗率低和组织中易于扩散等优点。目前外泌体非编码RNA在卵巢癌治疗中的应用仍较少,需要进一步完善大样本的体内试验及具体免疫机制的研究。
5 总结与展望
卵巢癌作为3大妇科恶性肿瘤之一,由于其早期诊断率低、复发率高及化疗耐药,其病死率位居妇科肿瘤首位。近年来,外泌体非编码RNA与肿瘤的关系已成为热门研究领域,外泌体非编码RNA结合了外泌体及非编码各自的优势,可作为卵巢癌早期诊断及预后评估的生物标志物。同时,外泌体非编码RNA亦可作为卵巢癌治疗的特异性靶点,减少化疗耐药的发生,降低药物不良反应,改善患者的治疗效果及预后。然而目前有关外泌体非编码RNA的研究相对较少,非编码RNA在外泌体中的富集及降解机制尚不明确。此外,外泌体非编码RNA作为肿瘤标志物的灵敏度及特异性如何仍需进一步研究。外泌体非编码RNA在卵巢癌治疗方面的应用仍存在亟待解决的问题,体外外泌体过滤装置不具有选择性,非肿瘤来源外泌体的减少是否对卵巢癌的疾病进程有影响需要进一步研究,特异性消除或抑制外泌体非编码RNA的分泌及如何通过外泌体非编码RNA逆转化疗耐药的发生仍需进一步研究。

