沉默ELAVL1基因表达体外和体内抑制前列腺癌PC-3细胞的增殖
周逢海,吕海迪,周 川,张晓峰,张 发
胚胎致死性异常视觉(embryonic lethal abnormal vision,ELAV)家族成员中的人抗原R(human antigen R,HuR)即为ELAVL1蛋白,其是一种RNA结合蛋白,在正常细胞中主要分布于细胞核中,当其从细胞核转移至细胞质中时即能够与mRNA结合促进目的蛋白的表达[1]。HuR广泛表达于包括小肠、脾脏和卵巢等组织中,通过转录后机制参与细胞中许多分子的调控表达[2]。然而,其他家族成员HuB、HuC和HuD几乎只表达在神经组织中,参与相关分子的表达调控[2]。
研究表明,ELAVL1基因与肿瘤的多种生物学行为有关;与癌旁组织或正常组织相比,ELAVL1在结直肠癌、肺癌、乳腺癌和肝癌等多种肿瘤组织中高表达,且主要表达于细胞质中[2-7]。ELAVL1通过与肿瘤生物学功能有关的多种分子的mRNA相结合从而促进蛋白表达,进而影响肿瘤细胞多种生物学功能包括细胞增殖、周期、凋亡和侵袭等,甚至还与肿瘤细胞的放化疗耐受相关,最终导致肿瘤的发生和进展[2-7]。然而,当前有关ELAVL1在前列腺癌中的表达及作用鲜有报道。已有的研究同样发现,与正常前列腺组织相比,ELAVL1在前列腺癌组织中高表达且主要表达于细胞质中[8],初步研究表明高表达的ELAVL1与前列腺癌的发生和发展密切相关,但机制如何仍缺乏深入的研究。
本研究中将携带有特异性针对ELAVL1基因的ELAVL1-shRNA(shELAVL1)重组腺病毒载体导入前列腺癌PC-3细胞内从而实现ELAVL1 mRNA和蛋白的特异性沉默,并在此基础上通过检测细胞增殖能力及细胞周期,从而观察ELAVL1对PC-3细胞生长的作用;之后通过检测与上述生物学作用相关的蛋白分子及肿瘤经典信号通路磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)中的蛋白分子实现初步的机制探究;最后利用PC-3细胞构建裸鼠移植瘤模型,并给予瘤内注射携带有ELAVL1-shRNA的重组腺病毒,观察沉默ELAVL1基因表达对移植瘤生长的影响,进一步通过体内研究证实ELAVL1对前列腺癌生长的影响。
1 材料与方法
1.1 细胞和实验动物
正常前列腺上皮细胞RWPE-1和前列腺癌PC-3细胞均购于中国科学院细胞库/干细胞库。BALB/c-nu裸鼠、4~5周龄、雄性、体质量为15~18 g购自湖南斯莱克景达实验动物有限公司[实验动物生产许可证号:SCXK(湘)2016-0002)]。
1.2 试剂和仪器
携带有特异性针对ELAVL1基因的shRNA(shELAVL1)的复制缺陷型重组腺病毒Ad5-shELAVL1-GFP和对照空载体病毒Ad5-GFP由本课题组前期构建获得[9]。RPMI 1640细胞培养液和青霉素链霉素双抗购自美国HyClone公司,RWPE-1细胞专用培养液PEpiCM购自美国ScienCell研究实验室,胎牛血清和0.25%胰蛋白酶购自美国Gibco公司,二甲亚砜(DMSO)购自美国Sigma公司。兔抗人ELAVL1单克隆抗体、兔抗人环氧合酶2(cyclooxygenase-2,Cox-2)多克隆抗体、兔抗人细胞周期蛋白D1(cyclin D1)多克隆抗体、兔抗人AKT单克隆抗体,兔抗人磷酸化-AKT(phospho-AKT,p-AKt)多克隆抗体和兔抗人PI3K多克隆抗体购自英国Abcam公司;鼠抗人β-actin单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG或羊抗鼠IgG均购自北京中杉金桥生物技术有限公司;TEMED、电化学发光试剂、30%丙烯酰胺、10% SDS溶液和Triton X-100等均购自北京索莱宝科技有限公司;PVDF膜购自美国Merck Millipore公司;Alexa Fluor 594标记的羊抗兔IgG购自美国Invitrogen公司;DAPI细胞染色液购于国药集团化学试剂有限公司。CCK-8试剂盒购自北京索莱宝科技有限公司,碘化丙啶(propidium iodide,PI)和RNaseA购自美国Sigma公司。反转录试剂盒和PCR扩增试剂盒均购自东洋纺(上海)生物科技有限公司。
凝胶成像分析系统(型号:ChemiDoc-It2)为美国UVP公司产品,倒置光学显微镜(型号:CKX31)为日本Olympus公司产品,流式细胞仪(FACSVerse)为美国BD公司产品,酶联免疫检测仪(型号:Infinite 200)为瑞士TECAN公司产品,荧光显微镜(型号:MF43)为美国Advanced Microscopy公司产品。
1.3 实时荧光定量PCR法检测PC-3细胞和RWPE-1细胞中ELAVL1 mRNA的表达水平
收集前列腺癌PC-3和前列腺正常上皮细胞RWPE-1,用TRIzol试剂提取细胞的总RNA并反转为cDNA。反转录条件:按5×Reverse Transcription Buffer 2 μL、OligdT引物1 μL、RNA 1 μg和MMLV RTase 0.5 μL的比例配制反应液,用DEPC处理后的ddH2O补充至10 μL;反应条件为37 ℃ 20 min,95 ℃ 5min。反转录完成后,以此cDNA为模板,按照2×Realtime PCR Master Mix 5 μL、2条引物各0.4 μL、cDNA 0.1 μL、加ddH2O补充至10 μL的比例配制PCR反应体系;扩增条件为95 ℃ 3 min;94℃ 15 s、60 ℃ 30 s、72 ℃ 30 s,共40个循环;95 ℃ 10 s、65 ℃ 60 s、97 ℃ 1 s。引物序列见表1。反应结束后,用PCR软件生成扩增曲线和溶解曲线,定量PCR并对实验数据进行统计分析。
1.4 蛋白质印迹法检PC-3及RWPE-1细胞中ELAVL1蛋白的表达水平
将PC-3及RWPE-1细胞接种于6孔板培养板中,待细胞融合度为80%~90%时,收集细胞并提取细胞总蛋白;行10% SDS-聚丙烯酰胺凝胶电泳分离蛋白,将分离后的蛋白条带电转移至硝酸纤维素膜上;用含5%脱脂奶粉的封闭液封闭处理2 h,加入一抗[兔抗人ELAVL1单克隆抗体(体积稀释比例为1∶500)和鼠抗人β-actin单克隆抗体(内参照)(体积稀释比例为1∶1 000)]室温孵育2 h;TBST洗膜(8 min/次×3次),随后加入二抗[辣根过氧化物酶标记的山羊抗兔IgG(体积稀释比例为1∶1 000)或辣根过氧化物酶标记的山羊抗鼠IgG(体积稀释比例为1∶1 000)]均室温孵育1 h;TBST洗膜(8 min/次×3次),滴加电化学发光液后于发光成像仪中显影。
1.5 免疫组织化学法检测PC-3及RWPE-1细胞中ELAVL1蛋白的表达水平并定位
将PC-3和RWPE-1细胞接种于直径为3.5 cm的培养皿中盖玻片进行细胞爬片,细胞生长至融合度为70%时,去除细胞培养液,用PBS清洗细胞(3 min/次×3次);滴入4%多聚甲醛溶液室温下固定10 min,PBS清洗(3 min/次×3次);用3%双氧水室温下进行孵育10 min;加入含1%胎牛血清白蛋白非特异性抗原(150 µL)封闭处理10~15 min;滴加一抗[兔抗人ELAVL1单克隆抗体(体积稀释比例为1∶100)]50 µL,4 ℃下湿盒孵育过夜。PBS清洗3遍后滴加二抗,室温条件下孵育1 h。PBS清洗(4 min/次×2次)后DAB显色。常规处理后,中性树脂进行封片,放于显微镜下进行蛋白定位观察。
1.6 免疫荧光法检测PC-3和RWPE-1细胞中ELAVL1蛋白的定位
将PC-3和RWPE-1细胞接种于直径为3.5 cm的培养皿中盖玻片进行细胞爬片,细胞生长至融合度为70%时,去除细胞培养液,随后用PBS清洗细胞(3 min/次×3次),加入4%多聚甲醛室温下固定10 min,用PBS清洗细胞(3 min/次×3次);加入0.5% TritonX-100适量保证覆盖载玻片持续5 min,进行细胞膜通透。用PBS清洗细胞(3 min/次×3次),加入封闭液1~2 mL处理1.5 h进行非特异性抗原封闭。向培养皿中加入一抗[兔抗人ELAVL1单克隆抗体(体积稀释比例为1∶100)]1 mL,常温下反应2 h。BS清洗细胞(3 min/次×4次),加入用PBS稀释后的二抗(Alexa Fluor 594标记的羊抗兔IgG)1 mL,避光常温下反应2 h。PBS清洗后加入DAPI染色液染细胞核,静置3 min后,在载玻片上滴加甘油并用盖玻片进行封片,置于荧光显微镜下观察ELAVL1蛋白的定位情况。

表1 实时荧光定量PCR引物序列Table 1 The primer sequence of real-time fluorescent quantitative PCR
1.7 蛋白印迹检测感染重组腺病毒Ad5-shELAVL1-GFP后PC-3细胞中ELAVL1蛋白的沉默效率
将PC-3细胞接种于6孔板培养板中,1 d后待其融合度为60%~70%时,将重组腺病毒Ad5-shELAVL1-GFP及空载体腺病毒Ad5-GFP,按照感染复数(multiplicity of infection,MOI)=300感染PC-3细胞(以未用任何药物处理的PC-3细胞作为空白对照组);8 h后更换为新鲜完全培养液继续置于37 ℃,CO2体积分数为5%的培养箱中继续培养72 h,随后收集各组细胞并提取总蛋白。采用蛋白质印迹法检测ELAVL1蛋白的表达水平,实验流程同1.4节。
1.8 CCK-8检测沉默ELAVL1表达对PC-3细胞增殖能力的影响
用胰蛋白酶消化PC-3细胞后收集细胞,用培养液重悬细胞后计数并调整PC-3细胞密度为1×105个/mL,随后在96孔板接种100 µL/孔细胞(1×104个细胞),第2天待细胞融合度在50%~70%时按照MOI=300对每孔分别进行病毒感染。实验分组同1.6节,分为空白对照组、Ad5-shELAVL1-GFP组和对照空载体腺病毒Ad5-GFP组,每组设置4个复孔;病毒感染8 h后更换为新鲜的完全培养液,分别于第0、24、36、48和72 h时取所需检测的样品测孔中加入10 µL CCK-8溶液,置于CO2培养箱中继续孵育2 h,最后在酶标免疫检测仪波长450 nm处检测各孔的D值,并以时间-D值绘制生长曲线。
1.9 FCM法检测沉默ELAVL1表达对PC-3细胞周期的影响
细胞的分组及处理同1.7节,病毒感染后第5天用胰蛋白酶消化细胞并收集于离心管(10 mL)中,离心除去上清液,加入4 ℃预冷的PBS洗涤后,加入预冷的75%乙醇溶液固定细胞(置于-20 ℃冰箱过夜)。取出细胞再用4 ℃预冷的PBS洗涤(5 min/次×2次)。将浓度为200 µg/mL的RNA酶0.2 mL加入其中,并在避光37 ℃条件下孵育30 min,之后加入PI(100 µg/mL)0.2 mL染色,室温条件下避光进行孵育30 min,之后上流式细胞仪进行周期的检测。
1.10 蛋白质印迹法检测沉默ELAVL1表达对PC-3细胞中Cox-2、Cyclin D1、PI3K、AKT及p-AKT蛋白表达水平的影响
细胞的分组及处理同1.7节,病毒感染8 h后更换为新鲜的完全培养液,继续置于37 ℃、CO2体积分数为5%的培养箱进行培养。72 h后收集各组细胞并提取总蛋白,采用蛋白质印迹法检测Cox-2、Cyclin D1、PI3K、AKT及p-AKT蛋白的表达水平,检测流程同1.4节。一抗分别兔抗人ELAVL1单克隆抗体(体积稀释比例为1∶500)、兔抗人Cox-2多克隆抗体(体积稀释比例为1∶500)、兔抗人cyclin D1多克隆抗体(体积稀释比例为1∶500)、兔抗人PI3K多克隆抗体(体积稀释比例为1∶300)、兔抗人AKT单克隆抗体(体积稀释比例为1∶200)、兔抗人p-AKT多克隆抗体(体积稀释比例为1∶200),鼠抗人β-actin单克隆抗体(体积稀释比例为1∶1 000),二抗为辣根过氧化物酶标记的山羊抗兔IgG或山羊抗鼠IgG(体积稀释比例均为1∶1 000)。
1.11 前列腺癌PC-3细胞皮下移植瘤模型建立
裸鼠购买后于无特定病原体(specific pathogen-free,SPF)级环境中适应饲养3 d。将PC-3细胞接种于培养皿中,待细胞融合度为70%时收集细胞并调整细胞密度为1×107个/mL。取100 µL(细胞数约为1×106个)细胞悬液采用注射的方法接种于裸鼠左侧腹部皮下。2周后,以裸鼠左侧腹部出现直径>5 mm的移植瘤提示裸鼠移植瘤构建成功。
1.12 Ad5-shELAVL1-GFP抑制前列腺癌PC-3细胞皮下移植瘤的生长
PC-3细胞接种2周后,采用随机数字表法将移植瘤构建成功的裸鼠共27只随机分为3组,每组9只,采用瘤内注射的方式分别给予0.9%氯化钠溶液、重组腺病毒Ad5-shELAVL1-GFP及空载体腺病毒Ad5-GFP治疗;每只裸鼠每次瘤内注射腺病毒(病毒滴度为2×1011pfu/mL)50 μL,每周2次,连续2周。0.9%氯化钠溶液作为空白对照组同样按照上述给药方式和剂量给药。
首次给药后每3 d一次记录裸鼠移植瘤的长(a)短(b)径,计算肿瘤体积并绘制肿瘤体积增长曲线,肿瘤体积=1/2×a×b2。18 d后处死所有小鼠取出移植瘤称重。
1.13 统计学方法
采用SPSS19.0统计软件对所有的实验数据进行统计学分析,计量资料采用表示。组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义
2 结果
2.1 ELAVL1 mRNA和蛋白在前列腺癌中的表达情况
实时荧光定量PCR法检测结果(图1A)显示,正常前列腺正常上皮RWPE-1细胞和前列腺癌PC-3细胞中ELAVL1 mRNA的相对表达量分别为1.0±0.04和2.11±0.02,PC-3细胞中ELAVL1 mRNA的表达水平较RWPE-1细胞明显上调(P<0.001)。
蛋白质印迹法检测结果(图1B)同样显示,PC-3细胞中的ELAVL1蛋白的表达水平明显高于RWPE-1细胞,差异具有明显的统计学意义(P<0.001)。
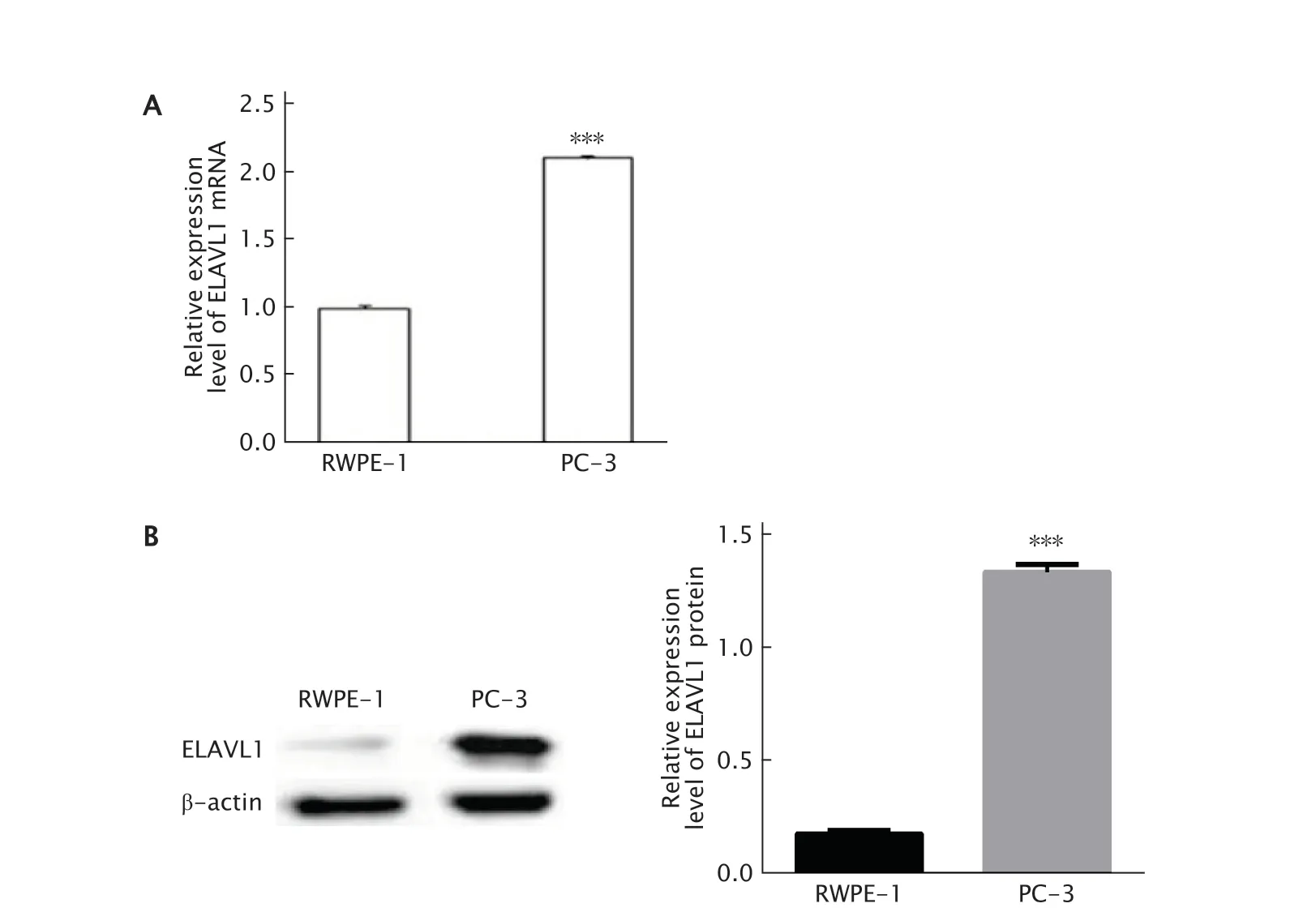
Fig.1 The expression levels of embryonic lethal abnormal vision (ELAVL1) mRNA and protein in normal prostate epithelial cells RWPE-1 and prostate cancer PC-3 cells were detected by real-time fluorescent quantitative PCR (A) and Western blotting (B),respectively.***P<0.001,vs RWPE-1 cells (n=3).图1 分别采用实时荧光定量PCR和蛋白质印迹法检测ELAVL1 mRNA(A)及蛋白(B)在前列腺正常上皮RWPE-1细胞和前列腺癌PC-3细胞中的表达水平
上述结果说明,ELAVL1在前列腺癌细胞中的表达水平明显提高。
2.2 ELAVL1蛋白在前列腺癌细胞中的表达定位
免疫组织化学检测结果(图2A)显示,RWPE-1细胞核中ELAVL1蛋白染色较深,细胞质中染色较浅并且无ELAVL1蛋白染色颗粒,提示ELAVL1蛋白主要集中表达于细胞核中;而在PC-3细胞中,细胞核中该蛋白染色较浅,细胞质中出现明显的蛋白染色颗粒提示ELAVL1蛋白主要在细胞质中表达。
免疫荧光法检测结果(图2B)显示,正常前列腺上皮RWPE-1细胞中ELAVL1蛋白的红色荧光在细胞核和细胞质中均出现,融合后的图片显示RWPE-1细胞核呈现紫色,细胞质红色荧光较浅,说明ELAVL1蛋白主要表达在细胞核中,细胞质中较少。而在前列腺癌PC-3细胞中,红色荧光主要富集在细胞质中,融合后图片显示细胞核仍为蓝色,细胞质红色荧光较亮,说明ELAVL1蛋白主要表达在细胞质中。
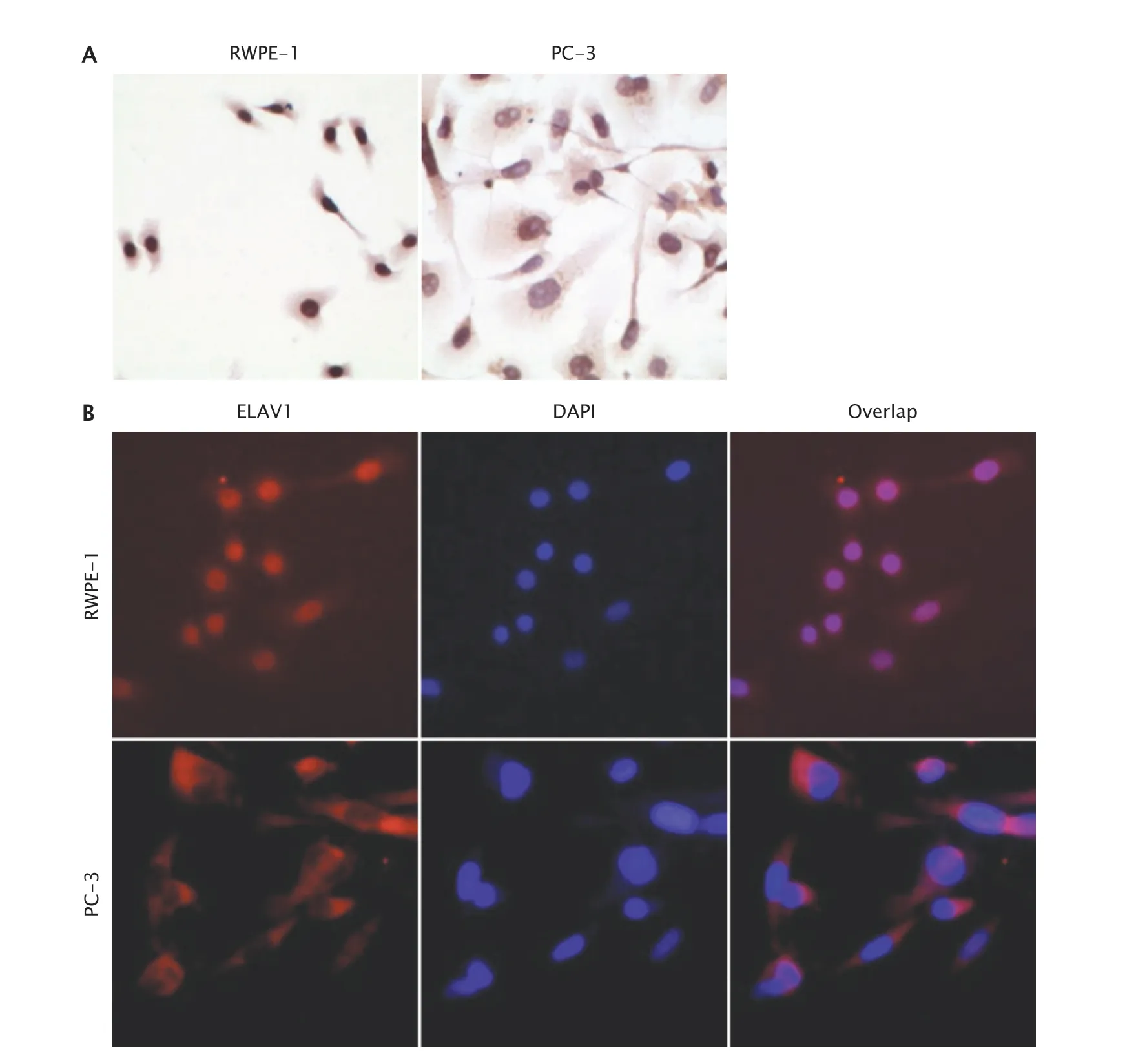
Fig.2 The localization of embryonic lethal abnormal vision (ELAVL1) protein in normal prostate epithelial cells RWPE-1 and prostate cancer PC-3 cells were detected by immunohistochemical method (A,DAB,×400) and immunofluorescence (B,×400),respectively.图2 分别采用免疫组织化学法(A,DAB,×400)和免疫荧光法(B,×400)检测ELAVL1蛋白在正常前列腺上皮RWPE-1细胞和前列腺癌PC-3细胞中的定位情况
2.3 沉默ELAVL1基因表达对前列腺癌PC-3细胞增殖能力的影响
PC-3细胞感染重组腺病毒Ad5-shELAVL1-GFP后,蛋白质印迹法检测结果(图3A)显示,与对照组相比,Ad5-shELAVL1-GFP组中ELAVL1蛋白的表达水平明显下调(P<0.05)。这一结果提示,PC-3细胞中ELAVL1基因被有效的沉默。
CCK-8法检测结果(图3B)显示,Ad5-shELAVL1-GFP组PC-3细胞的D值在0、24和36 h分别与Ad5-GFP组和空白对照组相比,差异均无统计学意义(P值均>0.05);而在48和72 h时Ad5-shELAVL1-GFP组细胞的D值较Ad5-GFP组明显降低,差异有统计学意义(P值均<0.05)。Ad5-GFP组和空白对照组在0、24、36、48和72 h的D值差异无统计学意义(P值均>0.05)。以上结果说明,对照重组腺病毒空体载Ad5-GFP对PC-3细胞的增殖能力无明显的影响,而在ELAVL1-shRNA沉默ELAVL1基因表达后0、24和36 h时抑制细胞增殖能力的作用不显著,在48和72 h时其抑制细胞增殖能力的作用明显提高。
2.4 沉默ELAVL1基因对前列腺癌PC-3细胞周期的影响
FCM法检测结果(图4)显示,腺病毒空载体Ad5-GFP组PC-3细胞中G1期细胞所占的比例为(73.67%±1.41)%,明显高于Ad5-shELAVL1-GFP组的(50.02±1.73)%,差异具有统计学意义(P<0.05);而腺病毒空载体Ad5-GFP组中G2期细胞所占的比例为(6.19±0.35)%,明显低于Ad5-shELAVL1-GFP组的(26.92±1.83)%,差异具有统计学意义(P<0.05);腺病毒空载体Ad5-GFP组中G1期细胞和G2期细胞所占的比例与空白对照组相比,差异均无统计学意义(P值均>0.05)。
以上结果说明沉默ELAVL1基因能够使得前列腺癌PC-3细胞周期被阻滞于G1期。
2.5 沉默ELAVL1基因表达对前列腺癌PC-3细胞中Cox-2、cyclin D1、PI3K、AKT和p-AKT等蛋白表达水平的影响
蛋白质印迹法检测了各组PC-3细胞中ELAVL1、AKT、cyclin D1、p-AKT、Cox-2和PI3K蛋白的相对表达水平。结果(图5)显示,与对照组空载体腺病毒Ad5-GFP组相比,重组腺病毒Ad5-shELAVL1-GFP组PC-3细胞中与细胞周期及增殖相关蛋白cyclin D1和Cox-2及与PI3K/AKT信号通路相关的蛋白AKT、p-AKT和PI3K的表达水平均明显下调,差异有统计学意义(P值均<0.05)。这一结果说明,沉默ELAVL1基因表达后,AKT、PI3K、p-AKT、cyclin D1及Cox-2等蛋白的表达水平随之下降,表明在肿瘤细胞PC-3中ELAVL1可能参与了调控细胞的增殖及周期,并涉及到PI3K/AKT信号通路。
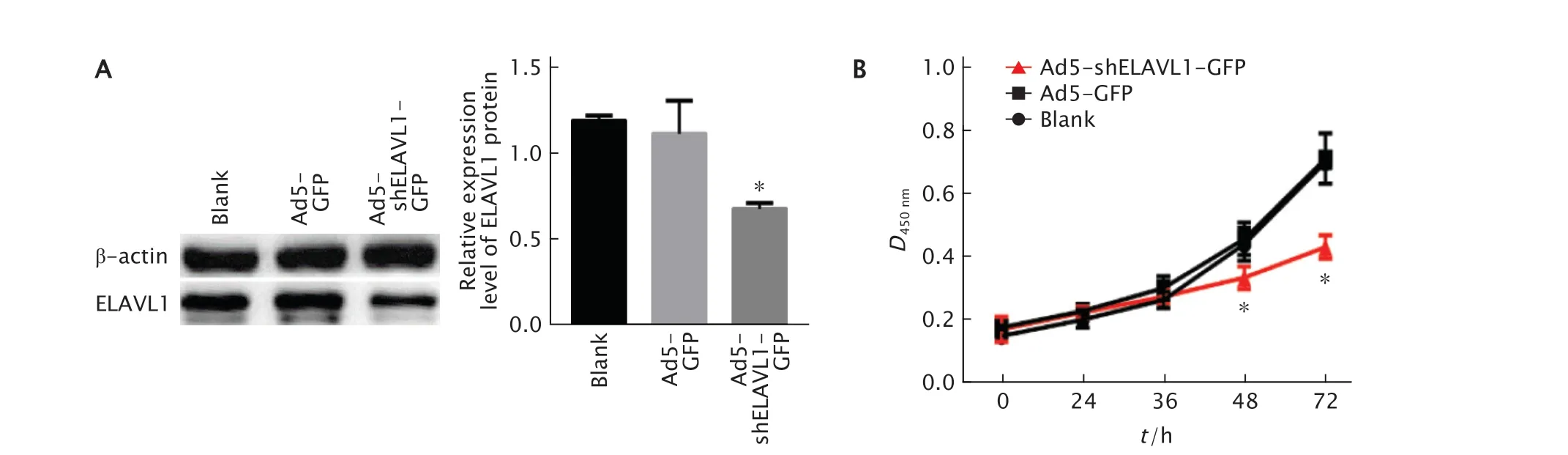
Fig.3 The expression level of embryonic lethal abnormal vision-like 1 (ELAVL1) protein in prostate cancer PC-3 cells infected with recombinant adenovirus Ad5-shELAVL1-GFP was detected by Western blotting (A),the effect of silencing ELAVL1 gene on proliferation of PC-3 cells was detected by CCK-8 method (B).PC-3 cells were infected with adenovirus empty vector Ad5-GFP as the control;PC-3 cells were treated without any drugs as the blank control.*P<0.05,vs Ad5-GFP group (n=3).图3 采用蛋白质印迹法检测PC-3细胞中ELAVL1蛋白的沉默效果(A)及CCK-8法检测沉默ELAVL1基因表达对PC-3细胞增殖的影响(B)

Fig.4 The effect of silencing embryonic lethal abnormal vision (ELAVL1) gene in PC-3 cells on cell cycle distribution was detected by FCM assay.PC-3 cells were treated without any drugs as the blank control,PC-3 cells were infected with adenovirus empty vector Ad5-GFP as the control.*P<0.05 (n=3).图4 沉默ELAVL1基因表达对PC-3细胞周期的影响
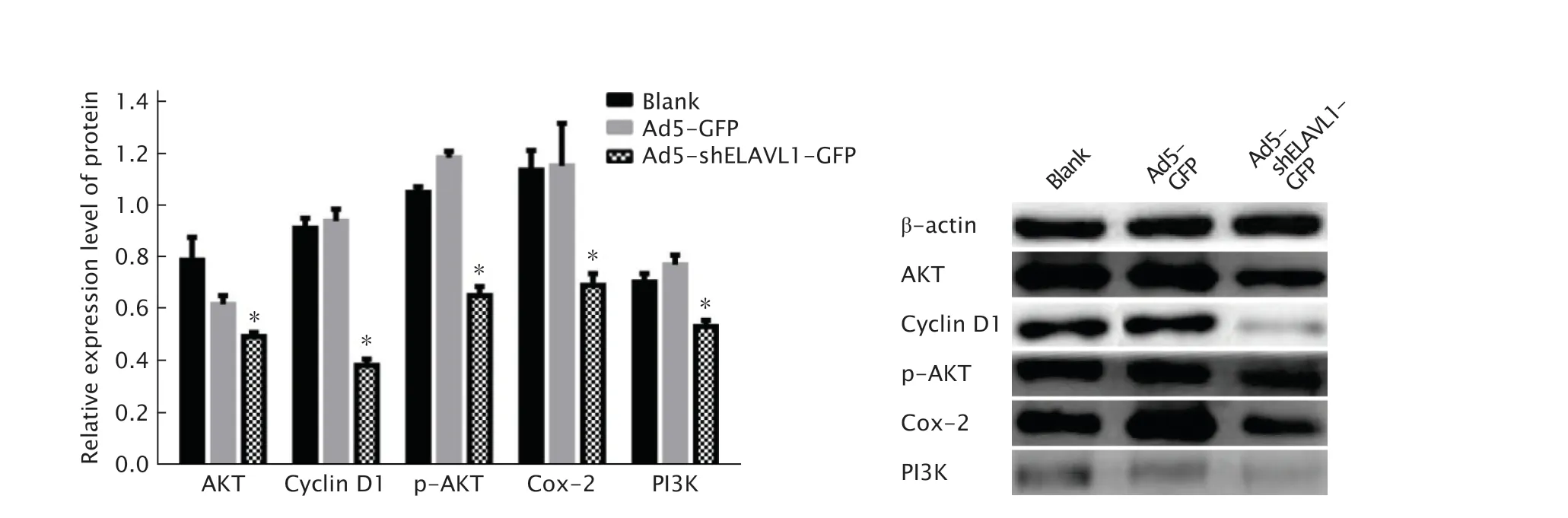
Fig.5 The effect of silencing embryonic lethal abnormal vision (ELAVL1) gene in PC-3 cells on the protein expressions of protein kinase B (PKB,also known as AKT),cyclin D1,phospho-AKT (p-Akt),cyclooxygenase-2 (Cox-2) and phosphatidylinositol 3-kinase (PI3K) were detected by Western blotting.PC-3 cells were treated without any drugs as the blank control,PC-3 cells were infected with adenovirus empty vector Ad5-GFP as the control.*P<0.05,vs Ad5-GFP group (n=3).图5 蛋白质印迹法检测沉默ELAVL1基因表达对PC-3细胞中AKT、cyclin D1、p-AKT、Cox-2和PI3K蛋白表达的影响
2.6 重组腺病毒Ad5-shELAVL1-GFP对前列腺癌PC-3细胞移植瘤的作用
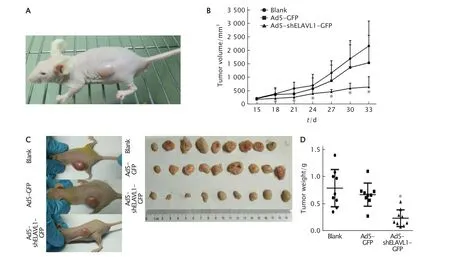
Fig.6 The effect of intratumoral injection of recombinant adenoviral vector Ad5-shELAVL1-GFP on the growth of prostate cancer PC-3 cells xenografts in nude mice.A:Xenograft tumors on the 14th day after subcutaneous injection of PC-3 cells in the left abdomen of nude mice;B:Comparison of growth curves of xenograft tumors of PC-3 cells in nude mice.Xenograft tumors that were treated with 0.9% sodium chloride solution.C:On day 33,observation of xenograft tumors in nude mice treated with Ad5-shELAVL1-GFP,treated with 0.9% sodium chloride solution as the blank control,and treated with Ad5-GFP as the control.D:Comparison of the weight of xenograft tumors obtained from nude mice,treated with Ad5-shELAVL1-GFP,treated with 0.9% sodium chloride solution as the blank control,and treated with Ad5-GFP as the control.*P<0.05,vs Ad5-GFP (n=9).图6 瘤内注射重组腺病毒Ad5-shELAVL1-GFP对裸鼠前列腺癌PC-3细胞移植瘤生长的影响
将PC-3细胞接种于裸鼠左侧腹部皮下,14 d后在接种处出现圆形饱满的移植瘤(图6A),次日开始将重组腺病毒Ad5-shELAVL1-GFP、对照空载体腺病毒Ad5-GFP及0.9%氯化钠溶液(空白对照组)进行瘤内注射。在瘤内注射病毒期间,小鼠饮食、活动能力、毛色和精神状况均良好,移植瘤生长曲线结果显示(图6B),Ad5-shELAVL1-GFP组的裸鼠肿瘤生长速度与对照组相比明显减缓(P<0.05),而对照病毒组与空白对照组之间差异无统计学意义(P>0.05)。第33天时对裸鼠荷瘤体积大体观察(图6C)可见,Ad5-shELAVL1-GFP组裸鼠的移植瘤较对照病毒组和空白对照组明显缩小。对3组移植瘤标本的称重结果(图6D)显示,Ad5-shELAVL1-GFP组、对照病毒组和空白对照组移植瘤的质量分别为(0.24±0.15)g、(0.67±0.21)g和(0.79±0.34)g,Ad5-shELAVL1-GFP组与对照病毒组和空白对照组相比,差异具有统计学意义(P<0.05),而对照组和空白对照组间则差异无统计学意义(P>0.05)。
上述结果说明,沉默ELAVL1基因表达能够减缓前列腺癌肿瘤的生长。
3 讨论
已有的研究表明,前列腺癌组织中ELAVL1的表达水平明显高于正常前列腺组织[8]。本研究中发现,前列腺癌PC-3细胞中ELAVL1蛋白的表达水平明显高于正常前列腺上皮细胞RWPE-1,该结果符合前述前列腺癌临床样本的研究结果。另外以往研究中也已证实,在其他肿瘤中包括肝癌、乳腺癌和肺癌等,ELAVL1蛋白的表达水平高于正常组织[5,10-11],本研究结果符合ELAVL1在其他肿瘤中的表达情况。此外,本研究中发现ELAVL1在前列腺癌PC-3细胞中主要集中表达于细胞质中,而在RWPE-1中主要表达于细胞核上。ELAVL1蛋白在细胞核和细胞质中均有表达,正常情况其主要位于细胞核中,在受到刺激后ELAVL1蛋白与目的mRNA结合穿梭至细胞质中进行调控,之后mRNA被释放,ELAVL1返回细胞核[2]。因此,细胞质中的ELAVL1才能真正发挥调控生物学的作用。多项研究发现,肿瘤细胞中高表达的ELAVL1主要集中于细胞质,且这些细胞质中的ELAVL1具有显著促肿瘤作用[12-15],由此可见细胞质中ELAVL1的堆积是其促肿瘤作用的关键。本研究中发现,与RWPE-1细胞相比,高表达的ELAVL1在PC-3细胞中主要位于细胞质中,初步推测与其他肿瘤一样,ELAVL1对于前列腺癌发生和发展同样具有促进作用。
肿瘤的生长依赖于细胞积极的分裂,已有的研究报告显示ELAVL1基因与细胞周期相关蛋白包括cyclin D1、cyclin E1和cyclin A2等[16-18],沉默ELAVL1基因表达后这些周期相关蛋白的表达均呈下降趋势。如YUAN等[19]在乳腺癌中的研究发现ELAVL1基因被敲减后,肿瘤细胞的生长缓慢,cyclin D1的表达水平也呈下调趋势。MURALIDHARAN等[20]在肺癌中的研究结果也同样显示,利用siRNA干扰技术沉默ELAVL1基因表达后,肺癌细胞的增殖能力被明显抑制,cyclin D1和cyclin E的表达水平明显减低。在前列腺癌的有关研究中,已经有学者证实了Cox-2表达也与肿瘤的进展和预后差有关[21]。有关ELAVL1蛋白和Cox-2之间关系,有研究发现沉默ELAVL1基因表达可以引起Cox-2的表达下调[8]。本研究中同样发现,沉默ELAVL1基因表达后PC-3细胞的生长被抑制,且细胞周期被阻滞于G1期;与细胞增殖有关的分子cyclin D1和Cox-2蛋白的表达水平下降。体内裸鼠PC-3细胞移植瘤模型实验进一步证实了,敲低ELAVL1基因表达后能够抑制肿瘤的生长。上述研究结果充分说明,前列腺癌中高表达的ELAVL1可能是通过细胞周期促进前列腺癌的发展。
肿瘤发生和发展的信号通路有很多,包括Janus激酶(janus kinase,JAK)/信号转导及转录激活因子(signal transducer and activator of transcription,STAT)信号通路、PI3K/AKT信号通路以及丝裂原活化蛋白激酶(mitogen-activate protein kinase,MAPK)通路等[22],尽管目前许多研究证明了ELAVL1基因与多种肿瘤生物活动相关的生物分子有关,但是目前有关详细ELAVL1蛋白信号通路的研究报道不多,有学者在神经胶质瘤研究中认为ELAVL1通过PKM2/ELAVL1/p27信号通路来促进肿瘤的发生和发展[23],也有学者在血液肿瘤研究中发现ELAVL1影响鼠双微体基因2(murine doubleminute 2,MDM2)-p53信号通路[24]。本研究中发现,沉默ELAVL1基因表达可导致PI3K/AKT信号通路中的PI3K、AKT和p-AKT蛋白表达水平下调,提示ELAVL1蛋白通过影响PI3K/AKT信号通路促进肿瘤的发生和发展。然而,本研究未进一步探究PI3K/AKT信号通路的抑制是cyclin D1和Cox-2的表达下调的上游机制,但根据文献报道在肿瘤PI3K/AKT信号通路中,其下游调控的分子包含cyclin D1和Cox-2[25-26],因此推测ELAVL1蛋白可能通过PI3K/AKT信号通路进而调控cyclin D1和Cox-2表达从而影响PC-3细胞的生长。

