单中心PAD、PCD与RVD方案治疗新诊断多发性骨髓瘤的疗效及成本-效果分析
杨 宁,刘 佳,肖 菲,李 昕,徐 岚,侯 健,钟 华
近年来,随着我国进入人口老龄化,多发性骨髓瘤(multiple myeloma,MM)的发病率呈上升趋势。随着免疫调节药物(来那度胺)、蛋白酶体抑制剂(硼替佐米和依沙佐米)和单克隆抗体[兆珂(达雷妥尤单抗注射液)]等药物在国内的上市应用,MM的总生存期(overall survival,OS)在过去20年中有了显著改善,患者OS也从<3年延长到8年左右[1-2]。国内外多项临床试验均证实,基于来那度胺和(或)硼替佐米等新药的联合化疗可极大改善MM患者的疗效,延长MM患者的生存期,并已成为治疗新诊断多发性骨髓瘤(newly diagnosed multiple myeloma,NDMM)患者的一线诱导化疗方案[3]。尽管如此,MM总体上仍然是一种不能治愈的疾病,绝大多数患者终将复发而不治。因此迫切需要优化现有治疗策略,在筛选出疗效更好、不良反应更小的药物组合,进一步提高治疗效果的同时,尽可能减少患者治疗过程中的经济负担。药物经济学是一门运用现代经济学手段,结合流行病学、生物统计学和决策学等多学科的研究结果,全面地分析药物治疗(包括非药物治疗)备选方案的成本、效果和效益,评价其经济学价值的学科。其目的在于以最小的成本取得较大的利益,进而使有效的药物资源得到最佳的利用和最优的配置。随着硼替佐米和来那度胺在MM治疗地位中的提高,国外有关硼替佐米和来那度胺治疗MM的药物经济学研究逐渐增多。然而,在中国药物经济学评价起步较晚,相关的药物经济学价值研究尚较少。鉴于硼替佐米和来那度胺等化疗药物价格昂贵,并且随着治疗效果的提高,MM患者治疗病程较以前显著延长,患者需要承受一定的药物使用经济压力,因此针对MM患者临床用药的药物经济学研究有很大意义。本研究拟回顾性分析本中心近5年来采用硼替佐米联合环磷酰胺和地塞米松,硼替佐米联合来那多胺和地塞米松以及硼替佐米联合多柔比星和地塞米松方案治疗NDMM患者的疗效及不良反应发生的情况,希望为以后患者临床化疗方案的选择使用提供借鉴。
1 资料与方法
1.1 患者资料
以本院2014年7月—2019年12月收治的接受PAD方案、PCD方案和RVD方案进行诱导治疗的93例NDMM患者为研究对象。患者中位年龄60岁(范围:44~78岁);其中男性为51例,女性为42例,男∶女比例为1.21∶1,按MM国际分期系统(International staging system,ISS)Ⅰ期11例,Ⅱ期49例,Ⅲ期33例。本研究获得上海交通大学医学院附属仁济医院医学伦理委员会审查通过,所有患者签署知情同意书。
1.2 纳入和排除标准
纳入标准:(1)符合MM诊断标准的NDMM患者,诊断标准参照中国MM诊治指南(2017年修订)[4];(2)具有完整临床资料,坚持完成规定疗程并可随访的患者;(3)化疗方案为PCD、PAD和RVD的患者且连续化疗4个疗程以上;(4)不合并其他恶性肿瘤的患者。
排除标准:(1)原发或继发浆细胞白血病;(2)有MM中枢侵犯;(3)重度肾功能不全[血清肌酐(serum creatinine,Scr)<30 mL/min]的患者;(4)先前或目前已接受MM系统治疗的患者;(5)有深静脉血栓及肺栓塞病史的患者;(6)对预防性抗凝治疗有禁忌症的患者;(7)接受过器官移植的患者;(8)在入组前3年内有其他类型恶性肿瘤病史的患者;(9)需接受连续性、系统性免疫抑制治疗的患者;(10)持续或活动性感染、已知人类免疫缺陷病毒呈阳性、活动性乙肝或丙肝感染;(11)入组前1月内接受过大型手术治疗的患者;(12)妊娠期或哺乳期患者;(13)患者不能够遵守研究访视计划和其他方案要求(包括血液取样和骨髓穿刺);(14)患者的初始诊断检测项目结果及预后分层数据有重要缺项者。
1.3 治疗方案
PAD方案具体用药:硼替佐米1.3 mg/m2,d1、d4、d8和d11静脉注射;多柔比星9 mg/m2,第1 d~第4 d静脉滴注;地塞米松40 mg,d1、d4、d8和d11静脉注射。PCD方案具体用药:硼替佐米1.3 mg/m2,每周1次静脉注射;环磷酰胺400 mg/m2,每周1次静脉注射;地塞米松40 mg,每周1次静脉注射。RVD方案具体用药:硼替佐米1.3 mg/m2,每周1次静脉注射;地塞米松40 mg,每周1次静脉注射;来那度胺25 mg/d,第1~21 d口服。3组患者连续治疗4周为1个疗程,接受4个疗程诱导治疗后评估疗效。
1.4 疗效评价
根据中国MM诊治指南(2017年修订)[4]指定的统一标准进行疗效评估,分为完全缓解(complete response,CR)、非常好的部分缓解(very good partial response,VGPR)、部分缓解(partial response,PR)、微小缓解(minimal response,MR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。计算总缓解率(overall response rate,ORR),ORR(%)=(CR+VGPR+PR)/总患者数×100%;高质量缓解率(high quality response rate,HQR)(%)=(CR+VGPR)/总患者数×100%。所有的疗效评估均需要在开始新治疗前的任意时间连续进行2次。
1.5 不良反应分级判断标准
通过问诊和体格检查,监测3组患者化疗期间及化疗间歇期相关血常规和肝肾功能等指标,对患者出现的主要不良反应按美国国家癌症协会(national cancer institute,NCI)部分常见毒性标准(common toxicity criteria,CTC)分级(3.0版本)进行判定。
1.6 细胞遗传学检测
委托康圣环球上海新培晶医学检验所采用荧光原位杂交(fluorescencein situhybridization,FISH)法检测患者的骨髓样本是否存在细胞遗传学异常。用CD138+磁珠分选MM细胞,检测探针位点包括IgH易位、p53缺失、1q21扩增、RB1(13q14)和D13S319(13q14.3)位点。若FISH检测显示IgH易位阳性,则进一步检测t(4;14)、t(14;16)、t(11;14)。检测探针试剂盒购自美国Vysis公司。
1.7 细胞遗传学危险分组
依据Mayo骨髓瘤分层及风险调整治疗(Mayo Stratification of Myeloma and Risk-adapted Therapy,mSMART)(3.0版本)分期系统进行细胞遗传学危险分层:高危组定义为合并t(4,14)、t(14,16)、t(14,20)、1q21扩增和17p缺失/突变的患者;标危组定义为合并t(11,14)、t(6,14)或未合并其他细胞遗传学异常的患者。
1.8 治疗成本的确定
药物经济学评价中,成本是指识别出干预措施所引起的相关资源的消耗或所付出代价的各个成本项目,包括直接成本、间接成本和隐性成本。直接成本是指医疗服务活动中直接发生的成本,包括药费、诊疗费、治疗、护理、检查费、床位费、膳食费和交通费等。间接成本是指由于疾病、伤残或死亡造成患者及其家庭的损失,包括休学、休工和早亡等造成的工资损失。隐性成本是指因疾病或实施预防所引起的疼痛、忧虑和紧张等生理和精神上的痛苦和不适[5]。由于休工和休学等造成的间接成本及隐性成本难以预测,所以本研究只考虑直接成本,同时去除各种不确定因素,如交通费等。具体包括药费、检查、检验、治疗、材料、床位、膳食和其他费用,同时包括不良反应造成的费用。所有成本均从病例系统收集而来,3组均计算4个疗程的总费用。
1.9 随访
所有患者均经门诊或住院资料查阅和电话联系方式进行随访,随访截止日期为2019年12月,中位随访时间为16.0个月(范围:3~51个月)。3组共入组患者97例,其中4例病人失访,后续未纳入研究。随访率为95.88%。
1.10 统计学方法
采用SPSS 21.0软件进行统计学分析。患者临床特征的比较采用Mann-WhitneyU检验和χ2检验,生存分析采用Kaplan-Meier生存曲线,治疗反应率的比较采用χ2检验,非参数秩和检验和Fisher’s精确检验,不良反应的比较采用Fisher’s精确检验。全部统计方法均采用双侧检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
PAD组31例,中位年龄60岁(范围:44~78岁);PCD组30例,中位年龄59岁(范围:49~77岁);RVD组32例,中位年龄61岁(范围:48~77岁),3组患者的中位年龄及主要临床特征(性别、诊断分型、分期和危险分层)差异均无统计学意义(P值均>0.05)(表1)。
2.2 疗效分析
PAD、PCD与RVD组患者治疗后的ORR分别为80.64%(25/31)、80.00%(24/30)和90.63%(29/32),差异无统计学意义(P=0.441)。HQR分别为41.94%(13/31)、36.67%(11/30)和62.50%(20/32),差异无统计学意义(P=0.096)。PAD、PCD与RVD组细胞遗传学高危患者治疗后的ORR分别为72.22%(13/18)、70.59%(12/17)和83.33%(15/18),细胞遗传学低危的患者治疗后的ORR分别为92.31%(12/13)、92.31%(12/13)和100.00%(14/14)。将细胞遗传学高危的患者的治疗效果与细胞遗传学低危的患者的疗效相比较,发现细胞遗传学低危患者的总有效率均为90%以上,高于细胞遗传学高危患者的总有效率,差异无统计学意义(P=0.533)。

表1 患者一般资料比较Table 1 Comparison of baseline information among PAD,PCD and RVD groups Total=93,n
2.3 生存分析
截至末次随访时间2019年12月,中位随访时间为16.0个月(范围:3~51个月)。PAD组mPFS预估为28.0个月[95%可信区间(conidence interval,CI):21.2~34.8],PCD组mPFS预估为29.0个月(95%CI:22.1~35.8),RVD组mPFS预估为24.0个月(95%CI:20.5~27.5)。PAD、PCD和RVD组间差异无统计学意义(P=0.35)。
2.4 不良反应
3组患者均有的非特异性不良反应,包括疲劳、四肢末梢麻木、反酸嗳气、腹泻、便秘和骨髓抑制等。其中,PAD方案的肝损害和骨髓抑制发生率高,肝损害发生率为12.90%(4/31),与PCD组的0.00%(0/30)和RVD组的0.00%(0/32)相比差异有统计学意义(P=0.020)。白细胞减少发生率为45.16%(14/31),与PCD组的6.67%(2/30)和RVD组的0.00%(0/32)相比差异有统计学意义(P<0.001);中性粒细胞减少发生率为38.71%(12/31),与PCD组的6.67%(2/30)和RVD组的12.50%(4/32)差异有统计学意义(P=0.003);血小板减少发生率为41.94%(13/31),与PCD组的10.00%(3/30)和RVD组的9.36%(3/32)相比差异有统计学意义(P=0.001)。RVD组患者深静脉血栓发生率较高为6.25%(2/32),但与PAD组的0.00%(0/31)和PCD组的0.00%(0/30)相比差异无统计学意义(P=0.326)。
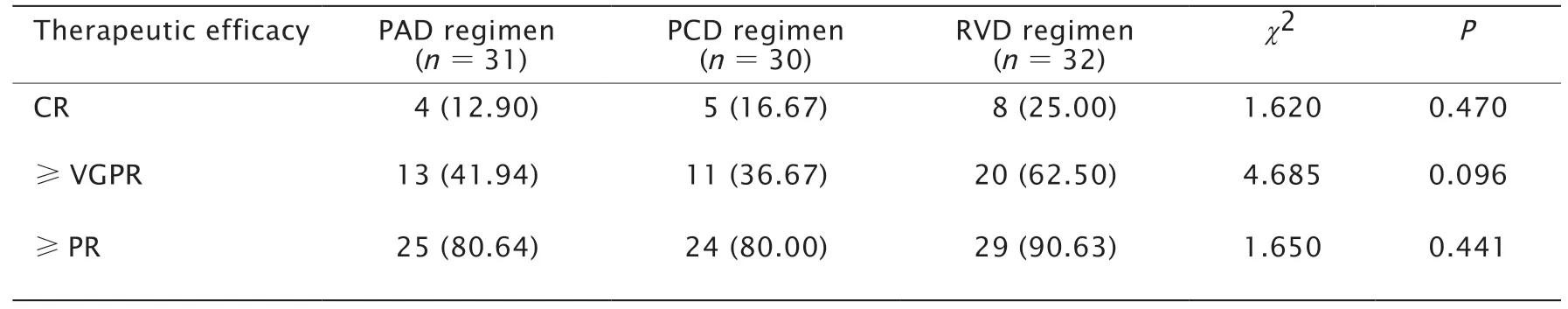
表2 PAD、PCD与RVD方案治疗NDMM患者的疗效比较Table 2 Comparison of the therapeutic efficacies among PAD,PCD and RVD regimens n (%)
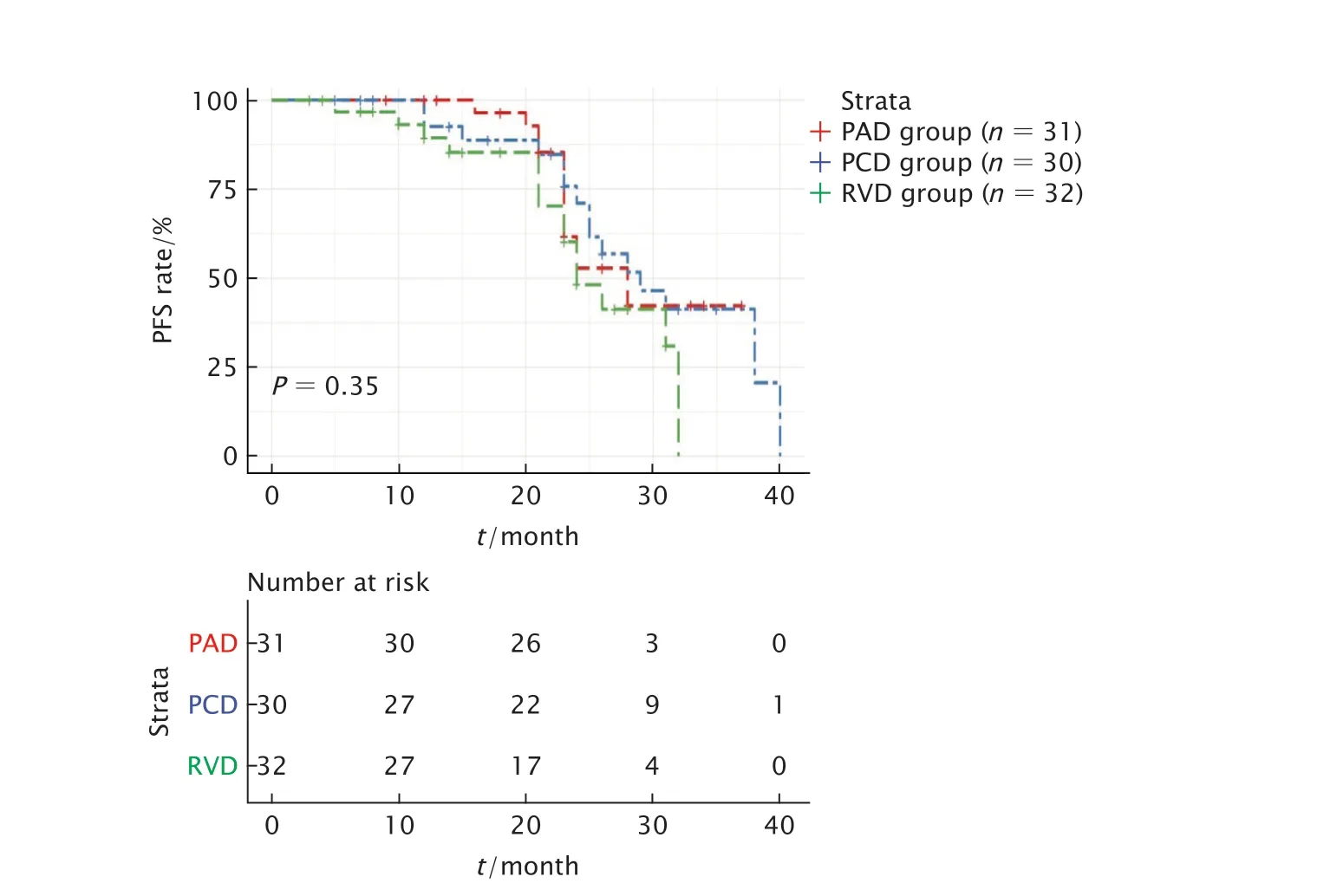
Fig.1 Progression-free survival (PFS) curves of newly diagnosed multiple myeloma (NDMM) patients treatment with PAD,PCD and RVD;PAD regimen:Bortezomib+doxorubicin+dexamethasone;PCD regimen:Bortezomib+cyclophosphamide+dexamethasone;RVD regimen:Bortezomib+lenalidomide+dexamethasone.图1 PAD、PCD和RVD方案患者的无进展生存曲线
2.5 3组患者带状疱疹发生率分析
在本研究中,93例接受硼替佐米治疗的患者中,仅有4例发生带状疱疹。其中有23例由于入组时间较早,未规范使用抗病毒药物,其余70例从硼替佐米化疗开始,预防性给予抗病毒药物如阿昔洛韦直至其所有疗程结束。在规范使用抗病毒药物的70例中,只有1例发生带状疱疹,带状疱疹发生率1.43%。未规范全程使用阿昔洛韦的23例中,3例发生带状疱疹,带状疱疹发生率13.04%。两组间差异具有统计学意义(P=0.045)。
2.6 患者的总治疗费用及纳入医保的总费用
各组方案成本均为诱导治疗的前4个疗程的费用,包括药费、检查费、治疗费、材料费、床位费、护理费及其他费用。3组患者平均总费用分别为人民币118 370.5元、115 957.1元和153858.4元。PAD组医保患者个人和统筹支付费用分别为53 158.68元和62 212.12元,分别占总费用的46.08%和53.92%。PCD组医保患者个人和统筹支付费用分别为53 037.04元和60 219.46元,分别占总费用的46.83%和53.17%。RVD组医保患者个人和统筹支付费用分别为87 553.25元和63 703.65元,分别占总费用的57.88%和42.12%。

表3 PAD、PCD与RVD方案不良反应比较Table 3 Comparison of adverse reactions amongPAD,PCD and RVD groups Total=93,n (%)
2.7 不同治疗方案成本-效果分析和敏感度分析
3组治疗成本间呈非正态分布,且方差不齐,故采用Kruskal-Wallis非参数检验。结果显示,3组治疗成本比较差异有统计学意义(P<0.01),且RVD组成本明显高于PAD组和PCD组,PCD组治疗成本最低。成本-效果分析采用的是成本与效果比,即C(总费用/元)/E(效果),用ORR代表效果。对不同方案比较时,需考虑增量成本-效果比ICER(incremental cost-effectiveness ratio,△C/△E),即每增加一个效果单位所需花费的费用,该比值越低说明此方案获得的成本-效果获益越大。其以最低成本为参照,其他成本与之对比而得的结果。
从表4可以看出,PAD组的C/E为1 430.69,PCD组为1 415.71,RVD组为1 668.95。PAD组和RVD组相对PCD组的△C/△E分别为3 303.59和3 574.8317,C/E与△C/△E显示,PCD组最低。
药物经济学评价方法中存在不确定性,使得研究结果往往与真实值存在偏差,故需进行敏感度分析。若在一定限度内的改变并不影响分析的结果就可以认为目前分析是可信的。本研究中3组方案的成本差异主要来源于药物中硼替佐米和来那度胺的价格,随着新药的不断问世和医改的进程,药品价格逐渐降低。假设硼替佐米和来那度胺成本降价20%,则总成本将发生相应的变化,由此进行敏感度分析,进行敏感度分析后结果没有改变,表明结果可靠。
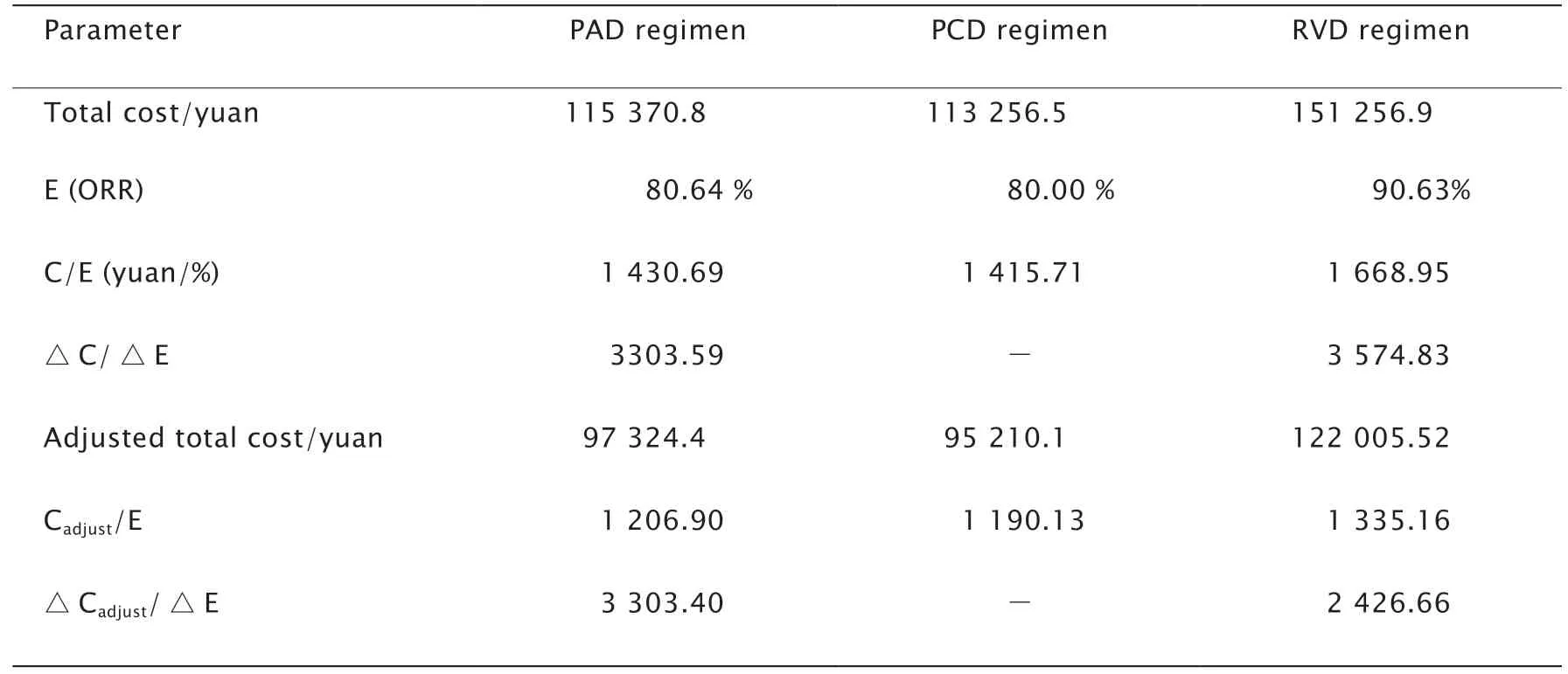
表4 PAD、PCD与RVD方案的成本-效果分析和敏感度分析Table 4 Cost-effectiveness analysis and sensitivity analysis among PAD,PCD and RVD groups
3 讨论
MM是一种克隆性浆细胞异常增殖的疾病,目前仍不能治愈。近年来以硼替佐米和来那度胺为代表的一批新药的出现,明显改善了MM患者的缓解程度及生存。硼替佐米作为一种蛋白酶体抑制剂,能直接抑制真核细胞26S蛋白酶体对多种蛋白质的降解,阻滞核因子激活的B细胞的核因子-κB(nuclear factor kappa B,NF-κB)信号通路,抑制与细胞增殖相关的基因表达,最终导致肿瘤细胞凋亡[6]。大量研究表明,含硼替佐米的治疗方案可以提高MM患者的ORR,改善其生存质量,延长生存时间[7]。来那度胺是沙利度胺的4-氨基-戊二酰基衍生物,属于第二代免疫调节剂,除通过抑制肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1(interleukin,IL-1)、IL-6和IL-12的分泌,促进肿瘤细胞凋亡外,来那度胺还能活化自然杀伤(natural killer cell,NK)细胞,增强NK细胞介导的抗体依赖细胞的细胞毒作用,增强免疫调节作用。来那度胺能抑制破骨细胞活化,对骨髓瘤患者具有重要作用[8]。硼替佐米和来那度胺等化疗药物价格昂贵,硼替佐米的市场价格为5 639.5元/盒,每个疗程用药4支的费用为2 2558元,来那度胺10 mg剂量的市场价格为1 7050元/盒,25 mg剂量的市场价格为2 1644元/疗程,药费花销巨大。自从硼替佐米进入医保以后,单用硼替佐米的患者医保总费用支付比50%以上,硼替佐米和来那度胺同时使用的患者医保总费用支付比也可达到42.12%,极大地降低了患者的经济负担。虽然得到了医疗保险的部分覆盖,但对于国内大部分MM患者,一线应用仍存在一定压力。因此如何在目前国内医保体系中选择疗效-成本最佳的治疗方案,使患者保持最好的缓解状态,对MM的临床治疗有十分重要的意义。
本研究中,PCD组患者治疗后的ORR为80.00%,HQR为36.67%。PAD组作为临床常用的一线治疗方案,治疗后的ORR为80.64%,HQR为41.94%。不良反应方面,PAD组肝损害和骨髓抑制发生率较其他2组更高,肝损害发生率12.9%,白细胞减少发生率45.2%,中性粒细胞减少发生率38.7%,血小板减少发生率41.9%。根据以往报道,PAD方案中多柔比星具有心脏累积毒性,不适宜长疗程化疗,尤其对于高龄或有心脏基础疾病患者,具有局限性[9]。赵瑜等[10]的研究也认为,PAD在提高疗效的同时不良反应发生率更高,患者可能因此而中断或延期治疗。在另一项关于PCD方案的研究中,对NDMM患者,PCD方案诱导4个周期,总有效率为80%,VGPR以上疗效为60%[11]。因此,笔者认为,PCD方案与PAD方案比较,PCD方案具有更少的不良反应,患者耐受性更好。
在本研究中,RVD组患者ORR为90.63%,HQR为62.50%。RVD组在ORR和HQR上都较PCD(80.00%和36.67%)及PAD(80.64%和41.94%)组有一定优势,但差异无统计学意义(P=0.441和P=0.096)。RVD组31.3%的患者出现神经毒性,血栓发生率(6.25%)较其他2组更高(P=0.326)。RVD组的成本明显高于PCD及PAD组,成本-效果比PCD组最低,RVD组最高。PAD和RVD组相对于PCD组的增量成本-效果比分别为3 303.59和3 574.83,即当有效率达80.00%时,每增加一个单位治疗效果,PAD组需花费3 303.59元,RVD组需花费3 574.83,敏感度分析所得结果与之前结果相符。ATTAL等[12]报道,对350例NDMM患者给予8个周期的RVD方案化疗后ORR为97%,其中48%的患者为CR和严格意义上的完全缓解(stringent complete response,sCR),3%患者为SD。而本研究中ORR为90.63%,CR率为25.00%,与之前的研究结果有在一定差异,推测与本研究入组患者较少,并且只进行了4个疗程的RVD方案有关。另有研究表明,RVD方案在NDMM患者中虽然具有更高的缓解率,但来那度胺会增加第二肿瘤的发生率(3%~8%),同时神经毒性(55%)及骨髓抑制的发生率也相对较高[13]。本研究中2例诱导治疗期间发生血栓事件,提示在RVD治疗过程中,规范血栓风险评估及采取预防性抗凝治疗的重要性。尤其对于年老及体能状况较差者,是否需要调整剂量仍有待于进一步探索。因此,笔者认为在不考虑成本情况下,RVD方案无疑为最佳方案。从安全、有效和经济的角度考虑,PCD方案优于RVD方案。
带状疱疹是与硼替佐米相关的最重要并发症之一[14],且带状疱疹会增加患者出现乏力、低热、神经痛、感染和病毒性脑炎的风险,同时也会增加患者的经济负担。研究发现,硼替佐米通过阻断NF-κB信号通路使辅助T细胞1(T helper cells 1,Th1)、CD4+T细胞、CD56+T细胞、CD8+T细胞数量减少,树突状细胞活性降低,T细胞增生受抑制。硼替佐米作用下患者的免疫缺陷状态使水痘-带状疱疹病毒激活概率增高[15]。因此,近年来NCCN指南[16]推荐,硼替佐米治疗期间可同步用药预防带状疱疹。在本研究的93例患者中,有23例由于入组时间较早,未规范使用抗病毒药物,其中3例发生带状疱疹。另70例从硼替佐米化疗开始,预防性给予抗病毒药物如阿昔洛韦直至其所有疗程结束,其中只有1例发生带状疱疹。张艳斌等[17]的研究也发现,以硼替佐米为主的化疗方案治疗MM患者297例,未使用抗病毒药物,共有35例发生带状疱疹。另一项关于伐昔洛韦预防MM患者硼替佐米治疗相关性带状疱疹的研究显示,不接受伐昔洛韦预防治疗的对照组中有15.00%的患者发生带状疱疹,与采用伐昔洛韦预防治疗的观察组差异有统计学意义[18]。另一项研究中,45例给予伐昔洛韦治疗的患者中,只有1例发生带状疱疹,而16例不给予伐昔洛韦治疗的患者中,有4例发生带状疱疹,差异有统计学意义(P<0.05)[19]。以上结果均说明,在采用硼替佐米治疗MM的过程中,对带状疱疹的预防性治疗可使疱疹病毒复制与激活得到有效控制,明显减少带状疱疹发生率,值得临床进一步推广。
本研究为单中心小样本回顾性研究,结果具有一定的局限性。并且,本研究只考虑了诱导治疗的疗效,未能考虑巩固及维持治疗,无法评价患者确切的长期获益,更准确的结果尚需扩大样本数、延长随访时间进一步验证。在成本估算方面,家庭护理及误工费等间接成本也尚未考虑。未来这些结论仍需要更多的多中心大样本的临床试验及相关的循证医学证据加以证明,以期为不同类型的MM患者制定更为经济有效和安全的治疗措施。综上所述,从药物经济学、用药安全及长远来考虑,特别是对于经济条件受限的患者而言,PCD方案不失为治疗MM的优选方案。对于有经济能力的患者来说,RVD方案无疑为最佳方案。

