不同复性方法纯化的重组大肠杆菌外膜蛋白A 小鼠免疫原性研究
肖雪 ,杨思宇 ,翟璐 ,夏洪伟 ,高玉龙 ,吴金 ,张中洋 ,朱战波 ,崔玉东
(1.黑龙江八一农垦大学,大庆163319;2.和元生物工程股份有限公司)
奶牛乳房炎是目前影响奶牛养殖业发展的重要疾病之一,不仅引起奶牛产奶量和奶品质降低,还导致奶牛产后发情周期延长,甚至失去繁殖性能,给奶牛养殖业造成巨大的经济损失[1]。据报道,引起奶牛乳房炎的病原微生物多达150 种[2],但以金黄色葡萄球菌、链球菌和大肠杆菌感染最为常见,这三类细菌引起的奶牛乳房炎可占90%以上[3],而在这三类病原菌中,肠杆菌科细菌引起的奶牛乳房炎占比高达33.6%。在临床分离的肠杆菌中,埃希氏大肠杆菌(E.coli)占76.1%,且引起的乳房炎难以治疗[4]。以往奶牛乳房炎的治疗以抗生素为主,且随着抗生素的长期和超量使用,临床上出现大量耐药菌株,致使抗生素治疗效果不佳[5]。因此,研究使用疫苗免疫预防奶牛乳房炎受到人们越来越多的关注[6]。目前,研究报道较多的是使用 E.coli(O111:B4)J5 株全菌苗免疫接种奶牛,该疫苗株是不完全O-侧链多糖突变菌株,其脂多糖的核心区和脂质A 区是暴露的,暴露区抗原刺激产生的抗体可以与革兰氏阴性肠杆菌核心抗原结合而发挥抗感染作用,并且能交叉抵抗不同血清型的E.coli 感染[7-8]。但E.coli(O111:B4)J5 疫苗的使用并不能阻止乳房内感染,只能减少临床奶牛乳房炎新病例的发生[8]。
近年来,随着亚单位疫苗的广泛研究和临床应用,国内外纷纷开展了E.coli 抗原亚单位疫苗研究。佟春玉等[9]将原核表达纯化的重组OmpT 蛋白(rOmpT)免疫小鼠,结果免疫小鼠对4 个进化种系(Phylogenetic group)不同的E.coli 攻毒的免疫保护率均为50%~60%,证明rOmpT 对各进化种系E.coli 均具有良好的免疫预防作用。俱雄等[10]将表达纯化的OmpC蛋白免疫小鼠,并用大肠杆菌进行攻毒,免疫保护率达到63.64%。呼锐等[11]原核表达了E.coli 的OmpA,通过小鼠模型实验证明rOmpA 能诱导产生特异性的IgG 抗体和淋巴细胞因子,分别用E.coli C8391 株、E.coli O157 株、E.coli J96、E.coli 2002-1 株以及福氏志贺氏菌、克雷伯氏菌对rOmpA 免疫小鼠攻毒,在对照组全部死亡时,各攻毒组免疫保护率分别为60%、60%、60%、40%、50%、30%,表明 rOmpA 不仅对E.coli 攻击具有良好免疫保护作用,且对志贺氏菌、克雷伯氏菌攻击也具有一定的交叉免疫保护作用。RAINARD 等[12]研究显示,用rOmpA 免疫能诱导奶牛抗体滴度增加,表明rOmpA 是诱导奶牛产生抗体的良好免疫原。由以上研究结果看出,rOmpA 不仅可用于预防E.coli 感染、也可用于预防肠杆菌科其他细菌感染,是具有良好开发应用潜力、预防肠杆菌感染的候选疫苗抗原。但诱导表达后的rOmpA 主要以不可溶的包涵体形式存在,且rOmpA 包涵体复性方法研究鲜有报道,为其应用带来一定困难。为此,实验室前期对rOmpA 包涵体蛋白进行了复性研究,筛选出两种较优复性方法,即使用β-环糊精、吐温-20 对包涵体形式的rOmpA 进行复性,然后纯化,获得了可溶性rOmpA。但不同方法复性后纯化的rOmpA 免疫原性如何及复性后纯化的rOmpA 与包涵体形式的rOmpA 在免疫原性上是否存在差异尚缺乏实验研究。为此,实验分别以β-环糊精复性rOmpA(βrOmpA)、吐温-20 复性 rOmpA(T-rOmpA)和包涵体rOmpA(I-rOmpA)作为抗原,比较研究了它们的免疫原性和免疫保护作用,为rOmpA 的进一步开发应用提供前期工作基础。
1 材料和方法
1.1 菌株和实验动物
重组菌株OmpA-pET32a/ BL21(DE3)由实验室构建并保存,分离于奶牛乳房炎病牛乳汁的E.coli 2002-1 菌株由实验室保存。
6~8 周龄 SPF 级雌性BALB/c 小鼠购自辽宁长生生物技术股份有限公司。
1.2 主要试剂仪器
主要试剂:PageRulerTM Prestained Protein Ladder 购自Thermo Scientific 公司;琼脂糖、胰蛋白胨、酵母提取物购自OXOID 公司;弗氏佐剂、牛血清白蛋白(BSA)购自Sigma-Aldrich Inc.公司;山羊抗小鼠IgG/辣椒根酶标记购自天根生化科技(北京)有限公司;Tris-HCl、Tris、NaCl、尿素、EDTA、TritonX-100 购自纳川生物技术有限公司;His-binding-resin 蛋白纯化柱购自上海点创生物科技有限公司;RPMI1640 购自美国 Hyclone 公司;胎牛血清(fetal bovine serum,FCS)购自 ExCell Bio 公司;干扰素-γ(INF-γ)、白介素-17A(IL-17A)、白介素-4(IL-4)、等细胞因子检测试剂盒、红细胞裂解液及200 目尼龙网购自深圳达科为生物工程有限公司。
主要仪器:电泳仪DYY-8B 型稳压稳流电泳仪,TECAN Infinite M200PRO 多功能酶标仪,Gel Doc 2000 紫外凝胶成像仪系统。
1.3 实验方法
1.3.1 rOmpA 免疫原制备
1.3.1.1 重组菌株 OmpA-pET32a/ BL21(DE3)的诱导表达
将实验室保存的重组菌株OmpA-pET32a/BL21(DE3)划线接种于LB-Amp+固体培养板中,37 ℃培养箱培养12 h 后,挑取单菌落接种3 mLLB-Amp+液体培养基中 37 ℃,180 rpm 培养 12 h,再以 1∶100 的比例转接于LB-Amp+液体培养基中,以180 rpm 于37 ℃条件下培养至菌液OD600值达到0.6~0.8 之间时,加入终浓度为0.1 mmol·L-1的IPTG 继续培养4 h,同时设置空载体菌株pET32a/BL21(DE3)作为对照。培养结束后,分别吸取1 mL 菌液,8 000 rpm 离心10 min,弃尽上清,加入无菌 dd 水 40 μL 重悬菌体沉淀,再加入5×上样缓冲液(含巯基乙醇)10 μL 震荡混匀,密封样品于沸水中煮沸10 min,待处理样品冷却至室温后取5 μL 样品进行12%SDS-PAGE 电泳鉴定。
1.3.1.2 表达的rOmpA 复性及纯化
将活化的OmpA-pET32a/BL21(DE3)重组菌以1∶100 的比例接种于 LB-Amp+液体培养基中,在 37 ℃条件下以180 rpm 震荡培养至菌液OD600值达到0.6~0.8 之间,加入终浓度为 0.1 mmol·L-1的 IPTG 继续培养 4 h,然后4 ℃ 8 000 rpm 离心10 min 收集菌体,用缓冲液(50 mmol·L-1Tris-HCl pH8.0,100 mmol·L-1NaCl)洗涤菌体两次,然后以溶液(50 mmol·L-1Tris-HCl pH8.0,100 mmol·L-1NaCl,1%Triton X-100)重悬菌体(菌液与溶液比例约为200 mL∶20 mL),冰浴超声破碎菌体(功率:150 W,破碎/间隔时间为:5 s/5 s)10 min 后,离心收集沉淀,分别用洗涤液Ⅰ(50 mmo·lL-1Tris-HCl pH8.0,100 mmol·L-1NaCl,0.5% Triton X-100,2 mol·L-1尿素)、洗涤液Ⅱ(100 mmol·L-1Tris-HCl pH8.0,300 mmol·L-1NaCl,3%Triton X-100)各洗涤一次,每次2~8 ℃冷藏柜摇床上振摇30 min,收集含有大量rOmpA 的离心沉淀物。以含8 mol·L-1尿素的溶液溶解包涵体蛋白,并分别用含β-环糊精和吐温-20 复性溶液做复性处理,然后用His-bindingresin 柱纯化复性蛋白,利用紫外分光光度计测定蛋白质浓度,调节蛋白浓度至1 mg·mL-1备用。
包涵体rOmpA 纯化即以含8 mol·L-1尿素的溶液溶解包涵体蛋白后,用His-binding-resin 柱纯化蛋白,纯化后蛋白溶液用PBS 溶液透析24 h,浓缩透析溶液,留取包涵体固体沉淀,PBS 溶液吹悬包涵体固体使其均匀分布在PBS 溶液中。分别取上述复性纯化和包涵体rOmpA 悬液,进行SDS-PAGE 电泳,检测蛋白纯度和确定含量。
1.3.1.3 rOmpA 蛋白亚单位疫苗的制备
分别取β-环糊精复性rOmpA、吐温-20 复性rOmpA 和包涵体 rOmpA,用无菌 PBS 稀释至 1 mg·mL-1,用弗氏佐剂以1∶1 比例与蛋白溶液充分混合,用齿科银汞调和器(Amalgamator)30 s·次-1,乳化数次,直至乳化蛋白滴至水中不迅速散开为止,将乳化完蛋白吸入无菌注射器中,4 ℃保存备用。
1.3.2 实验动物分组及免疫接种
取6~8 周龄SPF 级雌性BALB/c 小鼠随机分成4 组,每组 20 只,分别标记为 PBS 组、β-环糊精复性rOmpA 免疫组(β-rOmpA)、吐温-20 复性 rOmpA 免疫组(T-rOmpA)、包涵体 rOmpA 免疫组(I-rOmpA)。饲养一周后,每只小鼠以50 μg 抗原剂量与等量弗氏完全佐剂乳化后于腿部肌肉免疫接种。初次免疫接种后21 d,每只小鼠以同样抗原剂量与等量弗氏不完全佐剂乳化后进行加强免疫。
1.3.3 间接ELISA 测定抗体水平
在加强免疫接种后第14 d,每组随机取出4 只小鼠进行眼球采血,收集血清。E.coli 2002-1 全菌80 ℃水浴热灭活30 min 备用,酶标板中每孔分别包被包涵体rOmpA 纯化得到的可溶性rOmpA 蛋白0.2 μg,热灭活的 E.coli 2002-1 全菌 1×106CFU,4 ℃包被过夜,次日弃去包被液,每孔加入200 μL PBST重复洗涤3 次;然后每孔加入5%脱脂100 μL,于37 ℃孵育1 h,弃去孔内液体,PBST 洗涤3 次后,每孔加入 1∶1 600 倍稀释的小鼠血清 100 μL,37 ℃孵育 1 h,再 PBST 洗涤 3 次后,每孔加入 100 μL 以 1∶5 000 倍稀释的 Goat anti-mouse HRP-IgG 二抗,37 ℃孵育1 h,PBST 洗涤 3 次后,每孔加入 100 μL TMB 显色液,避光放置15 min 后,每孔加入50 μL 的终止液(2 mol·L-1硫酸)终止反应,在终止反应 10 min 内,用酶标仪测定波长450 nm 处各孔吸光度值。
1.3.4 脾淋巴细胞分离与细胞因子检测
在加强免疫接种后7 d,每组随机取4 只小鼠,无菌取出小鼠脾脏,在含有3 mL 的RPMI-1640 细胞培养液的35 mm 细胞培养皿上覆盖一张200 目尼龙网,将脾脏放置于尼龙网上,使用无菌注射器的活塞轻轻碾压小鼠脾脏使细胞穿过尼龙网悬于RPMI-1640 培养液中,制备细胞悬液;将细胞悬液转移至15 mL 离心管中,1 000 rpm 室温离心 5 min 后,弃去上层清液;加入1 mL 红细胞裂解液使红细胞裂解,37 ℃处理 2 min 后加入 9 mL 的 RPMI-1640 培养液终止反应;1 000 rpm 室温离心3 min,弃去上清;使用RPMI-1640 培养液清洗细胞3 次,末次清洗结束后,1 000 rpm 室温离心3 min 后,弃去上清,加入适量完全RPMI-1640 培养液(含10%胎牛血清,100 U青霉素·mL-1,100 U 链霉素·mL-1)重悬细胞,并调节细胞浓度至1×106cells·mL-1,将稀释好细胞铺于12孔细胞培养板中(1 mL·孔-1),每孔分别加入包涵体rOmpA 纯化得到的可溶性rOmpA 蛋白30 μg,热灭活的E.coli 2002-1 全菌体1×107CFU,置于细胞培养箱中(37 ℃、5% CO2)培养 72 h;将淋巴细胞悬液转移至2 mL EP 管中,2 200 rpm 离心20 min,收集上清,按照达科为产品Mouse IFN-γ、IL-4 和IL-17A Precoated ELISA Kit 操作方法进行检测。
1.3.5 免疫接种小鼠攻毒
将菌株E.coli 2002-1 划线接种于LB 固体培养板中,37 ℃培养箱培养12 h 后,挑取单菌落接种于3 mL LB 液体培养基中,37 ℃,180 rpm 震荡培养 12 h,再以1∶100 的比例转接于200 mL LB 液体培养基中,37 ℃,180 rpm 震荡培养 5 h 后,8 000 rpm 离心10 min 收集菌体,以适量无菌PBS 重复洗涤菌体3 次,倍比稀释后涂板计数;在加强免疫接种后14 d,每组取3 只分别以3.6×108CFU·只-1剂量进行腹腔攻毒,攻毒后48 h 处死小鼠,分别取肝、脾、肺、肾4个器官研磨于 2 mL PBS 中,混匀后按 1∶10、1∶100 比例稀释,将研磨器官原液及各梯度稀释液分别取20 μL涂布于LB 固体培养板中,置于37 ℃培养箱中培养12 h。通过平板菌落数量计算肝、脾、肺、肾细菌定植数;每组取10 只分别以5×108CFU·只-1剂量进行腹腔攻毒,攻毒后7 d 内,每天观察并记录小鼠的生存情况。
1.3.6 统计学分析
所有的数据进行生物统计学分析,采用SPSS 软件进单因素方差分析,组间差异采用t 检验,其中*表示P<0.05,** 表示 P<0.01,***P<0.001,有统计学意义。
2 结果与分析
2.1 重组蛋白OmpA 的表达与纯化
重组菌株 OmpA-pET32a/BL21(DE3)经 IPTG 诱导4 h 后进行SDS-PAGE 分析。结果,经IPTG 诱导菌在56 KD 处可见明显条带,其分子量大小与预期相符。经β-环糊精复性纯化蛋白、吐温-20 复性纯化蛋白和表达后直接纯化的包涵体蛋白进行SDSPAGE 分析,结果在分子量56 KD 处呈现单一条带。SDS-PAGE 图中可知,经β-环糊精复性纯化蛋白及直接纯化的包涵体蛋白纯度较高,SDS-PAGE 图中无杂蛋白条带,而经吐温-20 复性纯化蛋白SDSPage 中可见一条清晰杂带。纯度结果详见图1。
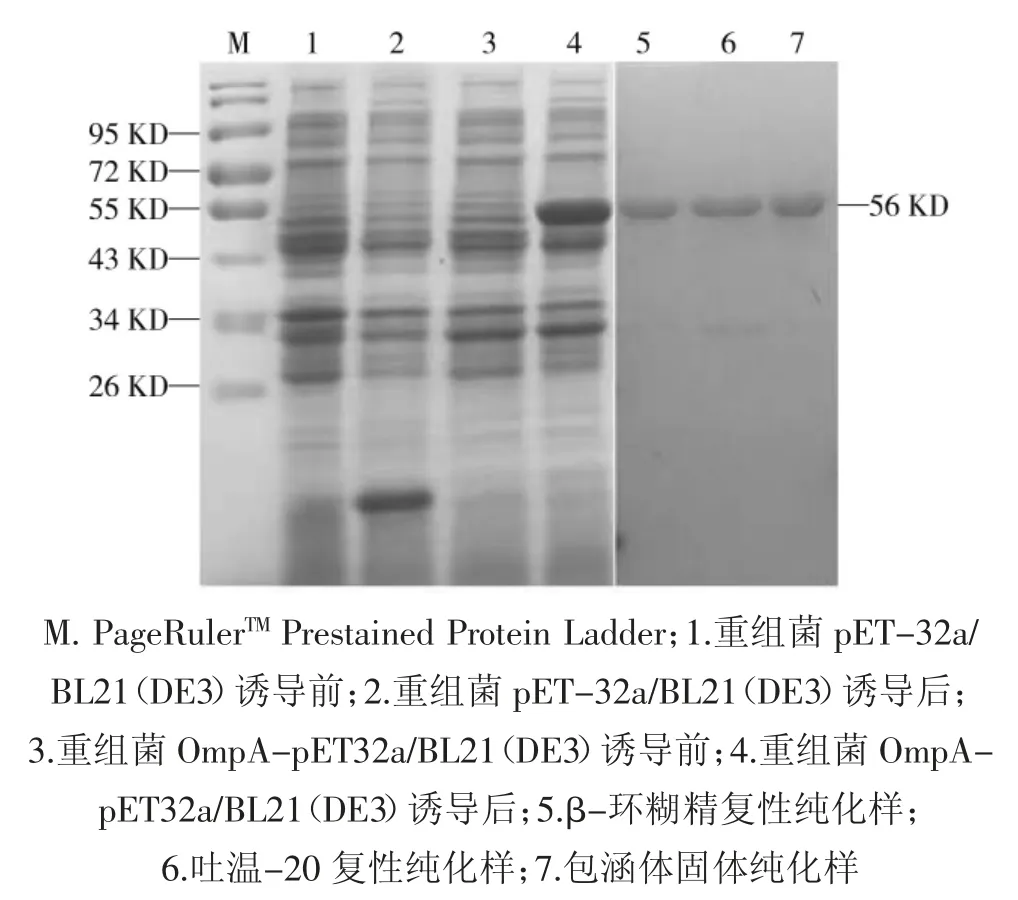
图1 SDS-PAGE 鉴定蛋白表达及纯化结果Fig.1 Expression and purification of recombinant OmpA.Lane M.PageRulerTM Prestained Protein Ladder
2.2 免疫小鼠血清特异性抗体检测结果
采用间接ELISA 方法测定各组在加强免疫后14 d小鼠血清中的抗体水平。结果显示,rOmpA 和E.coli 2002-1 全菌作抗原进行检测,β-rOmpA、T-rOmpA 和I-rOmpA 免疫组均能诱导机体产生体液免疫应答,三组抗体水平极显著高于PBS 对照组(P<0.001),且β-rOmpA 免疫组抗体水平显著高于T-rOmpA 免疫组(P<0.05)、极显著高于 I-rOmpA 免疫组(P<0.001)。结果详见图 2。

图2 免疫小鼠血清中的特异性抗体水平Fig.2 Levels of specific antibody in the immunized mice sera
2.3 免疫小鼠脾淋巴细胞产生细胞因子检测结果
取各组免疫接种小鼠脾脏脾淋巴细胞,体外经rOmpA 和E.coli 2002-1 全菌体刺激后用间接ELISA方法检测脾淋巴细胞分泌的特异性细胞因子IFN-γ、IL-17A 和IL-4。结果,各抗原免疫组小鼠脾细胞均能产生较高水平的IFN-γ,显著高于对照组(P<0.05),但产生 IL-4 水平均较低;rOmpA 刺激试验中 β-rOmpA 免疫组产生 IFN-γ、IL-17A 水平显著高于 T-rOmpA 免疫组(P<0.05),极显著高于 I-rOmpA免疫组(P<0.01)。结果详见图 3A;E.coli 2002-1 全菌体刺激试验中I-rOmpA 免疫组产生IFN-γ 水平显著高于 β-rOmpA 和 T-rOmpA 免疫组,β-rOmpA和T-rOmpA 免疫组产生IFN-γ 水平无显著差异(P>0.05),三组产生 IL-17A 水平无显著差异(P>0.05)。结果详见图3B。

图3 刺激后淋巴细胞上清中细胞因子水平Fig.3 Cytokine level in supernatant of lymphocyte culture after stimulating
2.4 免疫接种小鼠对E.coli 2002-1 菌株攻击的免疫保护作用
为比较各种抗原免疫接种后诱导的免疫保护作用,用E.coli 2002-1 菌株分别以3.6×108CFU·只-1和5.0 ×108CFU·只-1剂量对各组小鼠进行腹腔攻毒,然后测定小鼠肝、脾、肺、肾细菌定植数和小鼠免疫保护率。结果显示,以3.6 ×108CFU·只-1剂量攻毒后,小鼠肝、脾、肺和肾均有细菌定植,各抗原免疫组器官细菌定植数目均低于PBS 对照组,其中β-rOmpA免疫组肝、脾、肺、肾细菌定植量极显著低于T-rOmpA 免疫组和 I-rOmpA 免疫组(P<0.001),结果详见图4A。
对各免疫组小鼠以5.0 ×108CFU·只-1剂量攻毒后,观察记录小鼠死亡情况。结果,在攻毒后2 d,PBS对照组小鼠全部死亡,而此时β-rOmpA 免疫组小鼠存活率为60%,T-rOmpA 免疫组小鼠存活率为40%,I-rOmpA 免疫组小鼠存活率率为30%;而攻毒后3 d至 7 d,β-rOmpA 免疫组小鼠存活率为 40%,T-rOmpA 免疫组小鼠存活率为0,而I-rOmpA 免疫组小鼠存活率仍为30%。免疫保护作用结果表明,β-环糊精复性纯化的蛋白免疫原性优于吐温-20 复性纯化的蛋白和直接纯化的包涵体蛋白,诱导机体产生免疫应答和免疫保护作用最强。结果详见图4B。

图4 免疫小鼠对E.coli 2002-1 菌株攻击的免疫保护作用结果Fig.4 Immunoprotection of the immunized-mice against challenge with E.coli 2002-1 strain.
3 讨论
基因重组蛋白特别是重组膜蛋白在原核细胞中诱导表达,往往形成高密度、无活性、不可溶的包涵体形式蛋白。这种表达方式的优点[13]是表达量高,方便后续对其进行分离纯化;缺点是包涵体形式蛋白必须先变性再复性,才能恢复其生物活性。1961 年,Anfinsen[14]发现,蛋白质一级结构含有其折叠成熟所需的全部信息,无活性的包涵体形式蛋白质在一定的条件下可以完全自发地恢复活性。后来实验研究表明[15-16],伸展的肽链折叠成活性蛋白质并不是一步完成的,它先经过折叠进入中间态,然后由中间态过渡到最终具有特定三维结构和生物活性的自然状态。从中间态到天然构象折叠是复性的限速步骤。由于蛋白在折叠过程中会产生一些错误折叠的中间体,而且缺乏协助折叠的辅助蛋白,同时受到聚集反应的竞争,体外折叠形成蛋白质天然构象所需时间很长,从十几小时到几十小时不等。并非所有蛋白质在一定的条件下均可自发恢复具有完全活性的天然构象,包涵体复性成有活性的蛋白的过程非常复杂,且不同蛋白需要不同的复性方法。田亮等[17]研究牦牛源多杀性巴氏杆菌重组外膜蛋白H(rOmpH)亚单位疫苗对免疫接种小鼠诱导的免疫保护效果,结果rOmpH 包涵体蛋白经体外变性、复性及纯化后,不能产生良好的免疫原性。可见,即便是包涵体形式重组蛋白得到了复性,其免疫原性也受到了很大的影响,对复性的抗原蛋白的免疫原性仍需要实验证明。因此,实验前期对表达的主要以包涵体形式存在的rOmpA 以不同方法复性纯化后,进一步研究了它们的免疫原性,为后续将rOmpA 作为免疫原开发应用做前期准备。
研究分别将β-环糊精和吐温-20 复性纯化后的rOmpA 和包涵体形式的rOmpA 制备免疫原后免疫接种小鼠,然后检测和比较各组的血清抗体水平、脾淋巴细胞产生细胞因子水平以及细菌攻击后的肝、脾、肺、肾细菌定殖量、免疫小鼠存活数。结果显示,β-rOmpA 诱导的免疫应答和免疫保护作用明显好于T-rOmpA 和 I-rOmpA,且 β-rOmpA 免疫组小鼠所获得免疫保护率也最好,与乎锐等[11]研究的可溶性rOmpA 的免疫保护率结果一致。表明,利用β-环糊精复性后纯化的rOmpA 具有良好的免疫原性,可用于后续疫苗开发。
在检测血清抗体水平时,考虑到临床上E.coli 感染的实际情况,我们尝试了用灭活的E.coli 全菌体作为抗原对小鼠血清中抗体进行检测,所检测的血清抗体水平虽然明显低于rOmpA 作抗原的检测水平,但两种抗原各组之间抗体水平的变化趋势一致,说明rOmpA 和E.coli 全菌体均可作为抗原对免疫小鼠血清抗体进行检测。在体外脾淋巴细胞分泌细胞因子检测时,我们也尝试了用灭活的E.coli 全菌体作抗原进行刺激,各组均产生了比较高水平的IFN-γ 和一定水平的IL-17A,而IL-4 水平非常低。但与rOmpA 作为抗原相比,各组之间IFN-γ 的水平差异比较大,且不具有其他结果那样规律性。可能是由于全菌体抗原成分复杂,包括各种菌体表面蛋白、LPS、荚膜等成分,而且实验使用的是脾细胞,而非单一的淋巴细胞成分,这些因素可能都会影响到细胞因子表达谱及表达水平,致使这一结果不具有特异性[18-20]。各组产生IL-17A、IL-4 水平较低,说明在抗感染过程中,发挥较大作用的是Th1 细胞,而Th17 细胞和Th2 细胞发挥抗感染作用较弱。对免疫小鼠以E.coli 2002-1 菌株腹腔攻毒后,测定小鼠肝、脾、肺、肾细菌定植数和小鼠的存活率,β-rOmpA 免疫组小鼠肝、脾、肺、肾细菌定植量极显著低于T-rOmpA 和I-rOmpA 免疫组,而小鼠存活率也是β-rOmpA 免疫组最高,说明用β-环糊精方法复性纯化的rOmpA 诱导小鼠产生的抗E.coli 感染免疫保护作用最好。但实验是以小鼠作为动物实验模型开展的研究,可能与奶牛体内实验结果不一定完全一致,特别是对E.coli 和其它肠杆菌奶牛乳腺感染的免疫预防作用尚需进一步研究。

