轮状病毒SA11 株NSP2 蛋白的原核表达及其多克隆抗体的制备
陈肖宏,闻晓波,冉旭华
(黑龙江八一农垦大学动物科技学院,大庆 163319)
轮状病毒(Rotavirus,RV)是一种引起婴幼儿及多种幼龄动物肠道感染的病原,致死率高,给人类健康和畜牧业发展造成巨大危害[1]。RV 属于呼肠孤病毒科(Reoviridae)轮状病毒属成员,电镜观察下为一个无包膜的二十面体“车轮状”颗粒,基因组由11 个分节段的双链RNA(dsRNA)组成,共编码6 个结构蛋白(VP1~VP4,VP6 和 VP7)、5 或 6 个非结构蛋白(NSP1~NSP5 和/或 NSP6)[2]。具有感染性的完整 RV粒子为三层衣壳结构(triple-layered particle,TLP),最内层衣壳由VP2 蛋白及少量VP1 和VP3 构成,中间层由VP6 构成,最内层和中间层构成具有转录活性的双层衣壳结构(double-layered particle,DLP),DLP 外包裹纤突蛋白VP4 和糖蛋白VP7 构成了完整的具有感染性的RV 粒子。依据血清学分类方法,目前所鉴定出的RV 毒株可分为RVA~RVJ 至少10个群[3],其中A 群是引起婴幼儿和幼龄动物发生严重腹泻和脱水的主要病原。血清型由外衣壳蛋白VP7和 VP4 决定,RV 根据其 VP7 和 VP4 的抗原性分为G 血清型(glycoprotein)和 P 血清型(protease-sensitive)[4]。迄今为止,已鉴定出 32 种 G 型和 47 种 P 型可感染人类和动物[5]。
RV 经胞吞作用入侵细胞,在感染期间,病毒基因组复制和初生DLP 组装均发生在细胞质内的病毒质样结构(viroplasm-like structure,VLS)中。有研究表明,在缺乏所有其他病毒蛋白的细胞中,NSP2 与NSP5 的共表达可形成 VLS[6],但 NSP2 或 NSP5 的单独表达都不足以形成VLS,因此,NSP2 和NSP5 被认为是VLS 形成的最小组合。NSP2 蛋白在VLS 形成中起关键作用,在RV 感染的细胞中,使用RNAi 干扰技术或胞内抗体沉默NSP2 或NSP5 的表达可抑制VLS 形成[7-9]。现已证明NSP2 和NSP5 的相互作用对VLS 成核和病毒复制都是至关重要的[10],但关于这两种蛋白如何启动病毒质组装以及NSP2 在病毒质形成中的具体作用,目前尚不清楚。NSP2 蛋白由RV 基因组中第 8 基因片段编码,A 群 NSP2 蛋白全长1 059 bp,共编码317 个氨基酸,是一个相对分子量约为35 kDa 的碱性蛋白。从RV 感染细胞中分离出的具有复制活性的复制中间体,在非许可温度下利用 SA11 tsE(1400)突变体沉默 NSP2,双链 RNA 合成几乎完全缺失[11]。X 射线晶体分析表明,NSP2 蛋白常以八聚体形式存在,其总体结构是高度保守的[12]。NSP2 蛋白具有多种酶活性,在基因组复制过程中起关键作用。NSP2 蛋白可与单链RNA(ssRNA)非特异性结合且具有ATP 解螺旋活性[13],NSP2 蛋白还具有Mg2+依赖的核苷三磷酸酶(NTPase)活性和核苷二磷酸(NDP)激酶活性[14]。除了它的酶功能外,NSP2 还可与多种蛋白相互作用,例如NSP5、VP1 和微管蛋白[15]。
NSP2 蛋白在轮状病毒RNA 的复制、基因组的包装及双层衣壳结构装配的初始阶段发挥重要作用[16],近年来,对于NSP2 蛋白的研究主要集中于蛋白表达、结构与功能及其免疫学等方面的研究[17],但其在VLS 形成中的具体作用及其关键结构域对病毒质形成的影响目前尚不清楚。利用Kanai 等[18]开发的14质粒的RV 反向遗传操作系统,通过替换或缺失NSP2 蛋白关键位点或关键结构域,来研究其对病毒质形成的影响,抑制RV 复制,可为RV 致弱提供突变位点,为弱毒疫苗研发提供新方法。研究通过原核表达系统表达NSP2 蛋白,经免疫豚鼠制备NSP2 多克隆抗体,为进一步研究NSP2 蛋白结构和功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
E.coli BL21(DE3)、E.coli DH5α 和 pET-28a(+)载体均由实验室保存。pT7-NSP2 质粒购自Addgene公司。
1.1.2 实验动物
两只8 周龄清洁级体重约200 g 的雌性豚鼠购于哈尔滨动物实验基地,饲养于黑龙江八一农垦大学动物科技学院动物房。
1.1.3 主要试剂
质粒小提、胶回收试剂盒购自OMEGA 公司;限制性内切酶BamH I、HindIII、连接试剂盒购自Takara公司;Go Taq Green®Master Mix、预染彩虹蛋白Marker 购自Promega 公司;小鼠抗His Taq 抗体、辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG 购自北京博奥森有限公司;DNA 分子量标准购自天根生物科技有限公司;3,3-二氨基苯胺四氢盐酸(DAB)底物显色试剂盒购自北京中杉金桥生物技术有限公司;Micro BCATMProtein Assay Kit 购自 Thermo 公司;辣根过氧化物酶(HRP)标记的山羊抗豚鼠IgG 购自KPL 公司;TMB 显色液购自北京Solarbio 公司。
1.2 方法
1.2.1 pET-28a-NSP2 重组质粒的构建
参照NCBI GenBank 收录的轮状病毒SA11 株NSP2(GenBank 登录号:LC178571.1)基因组序列及pET-28a(+)载体图谱,设计特异性引物扩增SA11 株NSP2 编码区全序列,分别在上下游5′端添加BamH I和Hind III 酶切位点(下划线表示)。引物序列如下:SA11-NSP2-F:5′-CGCGGATCCATGGCTGAGCTAGCTTGCTTTTG-3′;SA11-NSP2-R:5′-CCCAAGCTTAAACGCCAACTTGAGAAACTTCGTC-3′,扩增片段大小为954 bp,引物委托北京华大基因公司合成。
以pT7-NSP2 质粒为模板,利用SA11-NSP2-F和SA11-NSP2-R 进行扩增,扩增条件:95 ℃预变性3 min;95 ℃变性 30 s,56 ℃退火 30 s,72 ℃延伸1 min,共 35 个循环;72 ℃终延伸 10 min;对 PCR 产物电泳后进行切胶回收。将回收的目的基因和原核表达载体 pET-28a(+)分别用 BamH I 和 Hind III 进行双酶切,酶切产物经电泳切胶回收后以T4 DNA Ligase 进行连接,连接产物转化至E.coli DH5α 感受态细胞中,37 ℃过夜培养。挑取阳性单克隆,摇菌提质粒后经PCR、双酶切鉴定,将鉴定正确的重组质粒送至北京华大科技有限公司测序,将测序正确的重组质粒命名为pET-28a-NSP2。
1.2.2 目的基因的诱导表达
将 pET-28a-NSP2 转化至 E.coli BL21(DE3)感受态细胞中,37 ℃过夜培养,挑取阳性单克隆接种至3 mL 含终浓度为 50 μg·mL-1卡那抗性的 LB 液体培养基中,37 ℃震荡培养,待菌液浑浊后以1∶100 的比例将菌液转接至终浓度为50 μg·mL-1卡那抗性LB液体培养基中,37 ℃,200 rpm 培养至 OD600≈0.6。取出1 mL 菌液作为未添加诱导剂的对照,剩余部分加入终浓度为1 mM 的IPTG 诱导剂。将添加和未添加诱导剂的菌液,37 ℃,200 rpm 继续培养4 h。取诱导培养物1 mL 离心弃上清,用PBS 洗涤菌体3 次后重悬于500 μL 的PBS 中,置于冰水浴中,超声破碎至液体清亮;4 ℃,12 000×g 离心 20 min,分别收集上清液和沉淀。加入5×Loading buffer,煮沸10 min,进行SDS-PAGE 分析检验。同时,将未加入诱导剂的空载体pET-28a(+)转化后的表达产物作为对照。
1.2.3 重组蛋白的Western blot 鉴定
取适量诱导样品及未诱导的空载体对照组样品经SDS-PAGE 分离后,从胶板上取下胶,切除多余部分,泡入转膜液中。同时剪下大小适中的一张PVDF膜和2 张厚滤纸,将PVDF 膜泡入预冷的甲醇中1 min 后与厚滤纸一同泡入转膜液中。按照滤纸、PVDF 膜、胶和滤纸的顺序依次放置于电转槽中央。半干法将蛋白转移至PVDF 膜上,转膜结束后将膜置于PBST 中漂洗3 次,然后浸润于5%脱脂乳中,4 ℃封闭过夜,洗膜后与1∶10 000 倍稀释的小鼠抗His Tag 抗体于37 ℃孵育1 h,再次洗膜后与1∶5 000倍稀释的辣根过氧化物酶标记的山羊抗小鼠IgG 抗体室温孵育2 h,再次洗膜,将配置好的DAB 显色液混合均匀后滴加在膜上,等待几分钟后,目的条带呈黄褐色,弃掉显色液,用去离子水终止反应。
1.2.4 重组蛋白的纯化及定量
诱导条件同上,离心收集诱导后菌体,重悬于PBS 中,置于冰水浴中超声破碎至菌液清亮,离心后收集沉淀,用4M 尿素重悬沉淀,冰浴20 min,离心后收集上清,4M 尿素重复洗脱蛋白3 次。将收集到的蛋白样品装入透析袋中过夜透析,以去除蛋白样品中的尿素,使蛋白复性。将复性后的蛋白稀释后用BCA 试剂盒对蛋白进行定量,通过绘制标准曲线确定蛋白的浓度。
1.2.5 抗体制备
用PBS 将复性后的蛋白样品稀释至400 μg·mL-1,分别取2 mL 稀释后的蛋白和2 mL ISA206 佐剂,将蛋白样品和佐剂放置于31 ℃水浴锅中温浴10 min。将装有佐剂的小瓶放置于磁力搅拌器上以适当转速搅拌,搅拌的同时快速加入蛋白样品,继续搅拌乳化10 min,乳化液保存于 4 ℃。取 1 mL 含有 200 μg 重组蛋白的乳化液注射于豚鼠后肢肌肉,2 周后以同样剂量加强免疫2 次,间隔2 周。在免疫前和免疫后2 周采血,4 ℃放置 2 h,5 000×g 离心 5 min 收集血清,通过间接ELISA 方法测定抗体效价,达到预期效价后,通过心脏采血收集血清,-20 ℃保存。
1.2.6 抗体效价的检测
采用间接ELISA 法,用碳酸盐缓冲液将重组NSP2 蛋白稀释至 5 μg·mL-1后包被 96 孔板,100 μL·孔-1,4 ℃包被过夜。取出包被好的酶标板,PBST 洗涤3 次,甩干孔内液体,加入5%脱脂乳,300 μL·孔-1,37 ℃封闭 2 h。PBST 洗涤 3 次,将多克隆抗体倍比稀释后加入孔中,每个梯度做2 个重复,同时设置阴性对照和空白对照,100 μL·孔-1,37 ℃孵育 1 h。PBST 洗涤 3 次,加入 1∶5 000 倍稀释的辣根过氧化物酶标记的山羊抗豚鼠IgG,100 μL·孔-1,37 ℃孵育1 h。PBST 洗涤3 次,加入TMB 显色液,50 μL·孔-1,37 ℃避光孵育 15 min。加入 2M H2SO4终止显色,50 μL·孔-1,在酶标仪上读取 OD450nm的数值,计算P/N 的值,P/N≥2.1 即为阳性阈值。
2 结果
2.1 pET-28a-NSP2 重组质粒的鉴定
重组质粒 pET-28a-NSP2 经 PCR 和 BamH I 与Hind III 双酶切后,进行1%琼脂糖凝胶电泳可见954 bp 的目的条带及约5.3 kb 的载体条带,见图1。将鉴定正确的菌液送至北京华大基因公司测序,测序结果与目的片段序列一致。
2.2 重组蛋白SDS-PAGE 鉴定
将鉴定正确的重组质粒pET-28a-NSP2 和空载体 pET-28a(+)转化入大肠埃希菌感受态 BL-21(DE3)中,经诱导表达,破碎后分别收集上清和沉淀,进行SDS-PAGE 验证,可见相对分子质量约为35 kDa 的NSP2 特异性条带,且以包涵体形式大量表达,见图2。

图1 重组质粒PCR、双酶切鉴定Fig.1 PCR and restriction enzyme analysis of recombinant plasmid pET-28a-NSP2
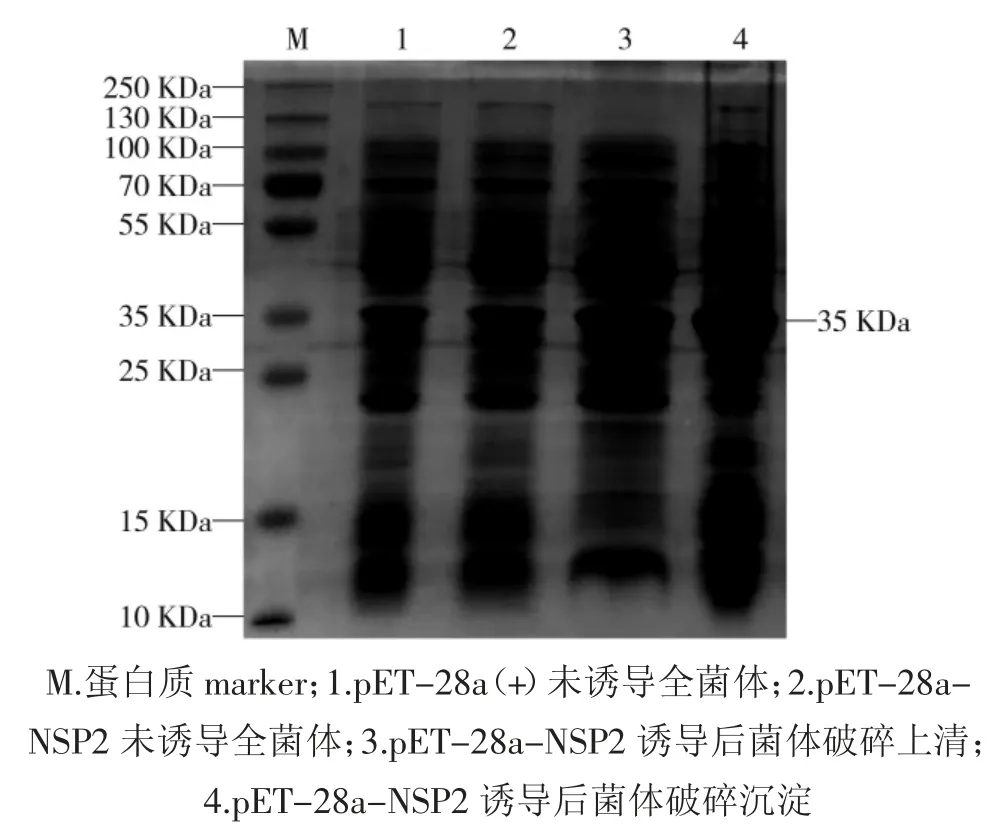
图2 重组蛋白pET-28a-NSP2 的SDS-PAGE 分析Fig.2 The Glycine-SDS-PAGE analysis of recombinant protein pET-28a-NSP2
2.3 重组蛋白Western blotting 验证
检测结果表明包涵体形式的重组蛋白能与抗His 标签的单抗发生特异性反应,在相对分子量约35 kDa 处可见特异性黄褐色条带,见图3,进一步证明NSP2 重组蛋白可在E.coli BL-21(DE3)感受态内大量表达。
2.4 纯化后重组蛋白的SDS-PAGE 鉴定
纯化的重组蛋白经12% SDS-PAGE 分析,纯化后的蛋白条带大小与重组蛋白鉴定结果一致,可见相对分子质量约35 kDa 的目的条带,见图4,并用Micro BCATMProtein Assay Kit 测定蛋白浓度,重组蛋白浓度约 2.09 mg·mL-1。

图3 Western blotting 鉴定NSP2 重组蛋白的表达Fig.3 Western blotting analysis of recombination protein NSP2
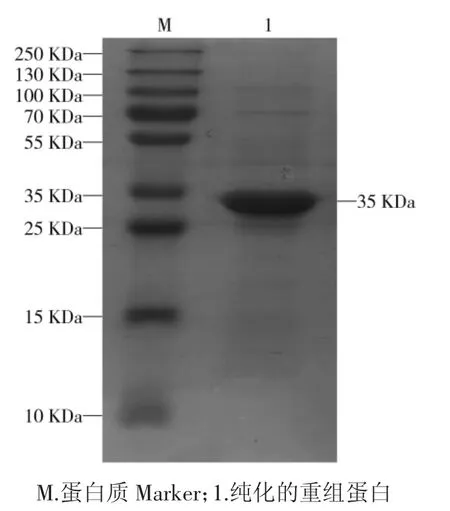
图4 SDS-PAGE 鉴定纯化的NSP2 重组蛋白的表达Fig.4 SDS-PAGE analysis of purified recombinant protein NSP2
2.5 多克隆抗体效价
采用间接ELISA 法检测表明,豚鼠血清中NSP2蛋白的多克隆抗体效价大于1∶5 000。
3 讨论
在全球范围内,轮状病毒几乎感染每一个5 岁以下儿童,每年造成的死亡人数超过20 万[1],但目前尚未开发出针对RV 的特异性药物,接种疫苗是世界公认的预防RV 性肠胃炎暴发的最有效手段。尽管现有的商品化减毒活疫苗在发达国家对预防RV 性肠胃炎非常有效,但仍存在散毒风险及潜在安全性等问题,畜牧业目前尚无商品化RV 疫苗,也无特异性治疗药物,临床上也只是对症治疗。以猪轮状病毒(Porcine rotavirus,PoRV)为例,猪轮状病毒是导致世界范围内仔猪腹泻的主要原因之一,该病潜伏期短,传染性强,多呈地方性流行,主要感染7 日龄仔猪,发病仔猪以腹泻、呕吐和脱水为特征,病死率高达80%~100%,成年猪多数呈隐性感染,一般表现为消瘦、食欲不振和发育停滞等特点,严重损害养猪业的经济效益,阻碍养猪业的健康发展[19-20]。目前国内猪轮状病毒感染率逐年递增,一旦暴发,很难净化,各种疫苗免疫也不能完全预防感染,因轮状病毒基因组的特殊性,常发生重配、重排,大大增加了防控此病和开发疫苗的难度。对于新生儿、免疫缺陷患者、前往高危地区旅行的成年人、以及畜牧业来说开发广谱抗RV 的药物和疫苗都是迫切的。RV 初次感染婴幼儿后,可在其体内检测到抗NSP2 蛋白的特异性血清IgG 和IgA,其抗体水平可维持100~150 d,当再次感染RV 时,其抗体水平可维持150 d[21]。另外,在初次感染后,在十二指肠液和粪便提取物中均可检测到抗NSP2 蛋白的IgA。血清中抗NSP2 的抗体水平可能是RV 感染和再感染的敏感指标。抗NSP2 的抗体在再次感染后限制病毒复制的潜力值得进一步研究[21]。有研究表明即使在相距较远的RV 血清群之间,NSP2 蛋白总体结构也是高度保守的[22]。2009 年范耀春[23]将 RV A 群 TB-Chen 株 NSP2 蛋白(Gen-Bank:AY787648)克隆至 pETL 载体中,表达并纯化了NSP2 蛋白,免疫豚鼠制备了抗重组NSP2 蛋白的血清抗体,经Western Blot 检测,结果表明血清抗体可特异性识别重组NSP2 自身蛋白,也可交叉识别SA11 株和Wa 株感染MA104 细胞中的NSP2 蛋白,在间接免疫荧光实验中进一步证明了这一结果,表达的TB-Chen 株NSP2 具有良好的免疫原性。现有研究已证明重组NSP2 蛋白免疫兔子、豚鼠及小鼠均可获得抗 NSP2 的高免血清[6,17,24-25]。将 NSP2 蛋白作为开发新型疫苗和药物的靶蛋白,以期降低RV 感染对人类和畜牧业的危害。
重组NSP2 蛋白诱导表达时可见特异性蛋白条带以包涵体形式大量表达,分子大小约35 kDa,NSP2蛋白以单体形式表达。但上清以及pET-28a(+)空载体中均存在与特异性蛋白条带大小相似的条带,经Western blotting 对其进一步验证,结果表明NSP2 蛋白以包涵体形式大量表达,其余相似蛋白可能为大肠埃希菌BL21(DE3)感受态自身蛋白。重组蛋白大量表达后收集菌体,超声破碎收集沉淀,首先采用Ni-NTA 纯化系统对重组蛋白进行纯化,发现重组蛋白未能和填料良好的结合,过早出现在前期的洗脱液中,可能是蛋白本身标签暴露不充分等因素导致与填料作用力弱,具体原因丞待研究。在后续试验中将超声破碎后的沉淀依次用 1、2、4、6、8 M 尿素重悬以洗脱蛋白,冰浴20 min 离心后收集上清,取适量上清 SDS-PAGE 检测,结果表明 1、2 M 和 4 M 尿素溶液中均含有大量重组蛋白,6M 和8M 尿素溶液中重组蛋白量较少,4 M 尿素可较好洗脱蛋白。纯化后总蛋白浓度可达2 mg·mL-1,重组蛋白含量占总蛋白的95%以上,结果表明未经Ni-NTA 纯化系统单纯用尿素洗脱的方法也可获得纯化效果较好的重组蛋白,利用4 M 尿素溶液纯化蛋白不仅降低了试验成本,也减少了试验的复杂程度。RV 可感染婴幼儿及许多哺乳动物和鸟类,其中包括试验常用的家兔和小鼠,感染后的动物体内可产生抗RV 的抗体,可能对后续试验产生影响,豚鼠不感染RV,可作为试验动物制备多克隆抗体。因豚鼠对弗氏佐剂较为敏感[26],免疫中易造成死亡,故而采用ISA206 佐剂,其乳化方法简单易操作且造价低廉。
研究成功构建了pET-28a-NSP2 重组表达质粒,并在大肠埃希菌BL21(DE3)中高效表达了全长NSP2 蛋白,纯化后的蛋白免疫豚鼠制备了多克隆抗体。利用抗NSP2 的高免血清通过间接免疫荧光试验可对RV 感染宿主细胞后不同时期NSP2 蛋白的表达及其分布进行检测。下一步将制备的抗NSP2 多克隆抗体作为一抗,进行间接免疫荧光与激光共聚焦试验,在感染RV 的宿主细胞内对NSP2 蛋白进行定位,进一步研究NSP2 蛋白影响病毒质形成的关键结构域、病毒自身复制和致病机制。轮状病毒侵入宿主细胞后的复制机制尚不明确,研究轮状病毒侵入宿主细胞后的复制机制可为轮状病毒新型药物和疫苗的研发提供借鉴。

