参松养心对代谢综合征大鼠心房颤动的影响及机制∗
章晶晶 帅维 孔彬 杨宏杰 黄鹤
代谢综合征(Met S)是一组复杂的代谢紊乱症候群,包括肥胖、高血糖、葡萄糖耐受不良、血脂异常和高血压。Met S是心房颤动(简称房颤)的一个重要危险因素,增加了房颤病人的发病率及死亡率。有研究表明,Met S可诱导心房重塑并增加房颤发生率[1-2]。
参松养心(SSYX)是一种传统的中草药,包括人参、麦冬、山茱萸、丹参、酸枣仁(炒)、桑寄生、赤芍、土鳖虫、甘松、黄连、南五味子、龙骨,在中国已被广泛地用于治疗心律失常,且有一定的疗效[3-5]。以前的研究表明SSYX 对动作电位时程(APD)及心房传导能力的影响是通过调节自主神经系统实现的[6],然而SSYX 对Met S房颤的影响及具体机制却并未完全阐明。
NOD 样受体热蛋白结构域3(NLRP3)炎性小体其由凋亡相关的斑点样蛋白组成,包含CARD(ASC)、caspase-1 和NLRP3。越来越多的证据表明,NLRP3炎性小体是炎症反应的重要介质[7]。已有研究表明抑制NLRP3-白介素(IL)-1β轴可以抑制交感神经活性[8]。笔者研究SSYX 对Met S大鼠房颤的影响,同时观察肿瘤坏死因子(TNF)、IL 炎症因子NLRP3炎性小体及交感神经活性的变化,旨在探索SSYX 对房颤影响的机制。
1 材料与方法
1.1 实验动物及分组 本研究所用动物由武汉大学动物实验伦理委员会审核并批准,符合《赫尔辛基宣言》的原则。健康雄性SD 大鼠40 只,购自武汉大学实验动物中心,随机分为4 组,入组时鼠龄、体重四组均无差异,分别为对照(CTL)组、SSYX 给 药(CTL+SSYX)组、Met S组、Met S +SSYX 组,每 组10 只。Met S 模 型 为高脂高糖饮食喂养16 周,而高脂高糖饲料包括炼乳(39.5%),牛脂(20%)和果糖(17.5%)以及饮用水中25%的果糖。Met S +SSYX 组大鼠喂养8周后同时给予SSYX 颗粒(0.4 g/kg)灌胃8周(将适量SSYX 颗粒溶于一定量的双蒸水中,每天用灌胃器取适量SSYX 溶液插入大鼠食道并将该溶液推注入大鼠胃中),SSYX(批号J111202)由以岭制药公司(中国石家庄)提供。饲养在室温18℃~28℃、相对湿度40%~70%的屏障系统内。所有大鼠喂养至16 周后,于上午9 点左右测量安静状态下的体重、心率、血压(收缩压、舒张压)、血糖情况并做好记录。
1.2 房颤诱发 各组喂养16周后,腹腔注射戊巴比妥钠60 mg/kg 麻醉大鼠,仰卧位固定。气管插管连接小动物呼吸机给予人工通气每分钟70 次。用碘酒在胸前消毒,于左侧胸骨第五肋间剪开皮肤,然后逐层钝性分离直至暴露心脏。成对的铂电极(直径:0.25 mm 米;间距:1 mm)放置在右房行程序性刺激;定制的Ag-Ag Cl电极(直径:0.25 mm;间距:0.5 mm)放置在左房,记录单相动作电位(MAP)。房颤的诱发:经5 min心脏恢复自发搏动消除心电记忆效应后,保持相同条件下,间断给予右心房Br ust刺激(电压为5 V、频率为50 Hz、持续时间为2 s的连续单向方波的猝发型串刺激),每次重复进行10次Br ust刺激,刺激之间窦性心律恢复时间>1 min。记录房颤持续时间,并计算房颤诱发率(Burst刺激诱发出房颤的动物数除以动物总数)。通过Labchart8.0软件分析房颤诱发相关数据。
1.3 酪氨酸羟化酶(T H)及生长相关蛋白-43(GAP43)检测 完成房颤诱发后,剪开大鼠胸骨,用弯剪从主动脉根部剪取心脏置于冰上并修剪过多残余组织,随后将左心耳从整颗心脏中分离下来。四组大鼠左心耳组织固定于4%多聚甲醛溶液48 h即可开始做石蜡包埋,从石蜡包埋的左心耳组织中切下四小块,切片用TH、GAP43 免疫荧光染色以标记交感神经。通过Image Pro Pl us软件分析免疫荧光相关数据。
1.4 T H、GAP43、TNF-α、IL-6、IL-1β、NLRP3、caspase-1的蛋白检测 大鼠左心耳组织用裂解液裂解,将心肌组织按照20 mg:150~250μl的比例加入裂解液。每个样本的总蛋白通过SDS-PAGE分离,然后转移到PVDF 膜上。将膜用5%脱脂奶粉在含有Tween 20(TBST)的Tris缓冲盐水中封闭1 h,并与含抗T H(T H;1∶1000;Abca m),GAP43(GAP43;1∶1000;Abcam),肿瘤坏死因子-α(TNF-α;1∶100;Abca m),白介素-6(IL-6;1∶100;LSbio),白介素-1β(IL-1β;1∶500;Abcam),NLRP3(1∶500;Abca m),半胱氨酸天冬氨酸酶-1(caspase-1;1∶1000;Abcam)的一抗在4°C 下孵育过夜。第2天,在TBST 中洗涤3次,然后与辣根过氧化物酶(HRP)偶联的山羊抗兔或抗大鼠二抗在37°C下孵育1 h。用化学发光检测法显影,各条带扫描后采用图像分析系统分析平均灰度值,目标蛋白以GAPDH 校正计算相对表达量。
1.5 统计学处理 采用GraphPad prism 8.0软件进行统计学分析及作图。连续变量采用均数士标准差(¯x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用t检验。以P<0.05为差异有显著性。
2 结果
2.1 四组基本情况比较 与CTL 组相比,Met S组的体重、心率、血压(收缩压、舒张压)、血糖水平均明显升高(P 均<0.05);Met S+SSYX 组的体重、心率、血压(收缩压、舒张压)、血糖水平均低于Met S组(P 均<0.05);CTL+SSYX 组与CTL 组比较,上述指标无差异(P 均>0.05),见表1。

表1 16周后四组大鼠的基本指标的测量
2.2 四组房颤诱发率的比较 CTL 组与CTL+SSYX 组的房颤诱发率均为0(0/10),Met S组的房颤诱发率为90%(9/10),Met S+SSYX 组的房颤诱发率为20%(2/10)。与CTL 组相比,Met S组的房颤诱发率明显增加(P<0.05);Met S+SSYX 组相对于Met S 组,房颤诱发率明显减少(P <0.05);CTL+SSYX 组与CTL 组,房颤诱发率无差异(P>0.05)。
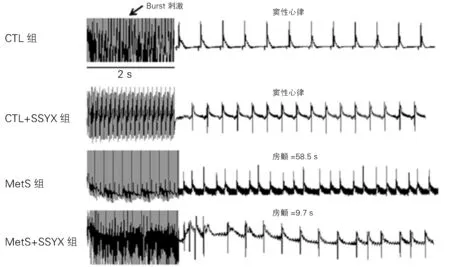
图1 四组Burst刺激诱发房颤情况
2.3 四组TH、GAP43 蛋白表达水平比较 与CTL组比较,Met S组T H 及GAP43染色阳性的密度明显升高(P 均<0.05);Met S+SSYX 组TH 及GAP43染色阳性的密度明显低于Met S组(P 均<0.05);与CTL 组 比 较,CTL+SSYX 组TH 及GAP43染色阳性的的密度无差异(P 均>0.05),见图2、3;与CTL 组比较,Met S组的T H、GAP43的蛋白表达水平明显升高(P 均<0.05);Met S+SSYX 组的TH、GAP43的蛋白表达水平明显低于Met S组(P 均<0.05);与CTL 组比较,CTL+SSYX 组T H、GAP43 的蛋白表达水平无差异(P均>0.05),见图4和表2。
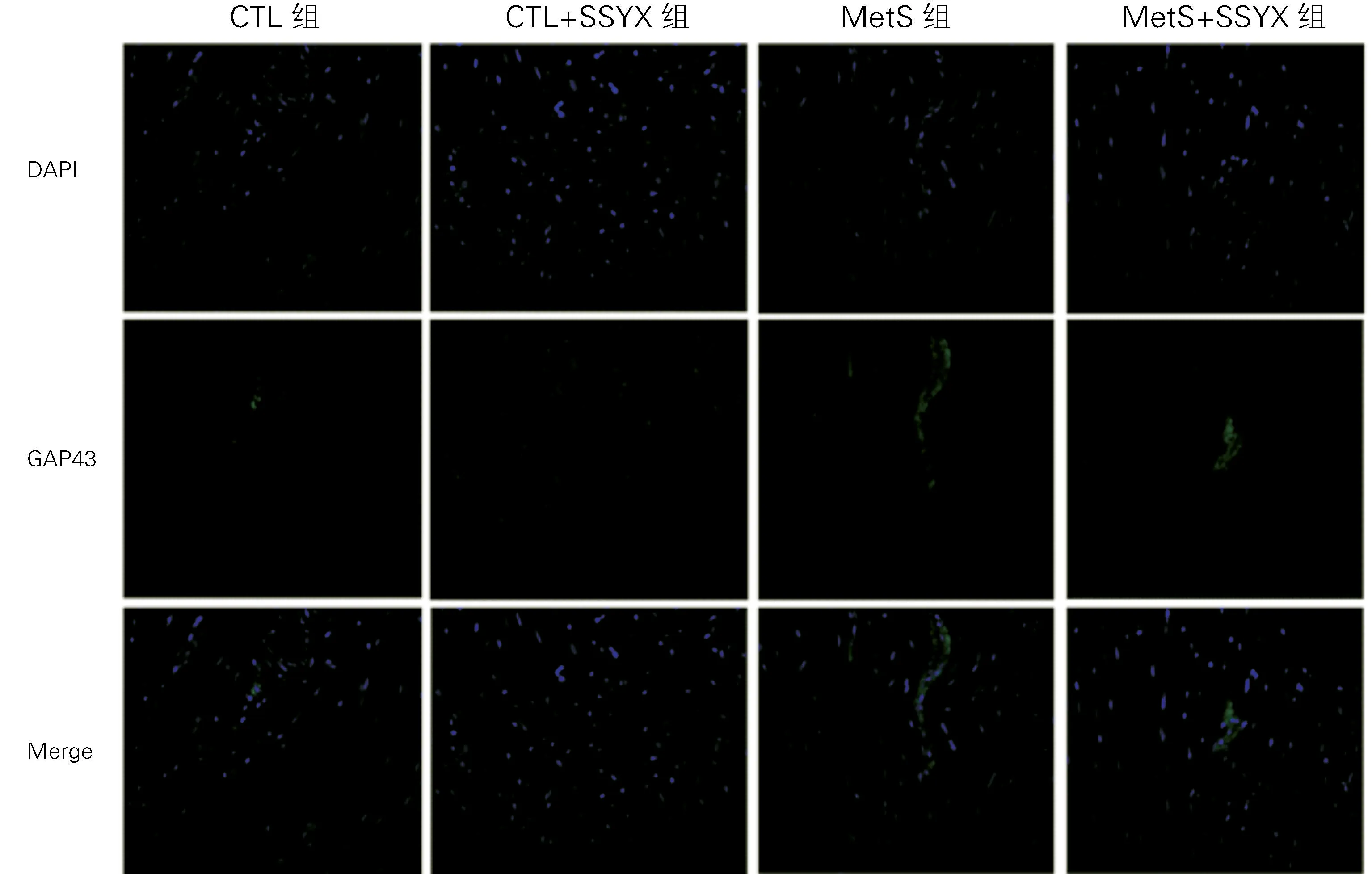
图2 四组心房组织T H 免疫荧光
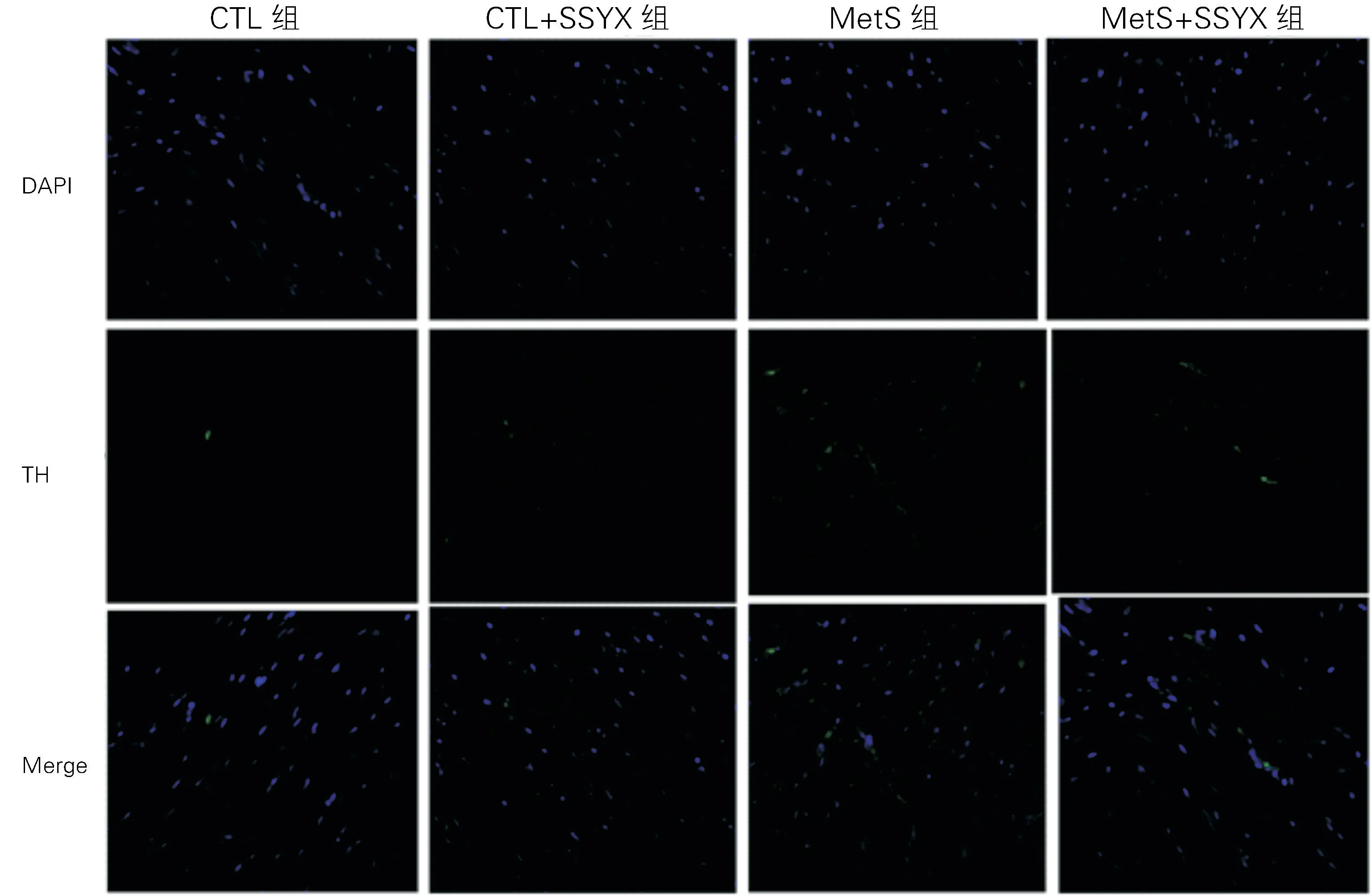
图3 四组心房组织GAP43免疫荧光
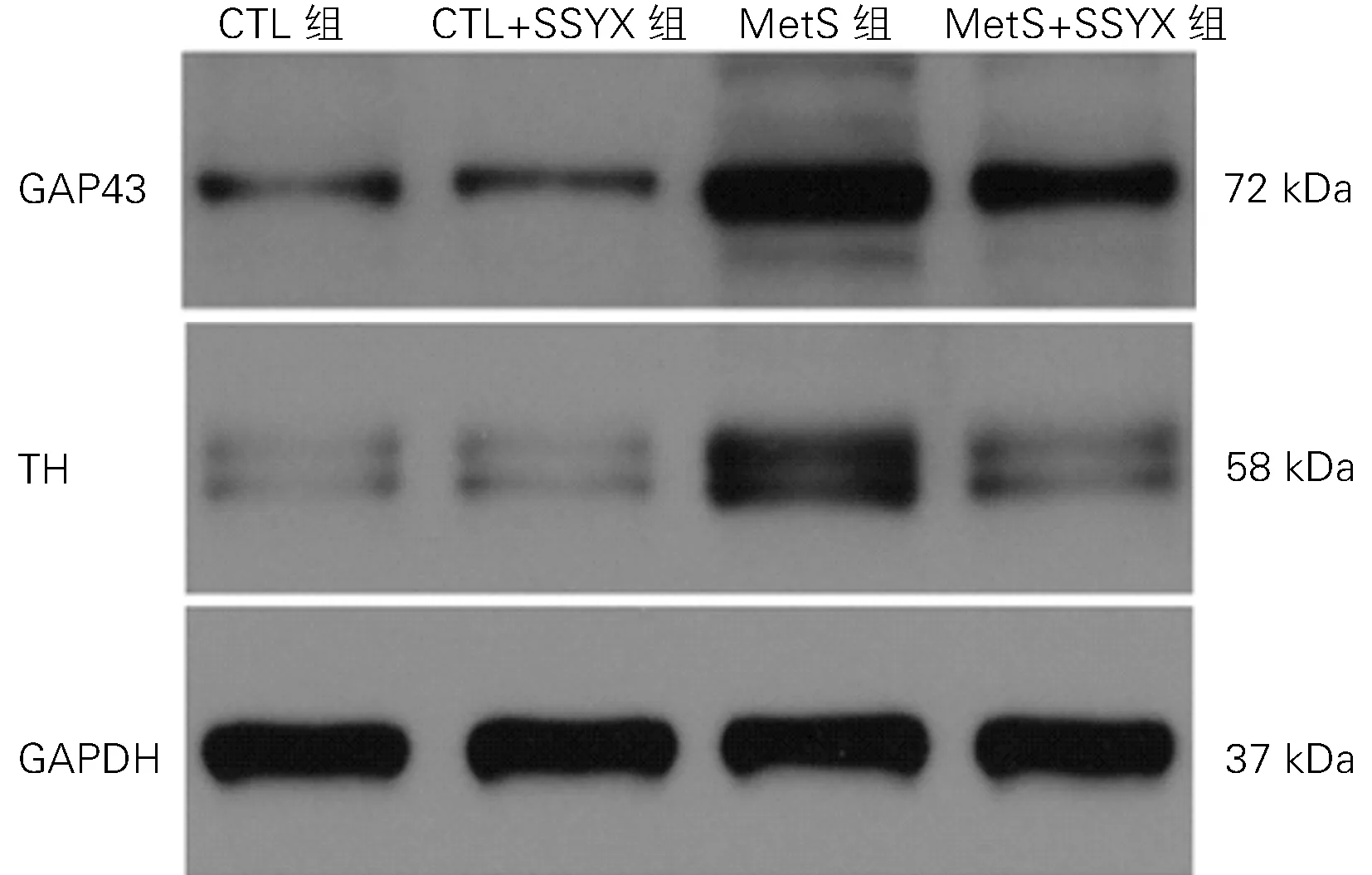
图4 四组心房组织T H 及GAP43蛋白的表达
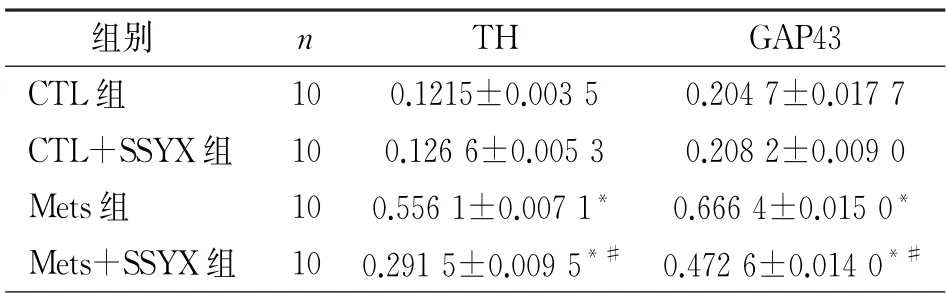
表2 心房组织中TH 及GAP43蛋白的相对表达量/GAPDH
2.4 四组TNF-α、IL-6、IL-1β蛋白表达水平比较 与CTL 组 比 较,Met S 组TNF-α、IL-6、IL-1β的 蛋白表达水平明显升高(P 均<0.05);与Met S组比较,Met S+SSYX 组TNF-α、IL-6、IL-1β的蛋白表达水平明显降低(P 均<0.05);与CTL 组比较,CTL+SSYX 组TNF-α、IL-6、IL-1β的蛋白表达水平无差异(P 均>0.05),见图5及表3。
2.5 四组NLRP3、caspase-1 及IL-1β蛋白表达水平的比较 与CTL 组比较,Met S 组NLRP3、caspase-1及IL-1β的蛋白表达水平升高(P 均<0.05);与Met S 组比较,Met S+SSYX 组NLRP3、caspase-1及IL-1β的蛋白表达水平降低(P 均<0.05);与CTL 组 比 较,CTL+SSYX 组NLRP3、caspase-1及IL-1β的蛋白表达水平无差异(P 均>0.05),见图6及表3。
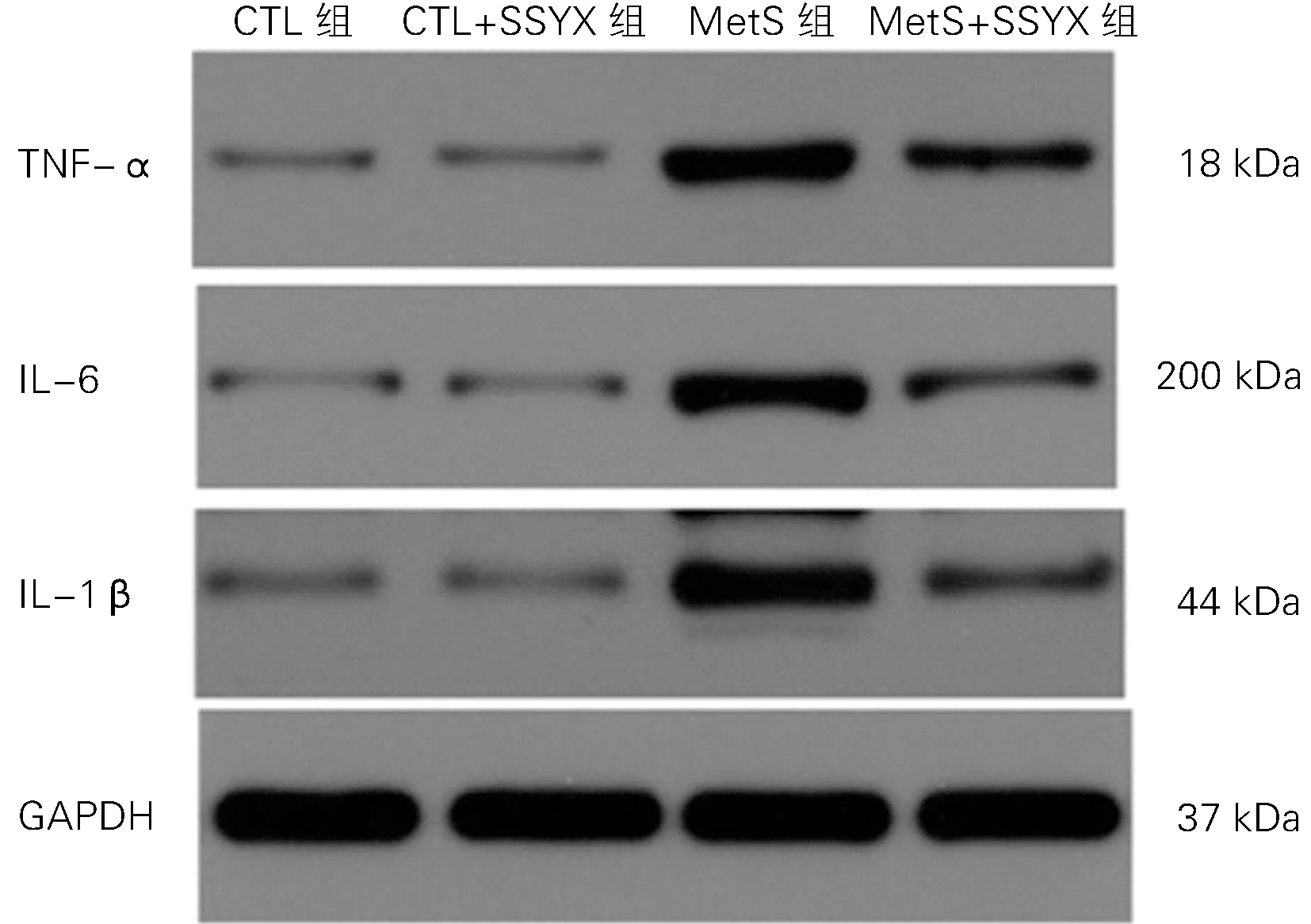
图5 四组心房组织TNF-α、IL-6、IL-1β蛋白的表达
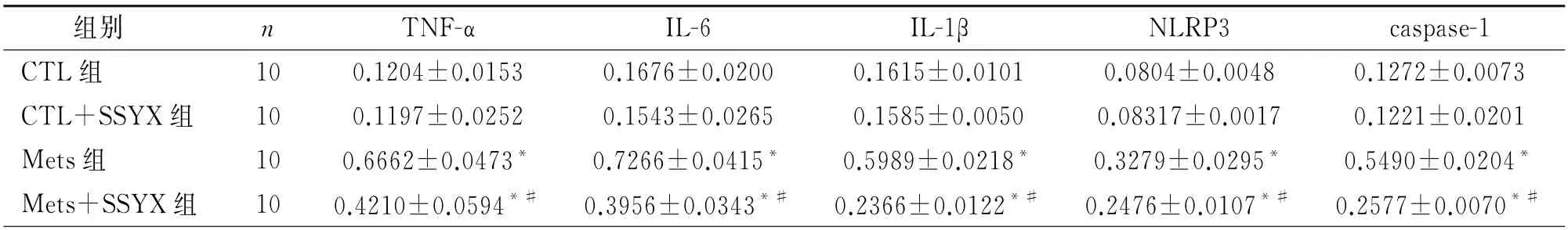
表3 心房组织中TNF-α、IL-6、IL-1β、NLRP3、caspase-1蛋白的相对表达量/GAPDH
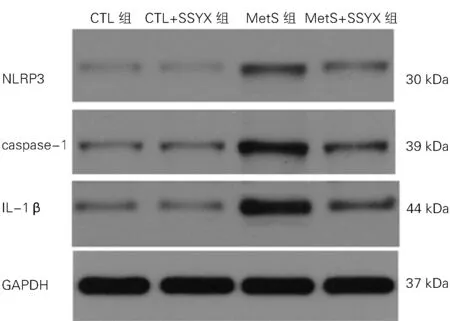
图6 四组心房组织中NLRP3、caspase-1、IL-1β蛋白的表达
3 讨论
本研究结果显示,给予高脂高糖饮食大鼠的体重、心率、血压(收缩压、舒张压)及血糖水平相对于正常饲养大鼠均明显增加(P 均<0.05),这一系列的代谢紊乱表明Met S大鼠模型成功建立。
既往的研究表明,交感神经活性增高可以促进心律失常的发展[9]。笔者研究发现Met S组心房组织T H、GAP43免疫荧光染色增强,TH、GAP43蛋白表达增加,说明其交感神经活性升高。与Met S组比较,Met S+SSYX 组心房组织T H、GAP43 免疫荧光染色减弱,T H、GAP43蛋白表达降低,说明其交感神经活性减弱。同时,许多研究表明炎症反应在房颤触发中起着重要作用。有临床研究指出,房颤病人相对于窦性心律者而言,其血液中的TNF-α水平明显升高[10]。人群中房颤易感性与血液中IL-6 水平呈正相关[11]。与这些研究一致,笔者发现相对于CTL组,Met S组TNF-α、IL-6、IL-1β的蛋白表达水平明显升高,其房颤易感性也明显升高,而SSYX 减弱了Met S诱导的TNF-α、IL-6、IL-1β这些促炎症因子的表达,并降低了房颤易感性。有研究指出,SSYX 通过抑制炎性因子的产生来增强副交感神经的活性从而来缓解房颤的进展[12]。另外,也有研究指出炎症反应可调节交感神经的活性,抑制炎症反应可减弱交感神经活性并降低心律失常的发生[8,13]。而NLRP3炎性小体的激活涉及到几种心血管相关的炎症反应[14],其与炎症通路NF-κB 信号通路也是相辅相成的[15]。最近,Yang等[16]证明保留射血分数心力衰竭小鼠的交感神经活性明显增强,NLRP3炎症小体活性增强,从而导致心律失常风险显著增加。同时,也有研究表明NLRP3-IL-1β轴可促进交感高活性[8]。笔者的研究表明Met S 组NLRP3-IL-1β轴的蛋白表达水平与T H、GAP43的蛋白表达水平、心房炎症情况趋势一致,均明显升高,而SSYX 降低了Met S诱导的这些效应。故笔者推测Met S大鼠的NLRP3炎性小体被激活,从而导致心房交感神经活性及心房炎症增高。而SSYX 可能通过抑制NLRP3炎症小体活性从而抑制交感神经活性以及心房炎症降低Met S房颤。

