牛血清白蛋白水热法一步合成氮掺杂碳点荧光检测2,4,6-三硝基甲苯
刘翠娥, 黄加玲, 王婷婷, 王小琴, 刘凤娇, 李顺兴
(闽南师范大学化学化工与环境学院,现代分离分析科学与技术福建省重点实验室,福建漳州 363000)
碳点(Carbon Dots,CDs)因其具有可调谐的光致发光特性,优异的理化性能,光稳定性好,以及低毒性、生物相容性和生物降解性等[1-7]优点,成为荧光传感器的研究热点。CDs发光特性与其表面结构有关,因此探讨不同来源、不同表面功能团CDs对荧光检测性能影响机制倍受关注。2,4,6-三硝基甲苯(2,4,6-Trinitrotoluene,TNT)是人工合成的爆炸能力强、性质稳定、通用烈性炸药。TNT可通过皮肤、肺和眼睛被人体吸收[8],从而损伤肝脏、造血系统和皮肤,并可能引起血红蛋白变性[9]。TNT及其降解产物可对水生生物和群落产生不利影响[10-12]。TNT的使用带来严重的人身安全和环境污染隐患,因此对其快速、准确、高效检测技术的需求日益增长[13]。
近年来,已经开发出基于X射线扩散、中子分析、拉曼光谱[14]和电化学传感[15,16]等方法。与其他技术相比,荧光法在痕量TNT检测中具有操作简单、低成本、便携性、高灵敏度和选择性好等优点[17]。基于NH2-CDs“功能单体”,乙二胺功能化CDs[18,19]已成功应用于TNT的选择性检测,但后修饰添加氨基活性位点法所需合成和纯化过程复杂。因此,以含氮物质为前驱体,一步合成氮掺杂CDs(Nitrogen-doped CDs,N-CDs)更便捷且环境友好。Zhang等[20]通过一步微波辅助热解乙二胺和柠檬酸,成功合成了N-CDs,在强的TNT-NH2相互作用下建立了荧光传感平台,对TNT检测的线性范围为1.0×10-8~1.5×10-6mol/L,检测限为1.0×10-9mol/L。Cayuela等[21]报道了一种使用含氮聚合物作为前驱体,合成疏水的N-CDs,在氯仿中可与TNT通过光诱导能量转移机制产生荧光猝灭,检测的线性范围为2.2×10-5~2.2×10-4mol/L,检测限为5.3×10-6mol/L。本文以含氮丰富的牛血清白蛋白(Bovine Serum Albumin,BSA)为碳源,采用水热法一步合成的N-CDs可定量检测TNT,同时还可以通过比色法半定量检测TNT。
1 实验部分
1.1 仪器与试剂
pHS -3E型pH计(上海雷磁公司);JEM-2100型场发射透射电子显微镜(日本,JEOL公司);ESCALAB 250 Xi型X射线光电子能谱(XPS)仪(美国,Thermo Fisher Scientific公司);Nicolet iS10型傅立叶变换红外(FTIR)光谱仪(美国,Thermo Fisher Scientific公司);X射线衍射(XRD)仪(日本,Rigaku公司);SPECORD®200 PLUS型紫外-可见分光光度计(德国,耶拿分析仪器股份公司);Cary Eclipse型荧光分光光度计(美国,Agilent公司)。
标准物质2,4,6-三硝基甲苯(TNT)的甲醇溶液购买于中国计量研究院;标准物质2,4-二硝基甲苯、邻硝基甲苯、间硝基甲苯、邻硝基苯酚的甲醇溶液,及标准物质间硝基苯酚均购买于北京坦墨质检科技有限公司。牛血清白蛋白(BSA)、NaOH、H3PO4、H3BO3、KCl、一水合柠檬酸、无水Na2HPO4、KH2PO4均购买于西格玛奥德里奇(上海)贸易有限公司;冰HAc(≥98%,色谱纯)购买于上海阿拉丁生化科技股份有限公司;Ca(OH)2标准缓冲液购买于厦门海标科技有限公司;乙醇(分析纯)购买于西陇科学股份有限公司;甲醇(色谱纯)购买于德国默克公司;实验用水为Milli-Q®系统(美国Millipore)制备的超纯水(电阻率18.2 MΩ·cm)。
1.2 实验方法
1.2.1 N-CDs的制备参考文献报道[22],修订N-CDs合成方法如下:将0.0300 g BSA溶于15.0 mL超纯水中,并在快速混合器上快速混合后,加入15.0 mL乙醇,在冰水浴中超声处理30 min,最后将上述混合液转至容量为50 mL的聚四氟乙烯内衬中,装于不锈钢高压釜中,在180 ℃下反应12 h,冷却至室温;0.22 μm滤膜过滤纯化后,转入透析袋(3 500 D)透析48 h,最后转移至培养皿冷冻干燥,回收固体粉末样品,在4 ℃储存备用。
1.2.2 N-CDs对TNT的紫外-可见吸收光谱和荧光光谱检测将0.0050 g N-CDs溶于50 mL的B-R缓冲液(pH=12)中,取500 μL上述配制的混合液,加入TNT并定容至2 mL,反应60 min后,检测波长190~800 nm的紫外-可见吸收光谱,以及激发波长为310 nm的荧光光谱。
1.2.3 N-CDs对实际水样检测分析取自来水水样,用0.22 μm滤膜过滤,备用待测。取500 μL的含0.1 g/L N-CDs的B-R缓冲液(pH=12),并用采集的水样定容至2 mL,反应60 min后,在激发波长为310 nm进行荧光光谱检测。同时采用加标回收验证该方法的可行性。

图1 N-CDs的透射电镜(TEM)图(A)、粒径分布直方图(B)、高分辨透射电镜(HRTEM)图(C)和X射线衍射图(D)Fig.1 TEM image(A),size distribution histogram(B),high resolution TEM image(C) and X-ray diffraction(XRD) pattern (D) of nitrogen-doped carbon dots(N-CDs)
2 结果与讨论
2.1 N-CDs的形态与组成
由透射电镜(TEM)(图1A)及粒径分布(图1B)可知,以BSA为前驱体,采用水热法制备的N-CDs颗粒分散好,粒径大部分分布在3.5~4.5 nm。由TEM(图1C)可知,N-CDs的外围轮廓模糊,即外部碳化不完全;而从图1C的右上方高分辨透射电镜(HRTEM)图显示出清晰的晶格条纹,表明制备的N-CDs碳芯碳化完全,这与常见CDs由类似石墨的核和无定形的含氧壳层组成相符[8]。从图1D的X射线衍射(XRD)图可知,宽衍射峰位于2θ=21.1°,表明N-CDs以非晶型碳形式存在,与TEM图中碳核外部碳化不完全的结果相符,且与先前的一些报道[22-24]相似。
BSA是水溶性蛋白质,分子量为66.4 kDa,由583个氨基酸组成,其中有35个半胱氨酸,形成17对二硫键,一个游离的巯基[25]。因此对N-CDs的C、H、O和S四种元素进行X射线光电子能谱(XPS)分析(图2A)。结果表明,制备的N-CDs中含有C 88.86%,N 3.20%,O 7.36%及S 0.58%。XPS高分辨C 1s 光谱(图2B)中显示出5个峰,结合能分别为284.5 eV、284.9 eV、285.5 eV、286.5 eV和288.0 eV,这归因于sp2杂化C-C[26,27]、C-C[28]、C-O或C-S或C-N[26,29]、C=O和C=O[30]。N 1s光谱(图2C)在399.8 eV、400.5 eV和401.8 eV处显示三个峰归因于C-N-C、N-(C)3和N-H[28],证实了N-CDs的形成。O 1s光谱(图2D):C=O(531.8 eV)、C-OH或C-O-C(532.3 eV)和N-OH(533.4 eV)[28,31]。

图2 N-CDs的X射线光电子能谱(XPS)表征。(A)全谱图,(B)C 1s谱图,(C)N 1s谱图,(D)O 1s谱图Fig.2 XPS of N-CDs(A) full spectrum,(B) C1s spectrum,(C) N 1s spectrum,(D) O 1s spectrum

图3 BSA(a) 和N-CDs(b)的傅立叶变换红外光谱图Fig.3 Fourier transform infrared(FTIR) spectra of BSA(a) and N-CDs(b)
由傅立叶变换红外(FTIR)光谱仪测得的谱图见图3。分析图谱:N-CDs(图3曲线b)的N-H、C-H和C=N伸缩振动分别在3 292 cm-1、2 963 cm-1、1 659 cm-1处有明显的峰[32,33],以及COO-(1 395 cm-1)和C-O-C(1 151 cm-1)[22],表明制备的N-CDs含有丰富的含氧基团。与原料BSA(图3曲线a)对比,制备的N-CDs在C=C(1 583 cm-1)的伸缩振动峰变宽,表明在水热制备N-CDs的过程中,BSA被碳化而形成不饱和的碳键,这与XPS中C 1s表征的sp2杂化C-C结果一致。
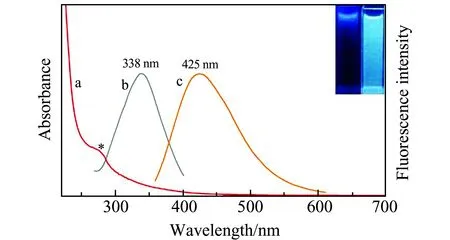
图4 N-CDs的紫外-可见光谱(a)以及荧光激发(b)和发射(c)光谱图 (插图:N-CDs在254 nm(左)和365 nm(右)紫外灯照射下图片)Fig.4 UV-Vis spectrum(a),fluorescence excitation spectrum(b) and emission spectrum (c) of N-CDs (Inset:photographs of N-CDs under 254 nm(left) and 365 nm(right) UV irradiation)
2.2 N-CDs的荧光特性
N-CDs的紫外-可见(UV-Vis)吸收光谱(图4a)表明,在波长277 nm处有一吸收峰,是荧光N-CDs的一个典型特征[34],归因于n-π*跃迁吸收[35],碳与双键相连接的杂原子C=O、C=N、S=O上未成键的孤对电子向π*反键轨道跃迁吸收所致。N-CDs的荧光激发光谱(图4b)和发射光谱(图4c),在波长338 nm处激发时,425 nm处显示出最大发射峰。插图中显示:254 nm紫外光照射下,N-CDs水悬浮液只呈现出微弱蓝光,而365 nm紫外光照射下,呈现相对较强蓝绿色荧光,表明N-CDs在水中分散性良好[36]。
N-CDs的另一个显著特征是具有激发波长的依赖性[35]。如图5A所示,340 nm激发时,N-CDs最大发射位于425 nm;400 nm激发时,发射峰移至468 nm。N-CDs在不同激发波长下的归一化荧光光谱,如图5B所示,这种变化更为明显。
在500 μL的含0.1 g/L N-CDs的B-R缓冲溶液(pH=12)中加入不同体积的甲醇后,用超纯水定容至2 mL,在激发波长310 nm的条件下,发射波长403 nm处N-CDs的荧光强度无明显的变化,表明甲醇对N-CDs荧光强度的影响可基本忽略。同时,在不同浓度的NaCl溶液中,在激发波长320 nm的条件下,发射波长413 nm处N-CDs的B-R缓冲液(pH=12)荧光强度同样无明显的变化,表明N-CDs稳定,在高离子强度条件下也不会聚集[28,29]。
2.3 N-CDs对TNT的检测
反应时间对N-CDs检测TNT时荧光强度的影响如图6A所示,0~5 min时,N-CDs的荧光强度急剧下降,5~60 min时,N-CDs的荧光强度依然缓慢地不断减弱,60 min后N-CDs的荧光强度几乎不再发生变化。因此,N-CDs对TNT的响应截止时间设为60 min。一定量的TNT加入配制的含0.1 g/L N-CDs的不同pH值B-R缓冲液,在激发波长320 nm条件下,记录有无TNT时N-CDs的荧光强度,如图6B所示。N-CDs的pH稳定性好,不同pH下N-CDs对TNT都有一定的荧光猝灭响应,而pH=12时,N-CDs响应最为灵敏。同时,插图中为加入TNT反应60 min后溶液的颜色,仅有pH=12时,溶液的颜色为浅橙色,易于辨别。

图5 (A) N-CDs不同激发波长下荧光发射光谱;(B) N-CDs不同激发波长下归一化荧光光谱Fig.5 (A)Fluorescence emission spectra of N-CDs excited at different wavelengths;(B) Normalized fluorescence emission spectra of N-CDs excited at different wavelengths

图6 (A) 反应时间对N-CDs检测TNT时荧光强度的影响;(B)不同pH的B-R缓冲液和有无TNT时N-CDs的荧光强度(黑色和橙色直方图分别代表无TNT和有TNT)。插图:不同pH的N-CDs液,检测TNT时日光下的照片。Fig.6 (A) Effects of reaction time on the change of fluorescence intensity of N-CDs for TNT delection;(B) Intensity of N-CDs in B-R buffer with different pH and with or without TNT(black and orange histograms represent absence and presence of TNT,respectively).Inset:Photograph of N-CDs at different pH under daylight when TNT is detected.
研究不同缓冲体系对N-CDs检测TNT的影响。等量的N-CDs分别加入pH=12的B-R、Ca(OH)2、Na2HPO4-NaOH不同缓冲液中,然后加入等量的TNT,在激发波长320 nm条件下,测试有无TNT时的荧光强度,如图7A所示。其中,N-CDs溶液的荧光强度为F0,而检测TNT的N-CDs溶液的荧光强度为F,N-CDs荧光强度的变化为ΔF=F0-F。由图可知:ΔF/F0(B-R)>ΔF/F0(Ca(OH)2)>ΔF/F0(Na2HPO4-NaOH)。在B-R缓冲液中,N-CDs对TNT响应的灵敏度最佳,所以选择pH=12的B-R缓冲体系作为N-CDs检测TNT的溶剂环境。由不同激发波长下N-CDs检测有无TNT时荧光强度的变化,对N-CDs检测TNT时的激发波长进行优化,如图7B所示。根据荧光强度的大小,以及比较ΔF/F的大小,确定310 nm为N-CDs检测TNT的最佳激发波长。

图7 不同缓冲液下(A)和不同激发波长(B)时N-CDs与TNT作用前后的荧光强度(黑色直方图代表N-CDs的荧光强度,橙色代表检测TNT时N-CDs的荧光强度)Fig.7 Fluorescence intensity of N-CDs before and after reacting with TNT under different buffer systems(A) and under different excitation wavelengths(B)The black histograms represent the fluorescence intensity of N-CDs,and the orange represent the fluorescence intensity of N-CDs when detecting TNT.
综上所述,500 μL的含0.1 g/L N-CDs的B-R缓冲液(pH=12)中,加入一定量的TNT,最终定容至2 mL,反应60 min后,以310 nm为激发波长,测定N-CDs的荧光发射光谱。随着TNT量的不断增加,N-CDs的荧光猝灭现象越明显,并出现蓝移现象,反应液的颜色越深,如图8A所示。TNT加入后,溶液的颜色由起初的无色转变为玫红色,最后为橙色的比色响应可以肉眼捕获,根据颜色的深浅可进行半定量分析检测TNT。根据Stern-Volmer方程:F0/F=1+KSV·[Q]。其中F0和F分别为无TNT和有TNT存在时N-CDs的荧光强度,KSV为Stern-Volmer猝灭常数,[Q]为猝灭剂TNT的浓度。如图8B中的插图所示,工作曲线由(F0-F)/F和猝灭剂TNT的浓度映射关系,在2.6×10-6~8.0×10-4mol/L范围内存在显著的线性相关关系(R2=0.9950),检出限(3σ/k)为5.1×10-6mol/L。

图8 (A) B-R缓冲液(pH=12)中不同浓度TNT时N-CDs的荧光发射光谱(插图:对应反应溶液在日光下的照片);(B)B-R缓冲液(pH=12)中不同浓度TNT时N-CDs的荧光猝灭图(插图:N-CDs的Stern-Volmer图)Fig.8 (A) Fluorescence emission spectrum of N-CDs in B-R buffer(pH=12) at different concentrations of TNT(Inset:photograph of the corresponding reaction solution under daylight);(B) Fluorescence quenching spectrum of N-CDs in B-R buffer(pH=12) at different concentrations of TNT(Inset:Stern-Volmer plots of N-CDs)

图9 其他硝基甲苯化合物和硝基酚类化合物对N-CDs检测TNT的干扰作用Fig.9 Interference effect of other nitrotoluene compounds and nitrophenols on the detection of TNT using N-CDs
探讨TNT相似干扰物2,4-二硝基甲苯(2,4-Dinitrotoluene,2,4-DNT)、2-硝基甲苯(2-Nitrotoluene,2-NT)、3-硝基甲苯(3-Nitrotoluene,3-NT)、2-硝基苯酚(2-Nitrophenol,2-NP)、3-硝基苯酚(3-Nitrophenol,3-NP)对N-CDs的荧光猝灭的影响。于N-CDs的B-R缓冲液(pH=12)中,加入上述等浓度等体积的硝基芳香爆炸物,60 min后,以激发波长310 nm测定反应液的荧光强度。由图9可知,通过TNT、2,4-DNT、2-NT和3-NT对N-CDs的荧光猝灭效率可知,TNT猝灭效应最佳,其次为2,4-DNT,最后为猝灭效应相近的2-NT和3-NT,可知硝基甲苯化合物对N-CDs的猝灭效应与硝基的个数有关。而将其中的硝基甲苯化合物和芳香硝基酚类化合物相比,芳香硝基酚类化合物对N-CDs的猝灭效应更好。在N-CDs检测TNT的抗干扰实验中,2,4-DNT、2-NT、3-NT、2-NP和3-NP都加强了TNT对N-CDs的猝灭效应,对N-CDs检测TNT具有正向干扰性,N-CDs检测TNT的抗干扰性不佳。N-CDs与硝基甲苯类化合物的猝灭可归因于硝基甲苯类化合物与N-CDs氨基之间形成的Meisenheimer络合物所致;而对于硝基苯酚类化合物,则是N-CDs氨基与酚羟基之间发生酸碱反应形成硝基酚盐的结果[17]。
2.4 实际水样中TNT检测
通过测定自来水水样中的TNT,检验该方法的适用性。对掺有标准TNT溶液(60、80和100 μmol/L)的样品进行了加标回收率的测试,所获得的样品回收率从97.6%~99.6%,且测定的相对标准偏差(RSD)最大值为2.5%,表明该方法可用于实际水样中TNT检测(表1),即水样中共存物质不干扰测定。

表1 水样中TNT的检测
3 结论
本文以含氮丰富的BSA为碳源,采用水热法制备N-CDs,不需进一步的化学修饰,而在宽的pH范围内保持良好的荧光强度,检测TNT表现出良好的线性关系,同时依据反应液可肉眼捕获的比色响应,半定量检测TNT。但是,N-CDs对TNT检测的选择性不佳,且受到其他硝基芳香甲苯化合物和硝基酚类化合物的干扰,实际应用中将受到一定的限制。所以,提高N-CDs对TNT的选择性和抗干扰性,是后续工作中值得展开探讨的方向。

