Loop长度对G -四链体DNA识别和结合肿瘤细胞的能力的影响
梅秋毫, 卢珊珊, 甄笑笑, 张 楠*
(1.中国科学院化学研究所,北京 100190;2.三峡大学生物与制药学院,湖北宜昌 443000)
G -四链体是由富含串联重复鸟嘌呤(G)的DNA或RNA折叠形成的核酸二级结构。人的基因组中,特别是启动子区存在许多可形成G -四链体的序列,这些序列涉及基因复制、转录、重组等多种生理[1,2]和癌症、糖尿病和心血管病等疾病的发生病理[3]过程,可作为药物设计的靶标。人工合成的G -四链体DNA也被发现具有如抗肿瘤活性等多种生物学活性[4,5],如AS1411是一种抗增殖的富G核苷酸序列,能够特异性识别核仁素,从而实现癌症的靶向治疗[6]。
核酸适配体(Aptamer)是通过指数富集的配体系统进化(Systematic Evolution of Ligands Exponential Enrichment,SELEX)技术,筛选出来的一类功能寡聚核苷酸,具有特异性识别能力。近年来,特异性靶向肿瘤细胞核酸适配体的筛选和应用是该领域的研究热点,将这类核酸适配体作为分子探针可实现体内肿瘤细胞的早期发现和成像定位,同时核酸适配体药物缀合物在靶向药物治疗方面具有极大的应用前景[7,8]。目前文献报道的很多核酸适配体都具有G -四链体结构,如靶向肝细胞生长因子受体核酸适配体CLN0003[9]、靶向stat3核酸适配体T40214[10]、靶向核仁素核酸适配体AS1411[6,10]等。这些靶向识别肿瘤细胞表面受体的核酸适配体的DNA序列倾向于形成G -四链体结构,提示核酸适配体对肿瘤细胞的结合能力可能与其G -四链体结构有关。我们实验室的前期研究发现,G -四链体对肿瘤细胞具有普遍的识别和结合能力,并初步验证了G -四链体细胞结合能力与细胞表面的核仁素等蛋白具有相关性[11]。
G -四分体是G -四链体的结构单元,由Hoogsteen氢键连接4个G形成环状平面,两层或以上的G -四分体通过π-π堆积形成G -四链体,而G四分体之间由1~7个核苷酸连接,这些连接G -四分体的核苷酸被称为loop环。一般G -四链体核酸一级序列为5′-GnXmGnXmGnXmGn-3′(X为A、T、C或G,m=1~7,n=2或3),X即为串联G四分体的loop环。前期研究发现loop环不同的G -四链体DNA对肿瘤的抑制增殖作用不同[12]。对于G -四链体DNA,G -四分体相同,而loop环可以不同,因此loop环的碱基种类和个数决定了G -四链体的构型和功能。目前,G -四链体DNA的loop环对其肿瘤细胞识别和结合作用的影响未见报道;探索G -四链体结构如loop环长度等对其识别和结合肿瘤细胞能力的影响,将对设计合成特异性靶向肿瘤细胞的核酸适配体,以及具有抗肿瘤增殖活性的寡核苷酸具有指导意义。本文通过圆二色光谱和抗动物血清核酸酶稳定性实验,考察loop长度对G -四链体DNA构型的影响;利用流式细胞术和激光共聚焦成像,考察G -四链体DNA与肿瘤细胞的表面结合和被摄取情况,从而确定loop长度对G -四链体DNA识别和结合肿瘤细胞的能力的影响。
1 实验部分
1.1 仪器及试剂
J-815型圆二色光谱仪(日本,JASCO公司);NANODROP 2000超微量分光光度计(Thermo Fisher scientific公司);DYY-10C垂直电泳仪(北京六一仪器厂);DNR Bio Imaging Systems凝胶成像系统(以色列,DNR成像系统有限公司);BD FACSCalibur流式细胞仪(美国,Beckman Dickson公司);OLYMPUS IX83 激光扫描共聚焦显微镜(日本,奥林巴斯)。
三羟甲基氨基甲烷(Tris)、N,N,N′,N′-四甲基二乙胺(TEMED)、牛血清白蛋白(BSA)购自美国Amresco公司;EDTA及其他化学试剂均为分析纯,购自国药集团化学试剂北京有限公司。RPMI-1640培养基、DMEM培养基、胰蛋白酶均为Gibco品牌,购自赛默飞世尔科技(中国)有限公司。胎牛血清(FBS)系南美血源,购自德国PAN公司。磷酸盐缓冲液(PBS),洗涤缓冲液(Washing Buffer,WB)为含5 mmol/L MgCl2和0.9 g/L葡萄糖的PBS,结合缓冲液为含0.5 mg/mL鲱鱼精DNA和1 mg/mL BSA的WB。人正常胚肾成纤维细胞(HEK293)、人子宫颈癌细胞(HeLa)购自中国科学院上海细胞库;耐阿霉素的荷尔蒙依赖性乳腺癌细胞(MCF-7/ADM)购自上海艾研生物技术公司;急性T细胞白血病细胞(Jurkat E6-1)购自医学科学院基础医学研究所(北京);人前列腺癌细胞(PC3)、人结肠癌细胞(LoVo)、人前列腺癌细胞(DU145)、人膀胱癌细胞(T24)、耐紫杉醇人卵巢癌细胞(A2780T)等均购自北京协和细胞库。
本实验设计了一组不同loop长度的G -四链体DNA(G4L1、G4L2和G4L3,loop长度分别为1 nt、2 nt 和3 nt),以及一个不含G的对照DNA序列(Ctr sq),具体序列信息详见表1。为了便于检测,同时合成了一组在5′端标记有荧光素(FAM)的G4L1、G4L2、G4L3和Ctr sq,分别命名为F-G4L1、F-G4L2、F-G4L3 和F-Ctr(下文统称为F-DNA)。所有DNA均由生工生物工程(上海)有限公司合成和纯化。

表1 G -四链体DNA名称与一级序列
1.2 实验方法
1.2.1 DNA样品的制备DNA冻干粉用PBS溶解,OD260标定浓度,标定至浓度为40 μmol/L;F-DNA冻干粉用同样的方法标定至浓度为20 μmol/L。两种DNA母液通过95 ℃加热变性5 min,再置于冰上复性10 min,而后放于4 ℃冰箱过夜,使其缓慢形成热力学稳定结构,用于与细胞结合的系列实验。
1.2.2 圆二色光谱实验将40 μmol/L的DNA母液用PBS稀释10倍,制成400 μL 4 μmol/L DNA溶液,室温放置2 h,而后进行圆二色光谱测定。圆二色光谱仪参数:灵敏度为100,扫描速度为500 nm/s,扫描次数为3次,扫描范围200~400 nm。数据用origin8.1软件进行处理。
1.2.3 抗核酸酶稳定性实验将5′端标记有FAM的不同的G -四链体DNA(F-G4L1、F-G4L2、F-G4L3)和胎牛血清(FBS)在PBS中混合,配制成500 μL混合溶液,其中G -四链体DNA的终浓度均为4 μmol/L,FBS的含量均为2%,混匀后置于37 ℃的生化培养箱中孵育。分别在孵育0 min、15 min、30 min、1 h、8 h和24 h后,取3种不同的G -四链体DNA的混合孵育液50 μL,各加1 μL EDTA,涡旋振荡5 s,95 ℃变性5 min以降解血清中核酸酶活性,然后置于-20 ℃下保存。待所有样品取样结束后,样品中加入上样缓冲液,95 ℃变性5 min后,进行凝胶电泳分析。20%变性聚丙烯酰胺凝胶电泳,含7 mol/L的脲作为变性剂,电解缓冲液使用1×TBE(89 mmol/L Tris+2 mmol/L EDTA+2 mmol/L硼酸,pH为8.4),电压为120 V,电泳2 h。
1.2.4 流式细胞分析所有细胞均在37 ℃、5%CO2的培养箱中用1640培养基(含10%FBS)培养。细胞根据生长周期,待生长密度约为70%~80%时传代。分别将培养48 h的细胞(HEK293、HeLa、MCF-7/ADM、Jurkat E6-1、PC3、LoVo、DU145、T24和A2780T)与荧光标记的G -四链体DNA在结合缓冲液中进行孵育,然后用流式细胞仪进行分析。每种细胞的孵育实验均设计成5组,分别为空白对照组(cells only)、对照序列组(F-Ctr)、F-G4L1组、F-G4L2组和F-G4L3组。每组均为将相应的F-DNA加入细胞溶液中(空白组不加)混合,孵育液的体积为200 μL,F-DNA的终浓度均为200 nmol/L。在冰上孵育30 min后,用洗涤缓冲液洗涤,用流式细胞仪进行数据采集,检测的数据用Flow Jo软件处理。加入F-DNA后皆要避光以防荧光猝灭。除Jurkat细胞(不贴壁)外,所有的细胞孵育前,均用5 mmol/L的EDTA消化5~7 min,然后用洗涤缓冲液洗涤。
1.2.5 结合解离常数(Kd值)的测定分别将0、20、40、60、80、100、200 nmol/L的F-G4L1与T24细胞在结合缓冲液中混合,冰上孵育30 min,用洗涤缓冲液洗涤,用流式细胞仪进行荧光数据采集。所得数据用Flow jo和Graphpad软件处理。
1.2.6 胰酶消化实验实验设计成两个大组,即EDTA消化组和胰酶消化组:两皿T24细胞,生长48 h后,分别用EDTA溶液和胰酶将细胞从培养皿上消化解离,制成单细胞分散液。胰酶消化组是向皿中加入1 mL 0.25%胰蛋白酶溶液,消化2 min,再用1 mL 1640培养基(含10%FBS)终止消化;EDTA消化组是向皿中加入1 mL 5 mmol/L EDTA,消化5~7 min,加入洗涤缓冲液终止消化。两组细胞离心后,都用洗涤缓冲液洗涤两次,然后在结合缓冲液中分别与F-G4L1、F-Ctr混合孵育,另外都设一个cells only组(不加F-DNA)。孵育总体积为200 μL,F-DNA终浓度为200 nmol/L,冰上孵育30 min,用洗涤缓冲液洗涤后,上流式细胞仪进行荧光数据采集。用Flow jo软件处理数据。
1.2.7 激光扫描共聚焦成像分析3×105个T24细胞铺于玻璃底的激光共聚焦培养皿中,生长约36 h后,取8皿细胞,吸去培养基,用洗涤缓冲液将皿中的细胞洗两次,再将含有不同F-DNA(F-G4L1、F-G4L2、F-G4L3和F-Ctr)的结合缓冲液分别加入细胞中,取4皿在4 ℃条件下孵育30 min,另外4皿细胞在37 ℃下孵育30 min,孵育结束后,吸去上清,用洗涤缓冲液洗一次,用激光扫描共聚焦显微镜观察拍照(用488 nm激光光源进行激发,接收范围为500~600 nm)。制出T24细胞与F-G4L1于37 ℃孵育结合的三位重构图像。激光共聚焦二维图像和三维重构图像用FV31S-SW软件进行处理。
2 结果与讨论
2.1 loop环长度对G -四链体DNA拓扑结构的影响
G -四链体DNA一级序列5′-G3HnG3HnG3HnG -3′(H为loop碱基,代表A、C、T碱基中的任意一种,n为loop长度),其中loop比为1∶1∶1、2∶2∶2和3∶3∶3 这三类loop长度比的G -四链体序列在人类基因组内分布广泛,占所有G -四链体序列约12%,具有重要的研究价值[13]。因此,为了考察loop环长度对G -四链体DNA的构型和结构稳定性的影响,设计了上述三种loop环长度的G -四链体,loop环长度分别为1 nt、2 nt和3 nt,并分别命名为G4L1、G4L2和G4L3,序列如表1所示。圆二色(CD)光谱可以反映出G -四链体的拓扑结构,反平行结构G -四链体DNA其CD光谱在波长290 nm处为正峰,260 nm处为负峰;平行结构G -四链体DNA在波长264 nm处为正峰,240 nm处为负峰;混合平行结构则在波长295 nm处为正峰,265 nm处出现正的肩峰,235 nm到240 nm间为负峰[14-16]。如图1所示,G4L1的CD光谱在波长264 nm处有正峰,240 nm处为负峰,表明G4L1为平行结构;G4L2、G4L3在295 nm处为正峰,235 nm处为负峰,并在264 nm处为正的肩峰,表明都两者为混合平行结构。上述结果表明,一个碱基长度loop的G -四链体DNA倾向于形成平行结构/两个和三个碱基长度loop的G -四链体DNA倾向于形成混合平行结构。这与Hazel等[17]发现loop短的G -四链体倾向于形成紧凑的平行结构的现象相符。
2.2 loop环长度对G -四链体DNA结构稳定性的影响
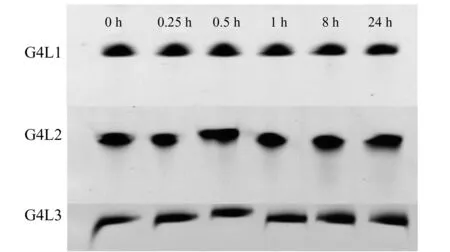
图2 F-DNA与10%FBS在PBS中孵育不同时间的聚丙烯酰胺凝胶电泳图Fig.2 Denatured polyacrylamide gel electrophoresis of F-DNA in PBS containing 10%FBS at different times
寡核苷酸易被核酸酶分解,而Cao等发现形成G -四链体结构的单链DNA较稳定,不易被核酸酶分解[18]。为了考察G4L1、G4L2和G4L3是否也在核酸酶下稳定,我们将荧光标记的这三种G四链体DNA分别与含有核酸酶的FBS于37 ℃混合孵育不同时间,用变性聚丙烯酰胺凝胶电泳对三种G -四链体DNA在血清中的降解情况进行分析。结果如图2所示,在2%FBS孵育中24 h后,F-G4L1的电泳条带最清晰,而F-G4L2 和F-G4L3的电泳条带都有轻微地拖尾,说明F-G4L1几乎没有降解,而G4L2和G4L3都略有降解。这表明G4L1、G4L2和G4L3耐核酸酶的能力都较强,而G4L1最强,在细胞孵育液中能够稳定存在。
2.3 loop环长度对G -四链体DNA的细胞识别能力的影响
从上述结果可知,loop环长度可影响G -四链体DNA的构型,继而考察不同loop长度的G4L1、G4L2和G4L3与9种细胞(除HEK293细胞为正常细胞外,其余均为肿瘤细胞)的结合情况。将荧光标记的DNA(F-G4L1、F-G4L2、F-G4L3和F-Ctr)在4 ℃下与细胞在结合缓冲液中孵育,用流式细胞术分析细胞表面荧光情况。如图3所示,与G4L1、G4L2和G4L3这三种G -四链体DNA分别孵育后,PC3、LoVo、Jurkat E6-1和A2780T表面荧光与空白对照相比没有明显变化,说明G4L1、G4L2和G4L3与这四种细胞几乎无结合;而DU145和HEK293与G4L1、G4L2和G4L3有较弱结合;G4L1和G4L2在MCF-7/ADM表面有较强荧光,而G4L3与MCF-7/ADM表面荧光较弱。这说明loop短的G4L1和G4L2与MCF-7/ADM的结合能力比loop长的G4L3强,MCF-7/ADM对G -四链体DNA的较强结合能力在以往文献中也有类似报道[11];G4L1、G4L2和G4L3在T24表面荧光都比较强,说明这3种G -四链体DNA均能够与T24有较强结合,其中loop最短(1nt)的G4L1荧光强度最大,说明其与T24结合能力最强,T24对G -四链体DNA的强结合能力还未见报道,对其结合能力的进一步研究,有助于深入理解G -四链体DNA对细胞的结合作用。

图3 F-DNA与不同细胞相互作用的流式细胞术分析Fig.3 Flow cytometric analysis of interaction between F-DNA with different cells
2.4 G -四链体DNA与T24结合能力的考察

图4 T24与不同浓度F-DNA结合的亲和力曲线Fig.4 Binding affinity curve of F-DNA with T24
G4L1与T24的结合能力强,为了考察其在对T24进行定位检测和靶向药物运送方面的应用前景,我们对G4L1和T24的相互作用进行了较深入的研究。首先考察G4L1与T24的结合解离常数(Kd)。将不同浓度的F-G4L1分别与T24于冰上混合孵育,用流式细胞术分析测量F-G4L1与T24荧光强度。如图4所示,两者的结合亲和力曲线对应的Kd值为105.8 nmol/L,这表明G4L1与T24细胞有较强的结合能力,有望能够用于肿瘤细胞T24的识别诊断和治疗。
2.5 G -四链体DNA识别T24表面靶物质的表征
与肿瘤细胞表面结合实验表明,G4L1结合能力强于G4L2和G4L3,其可能原因之一是loop短的G4L1形成的平行结构更容易识别和结合肿瘤细胞,而loop长的G4L2和G4L2形成的混合平行结构识别和结合肿瘤细胞的能力较弱。而对于同一种G -四链体DNA与不同细胞的结合情况也不同,这一结果与以往的文献报道相吻合[11]。分析其原因可能是G -四链体DNA识别细胞表面特定的靶蛋白,而不同细胞的表面特定靶蛋白的表达量不同,其表达越多,则与G -四链体DNA的结合越强。
为了确证G4L1识别和结合T24的靶标物质为细胞表面蛋白质,利用胰蛋白酶水解T24的表面膜蛋白后,与F-G4L1进行孵育,在4 ℃下用流式细胞术考察蛋白酶消化处理后的T24与F-G4L1的结合情况。以EDTA解离的细胞作为阳性对照组。如图5所示,胰酶消化的T24与F-G4L1的结合(T24-G4L1-trypsin)远少于EDTA解离的T24(T24-G4L1-EDTA),说明G4L1可结合T24的表面膜蛋白。

图5 G4L1与EDTA与胰蛋白酶消化后的T24结合的流式细胞术结果(A)和平均荧光强度(B)Fig.5 Histograms of flow cytometry of the binding of G4LI to T24 digested by EDTA or trypsin at 4 ℃(A) and their mean values of fluorescence intensity(B)
2.6 T24对G -四链体DNA内吞作用的激光共聚焦成像

图6 F-DNA与T24在4 ℃(A)和37 ℃(B)下孵育的共聚焦成像Fig.6 Confocal images of T24 incubated with F-DNA at 4 ℃(A) and 37 ℃(B) for 30 minAll scale bars represent 20 μm.
为了研究不同loop长度的G -四链体DNA在T24中被受体介导内吞的情况,利用激光扫描共聚焦显微成像技术考察不同温度(4 ℃和37 ℃)下标记有荧光素的G -四链体DNA(F-G4L1、F-G4L2和F-G4L3)和对照序列(F-Ctr)在T24中的位置。如图6所示,在4 ℃条件下,F-Ctr在细胞表面无荧光,而F-G4L1、F-G4L2和F-G4L3荧光分布在细胞膜表面,进一步证实了G -四链体DNA可与T24的表面膜蛋白结合;在37 ℃条件下,G4L1荧光大部分出现在细胞中,也出现在细胞膜上,荧光强度较强,而G4L2的荧光部分出现在细胞中,大部分出现在膜上,荧光强度较弱。这表明在4 ℃条件下,G -四链体DNA结合在肿瘤细胞膜蛋白上,在37 ℃条件下G -四链体DNA会被内吞进入肿瘤细胞,且loop长度短的G4L1更易被摄取。
对37 ℃下与G4L1结合的T24进行Z轴扫描并三维重构以得到细胞三维图像。如图7所示,从三维图像可以直观地看出G -四链体DNA被摄取进入细胞内;并且在X-Y平面上选取荧光点,该点在X-Z和Y-Z两个平面都有荧光,进一步证实了G4L1被细胞摄取并进入细胞内。

图7 37 ℃下G4L1进入细胞的共聚焦三维重构图Fig.7 The 3D reconstruction images of confocal imaging of G4L1 internalized by T24 at 37 ℃
3 结论
本文采用圆二色光谱和凝胶电泳对不同连接环(loop)长度G -四链体DNA的结构和稳定性进行了研究,利用流式细胞术和激光共聚焦显微技术考察了它们与不同肿瘤细胞的结合情况,研究了G -四链体DNA的连接环(loop)长度在其与肿瘤细胞结合中的作用。结果表明,loop长度越短的G -四链体DNA越易形成平行结构,识别和结合肿瘤细胞的能力越强,也更容易被细胞摄取;loop长度长的G -四链体DNA倾向于形成混合平行结构,这种结构的G -四链体DNA识别和结合肿瘤细胞的能力较弱。G -四链体loop长度与其形成的空间结构的对应关系,以及与细胞结合的普遍规律,对筛选或者高亲和力、高特异性识别肿瘤细胞的含G -四链体结构的核酸适体,以及含G -四链体结构的靶向药物递送系统的设计和构建提供了参考和依据。

