急诊脓毒症严重程度评分对ICU脓毒症患者预后的预测价值
黄嵘 徐芳媛 方向群 李翔
ICU收治的患者病种复杂、病情危重,为便于正确、客观地评估病情、判断预后,常需要进行危重病评分。目前用于临床的各种评分较多,包括急性生理学与慢性健康评估Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)评分系统、牛津急性疾病严重程度评分(oxford acute severity of illness score,OASIS)、早期预警评分等非特异性评分[1-2]和重症急性胰腺炎CCAAB评分、肺炎CURB-65评分、急诊脓毒症严重程度评分(emergency department severity of sepsis score,EDSSS)等特异性评分[3-4]。EDSSS是Smyth等[4]于2019年提出的,用于评价脓毒症患者的病情严重程度。目前有关该评分在ICU患者病情和预后评估方面的适用性研究较少。本研究旨在探讨EDSSS对ICU脓毒症患者预后的判断价值,并与APACHEⅡ评分进行比较,现将结果报道如下。
1 对象和方法
1.1 对象 回顾2018年1月至2019年7月入住皖南医学院附属黄山市人民医院的脓毒症患者。纳入标准:(1)年龄≥18 岁;(2)性别不限;(3)符合脓毒症 3.0 诊断标准。排除标准:(1)住院期间相关检查资料不完善者;(2)自动出院,导致影响预后判断者。共纳入109例患者,男 77例(70.64%),女 32例(29.36%);年龄 40~92(72.75±12.95)岁;ICU 住院时间 8(3,16)d;有创机械通气时间 6(2,13)d;存活组 66 例(60.55%),死亡组 43例(39.45%)。感染部位:肺部感染70例,腹腔感染27例,尿路感染4例,其它8例。
1.2 方法
1.2.1 资料收集 患者年龄、性别和诊断;ICU住院时间、有创机械通气时间;有无休克和急性肾损伤;EDSSS和APACHEⅡ评分分值。EDSSS和APACHEⅡ评分均以入科后24 h内各项指标的最差值进行评分。根据ICU转归,将患者分为存活组和死亡组。
1.2.2 定义和诊断标准 脓毒症 3.0诊断标准中将脓毒症定义为:感染引起的宿主反应失调所导致的致命性器官功能障碍;脓毒症 3.0诊断标准即感染+全身感染相关的序贯器官衰竭评分(sequential organ failure assessment,SOFA)≥2 分[5]。EDSSS 具体标准见表 1。

2 结果
2.1 两组脓毒症患者一般资料比较 两组患者性别、年龄、ICU住院时间和有创机械通气时间比较差异均无统计学意义(均P>0.05)。死亡组患者EDSSS、APACHEⅡ评分均高于存活组,差异均有统计学意义(均P<0.01),见表2。

表1 EDSSS具体标准
2.2 两组脓毒症患者EDSSS各项指标比较 存活组患者呼吸、心率低于死亡组,收缩压、GCS评分及脉搏氧饱和度高于死亡组,差异均有统计学意义(均P<0.05),体温和皮肤变化比较差异均无统计学意义(均P>0.05),见表3。
2.3 两种评分预测脓毒症患者死亡风险的诊断截点、Youden指数、灵敏度、特异度和AUC比较 见表4和图1。
3 讨论
对危重患者的病情进行量化评估,是治疗过程、医疗质量与医疗安全的共同需要,是现代医学发展的客观必然趋势。20世纪80年代以来,各种危重病评分系统已在临床工作中得到广泛应用。常用的非特异性评分系统包括APACHEⅡ评分系统、简化急性生理学评分(simplified acute physiology score,SAPS)Ⅱ等[1,6]。但在实际工作中,这些评分系统需要的资料相对复杂,且时间跨度较大,包含许多实验室检查指标,在实践中相对不易操作,对患者病情及预后的判断及时性较差,难以满足临床需要。此外,这些非特异性评分对ICU患者总体预后的评价效果较好,但对具体疾病的病情和预后判断效果存在偏差。因此临床上不断推出各种专科评分,如Smyth等[4]就提出了专门针对脓毒症的EDSSS。与传统的评分系统比较,EDSSS相对简单,没有实验室检查内容,但包括了年龄、体温、脉搏氧饱和度、心率、收缩压、呼吸频率、GCS评分和皮肤等8个指标。研究证实,该评分对脓毒症患者预后判断的AUC达到了0.87[4]。
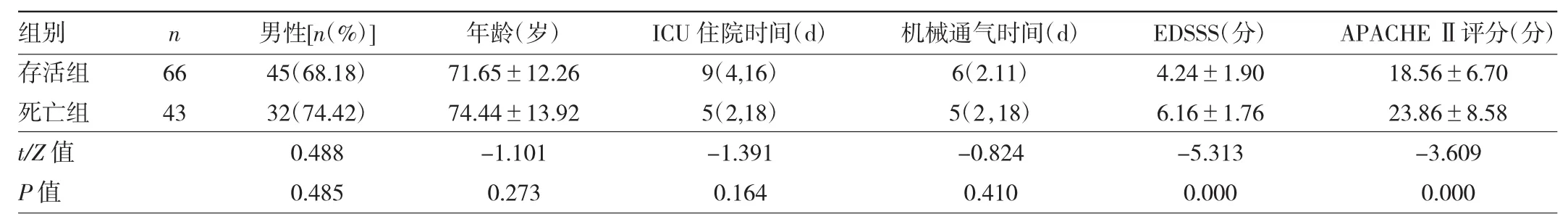
表2 两组脓毒症患者一般资料比较
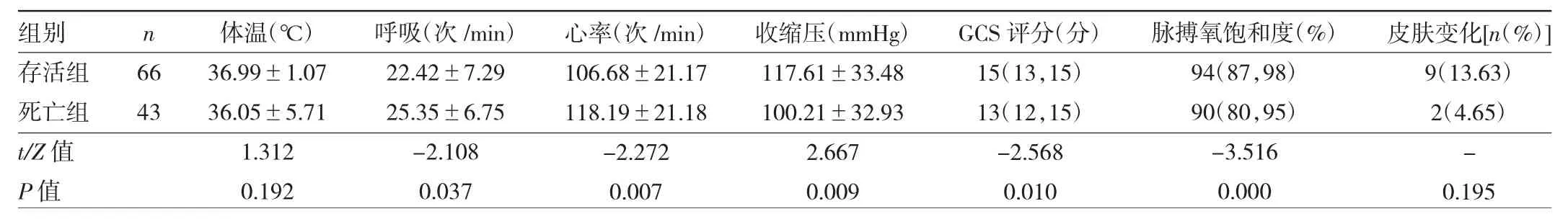
表3 两组脓毒症患者EDSSS各项指标比较

表4 两种评分预测脓毒症患者死亡风险的诊断截点、Youden指数、灵敏度、特异度和AUC比较
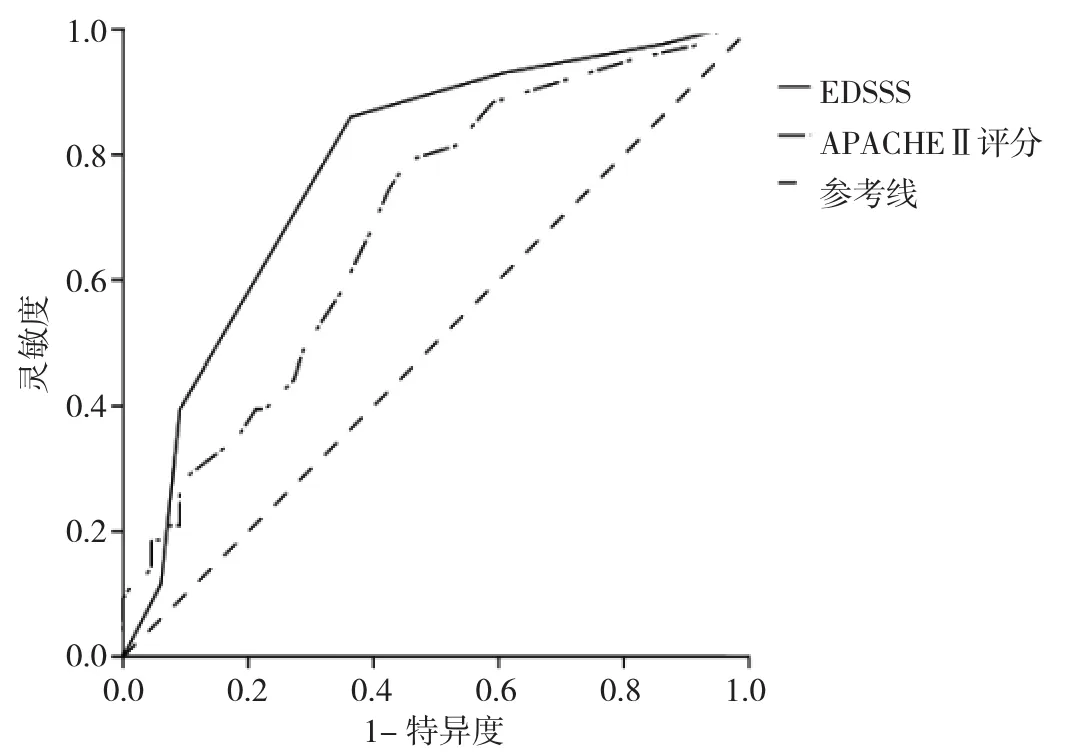
图1 ICU脓毒症患者急诊脓毒症严重程度评分(EDSSS)和急性生理学与慢性健康评估Ⅱ(APACHEⅡ)评分预测预后的ROC曲线
本研究结果显示EDSSS和APACHEⅡ评分均可用于脓毒症患者的病情评估,死亡组患者平均EDSSS为(6.16±1.76)分,平均 APACHEⅡ评分为(23.86±8.58)分,均高于存活组,差异有统计学意义。进一步研究发现,在评价脓毒症患者死亡风险的效能方面两者有所差异。EDSSS的AUC为0.780,APACHEⅡ评分则为0.691,提示EDSSS对ICU脓毒症患者预后的判断价值高于APACHEⅡ评分。研究指出,由于单独应用APACHEⅡ评分评估脓毒症患者预后可能导致偏差,因此临床上往往将其联合其它指标一起用于脓毒症病情的评估[7]。EDSSS则相对简单,没有相关实验室指标,但对预后具有较好的判断价值,可在临床上广泛使用。ROC曲线分析发现,Youden指数在EDSSS为5.5分时达到最大,为0.401,但能否将5.5分作为判断预后不良的临界值,其合理性有待进一步研究证实。该结果同时提醒ICU医师,当脓毒症患者EDSSS≥6分时,应特别关注。APACHEⅡ评分提示脓毒症预后不良的诊断截点与既往研究类似,当APACHEⅡ评分超过20.5分,提示预后不良。
EDSSS共包含8个指标,本研究中两组患者的呼吸、心率、收缩压、GCS评分和脉搏氧饱和度差异有统计学意义,其中呼吸、GCS评分和收缩压也是快速序贯器官功能衰竭评分(rapid sequential organ failure assessment,qSOFA)中的评价指标,间接证实了EDSSS的科学性和合理性。脓毒症患者可出现低血压和休克,机体通过代偿引起心率增快,此外脓毒症心肌损伤、心肌炎也可导致心率增快[8],因此死亡组患者心率高于存活组。本研究中死亡组患者脉搏氧饱和度低于存活组,考虑与本组脓毒症患者中超过50%的原发感染在肺部有关,肺部感染严重者氧合指数差,患者病死率也相应增高。两组患者年龄、皮肤变化和体温3个指标无统计学差异,可能存在以下原因:(1)年龄:本研究纳入的大多数为老年患者,平均年龄(72.75±12.95)岁,而 Smyth 等[4]研究中验证组患者平均年龄为62岁;(2)皮肤变化:本研究为回顾性研究,患者在转入ICU或直接收住ICU时的皮肤变化只能参考当时的病程记录,可能存在记录不够完整的情况,导致结果与实际情况存在一定差异;(3)体温:本研究中两组患者出现高热的比例较低,平均体温均低于37.2℃,仅死亡组患者体温的标准差较大。
综上所述,EDSSS临床工作量相对较小,对脓毒症患者的病情和预后有较好的判断价值,值得推广使用。

