基于增强CT特征的logistic模型预测胸腺上皮肿瘤组织学分型
何晓东 舒震宇 李杰 徐玉芸 林毅
胸腺上皮肿瘤(thymic epithelial tumors,TETs)是前纵隔最常见的原发肿瘤,起源于胸腺上皮细胞,2015年WHO将胸腺上皮肿瘤分为A型、AB型、B1型、B2型、B3型、胸腺癌(C型),在一定程度上反映了肿瘤的生物学行为及预后[1]。肿瘤组织分型及根治性切除手术是影响患者预后的独立因素[2-3],但是组织分型需术后病理评估,目前最常用的术前评估方法是CT检查[4-5]。本研究基于增强CT的特征,建立并验证胸腺上皮肿瘤组织学分型的logistic预测模型,旨在探讨CT在预测胸腺上皮肿瘤组织学分型中的应用价值。
1 对象和方法
1.1 对象 回顾2015年12月至2020年6月在浙江省人民医院行增强CT检查并经病理检查证实的胸腺上皮肿瘤患者178例。纳入标准:增强CT检查后2周内病理确诊。排除标准:(1)因CT图像质量影响评估者;(2)临床资料不全者;(3)病理检查前行放化疗等抗肿瘤治疗者。根据检查时间先后按7:3比例分为训练组和测试组,2015年12月至2019年3月的124例患者纳入训练组,构建logistic预测模型;2019年4月至2020年6月的54患者纳入测试组,用以验证模型的预测效能。
1.2 CT检查方法和影像分析 采用多排螺旋CT扫描仪(Siemens公司,Definition AS40和Definition AS128),所有患者均行平扫及增强检查,扫描范围肺尖至肺底,采集层厚1 mm,重建层厚5 mm。增强扫描采用非离子型对比剂碘佛醇(浓度 350 mgI/ml,流率 3~3.5 ml/s,剂量1.5~2.0 ml/kg),分别于对比剂注射后 25~30 s和 45~60 s进行增强扫描。由2位中级职称以上的影像诊断医师进行独立盲法阅片,评估内容包括:肿瘤大小,形态(圆形、椭圆形、分叶、不规则),边界(清晰、不清晰),强化程度(轻度、中度、明显),强化方式(均匀,不均匀)及是否有坏死、钙化、心包膜侵犯、胸膜侵犯、大血管侵犯、心包腔积液、胸腔积液、纵隔淋巴结肿大(短径≥10 mm)。
1.3 病理组织学分型 依据2015年WHO分型标准,将 TETs分为6种亚型:A型、AB型、B1型、B2型、B3型、胸腺癌(C型)。根据不同亚型的生物学行为差异性,简化分型为低危组(A、AB、B1)、高危组(B2、B3)和胸腺癌3个亚型。
2 结果
2.1 3组患者临床资料及CT特征分析 共计纳入178例胸腺上皮肿瘤患者,男97例(54.5%),女81例(45.5%);年龄 22~82(51.25±12.58)岁。低危组 91例(A 型 13例,AB型41例,B1型37例),高危组43例(B2型24例,B3型19例),胸腺癌44例。3组年龄、性别比较差异均无统计学意义(均P>0.05)。178例患者中出现重症肌无力43例(24.2%),3组重症肌无力比例比较差异有统计学意义(P<0.05),且高危组高于胸腺癌组(P<0.05)。肿瘤大小在低危组、高危组、胸腺癌中逐渐增大,低危组肿瘤形态规则(圆形、椭圆形)比例高于高危组及胸腺癌组,差异均有统计学意义(均P<0.01)。肿瘤边界不清、有坏死、强化不均匀、心包膜侵犯、大血管侵犯、胸膜侵犯、心包腔积液、胸腔积液、肿大淋巴结在胸腺癌和高危组中比例均高于低危组(均P<0.01)。钙化和强化程度在3组间差异无统计学意义(均P>0.05),见表1及图1-6。
2.2 logistic回归模型建立与验证 通过训练集数据进行单因素logistic回归分析,筛选出高危胸腺瘤、胸腺癌组的影响因素,年龄、大小、形态、边界、坏死、强化方式、心包膜侵犯、大血管侵犯、胸膜侵犯比较差异均有统计学意义(均P<0.05)。多因素logistic回归分析显示形态、边界、心包膜侵犯为预测高危胸腺瘤、胸腺癌的独立因素,见表2。
通过测试集数据验证logistic预测模型,ROC分析显示,在训练集中的AUC、准确性、特异度、灵敏度分别为 0.900、0.880、0.909、0.759,在测试集中的 AUC、准确度、特异度、灵敏度分别为 0.889、0.852、0.840、0.793,见图7。Hosmer-Lemeshow检验显示在训练集和验证集中均无统计学差异(均P>0.05),表明拟合无偏差。校准曲线在训练和验证集中显示出良好的校准性能,见图8。另外DCA曲线显示在训练集和验证集中均表现了很好的净效益,见图9。
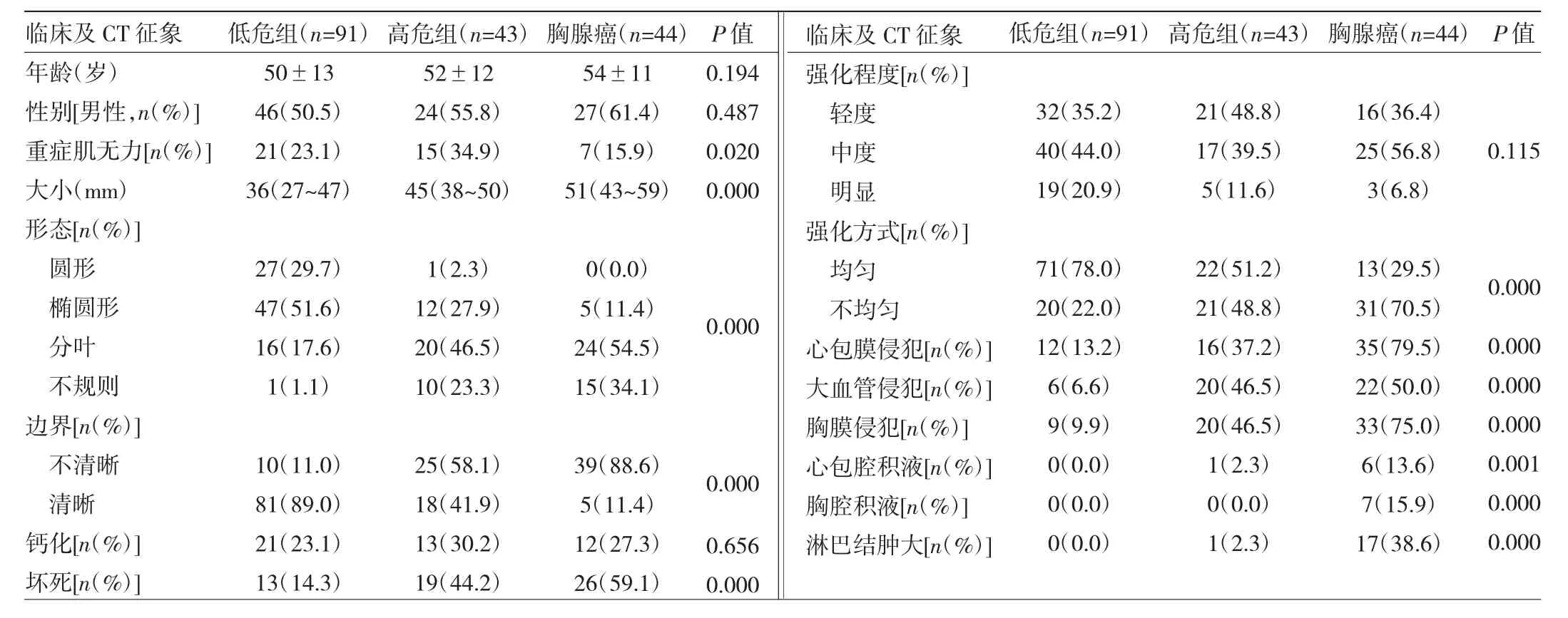
表1 3组患者临床资料及CT特征分析
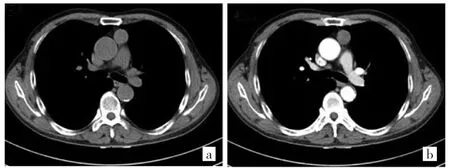
图1 63岁男性A型胸腺瘤(低危组)患者CT图像(a:平扫前纵隔圆形肿块,边界清;b:增强扫描病变均匀、轻度强化,邻近结构无侵犯)

图2 29岁女性AB型胸腺瘤(低危组)患者CT图像(a:平扫前纵隔分叶状肿块,边界清;b:增强扫描病变均匀、中度强化,邻近结构无侵犯)
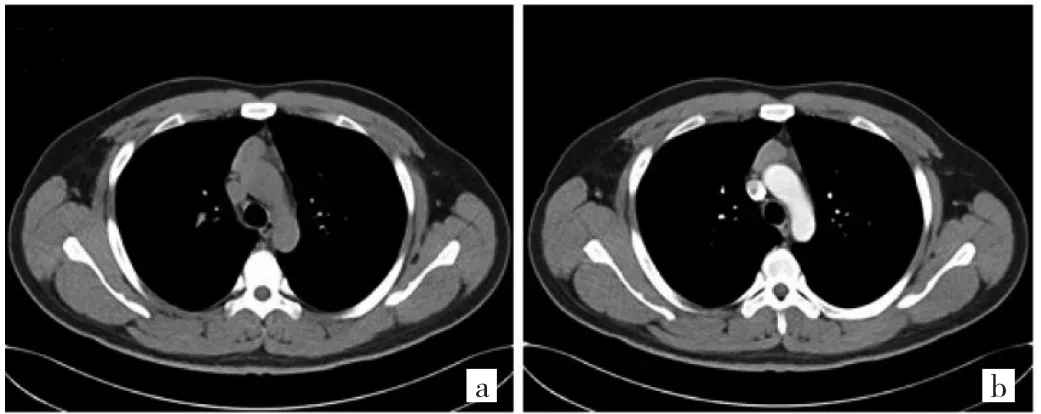
图3 26岁男性B1型胸腺瘤(低危组)伴重症肌无力患者CT图像(a:平扫前纵隔椭圆形肿块,边界清;b:增强扫描病变均匀、轻度强化,邻近结构无侵犯)

图4 46岁男性B2型(胸腺瘤高危组)患者CT图像(a:平扫前纵隔分叶状肿块,环形钙化;b:增强扫描病变不均匀、中度强化,胸膜局部受侵)
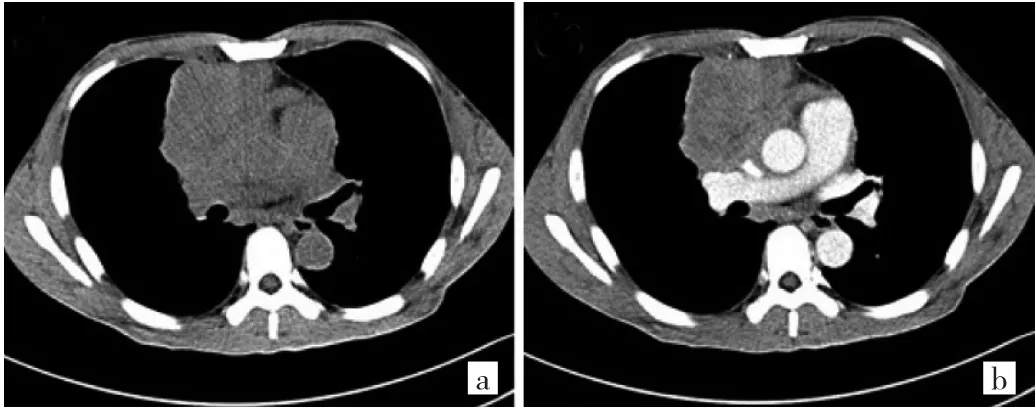
图5 73岁男性B3型胸腺瘤(高危组)患者CT图像(a:平扫前纵隔分叶状肿块,斑点状钙化;b:增强扫描不均匀、明显强化,胸膜受侵)
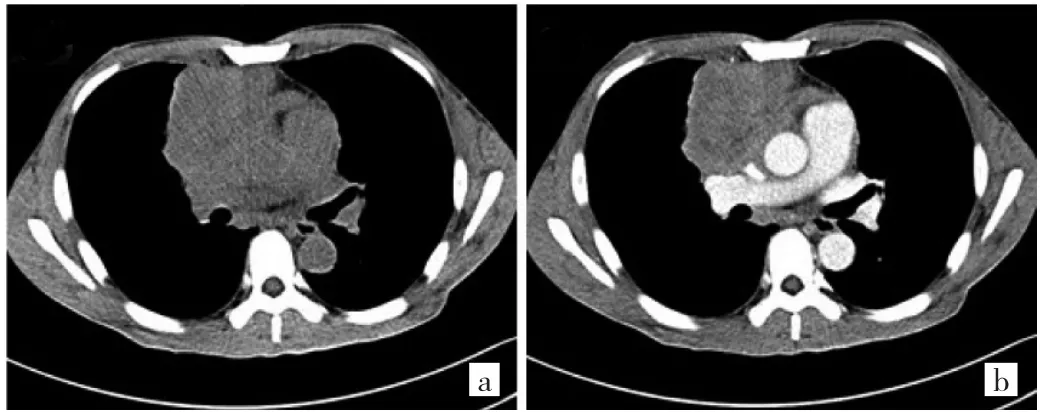
图6 53岁男性胸腺癌患者CT图像(a:平扫前纵隔不规则肿块,边界不清;b:增强扫描不均匀、轻度强化,胸膜、大血管、心包受侵,纵隔淋巴结肿大)
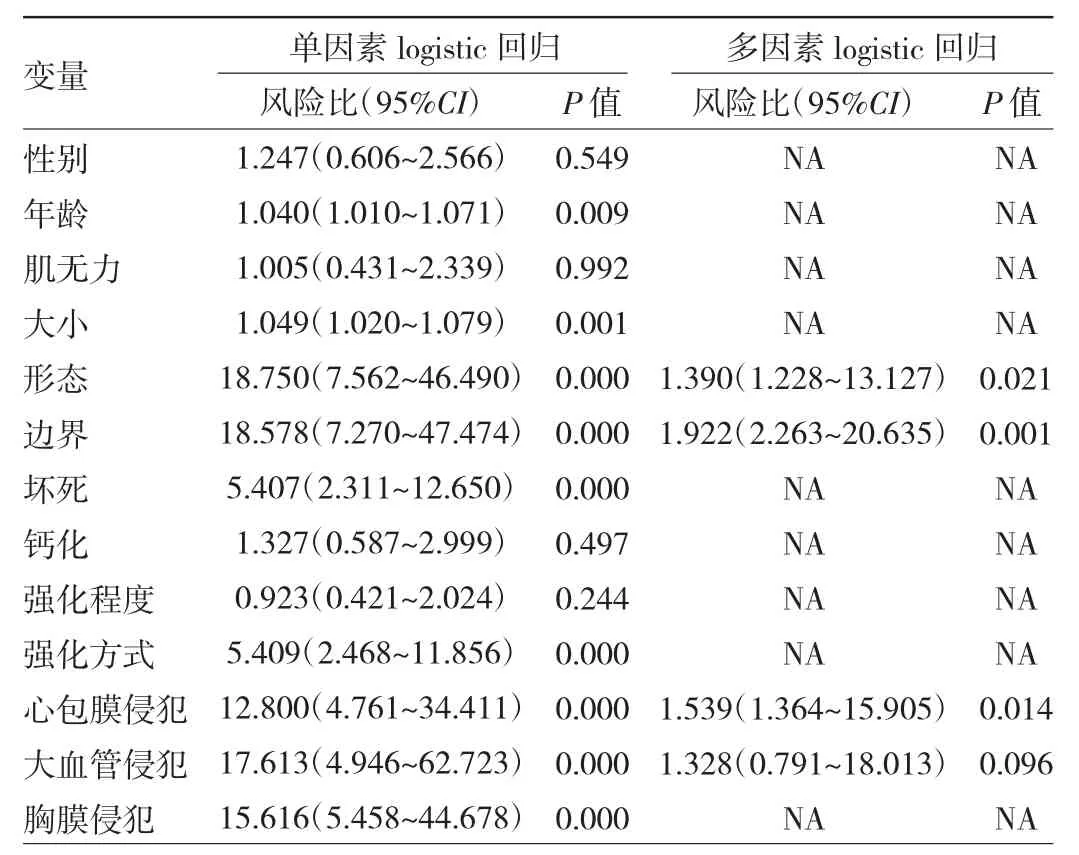
表2 预测高危胸腺瘤、胸腺癌的logistic回归分析
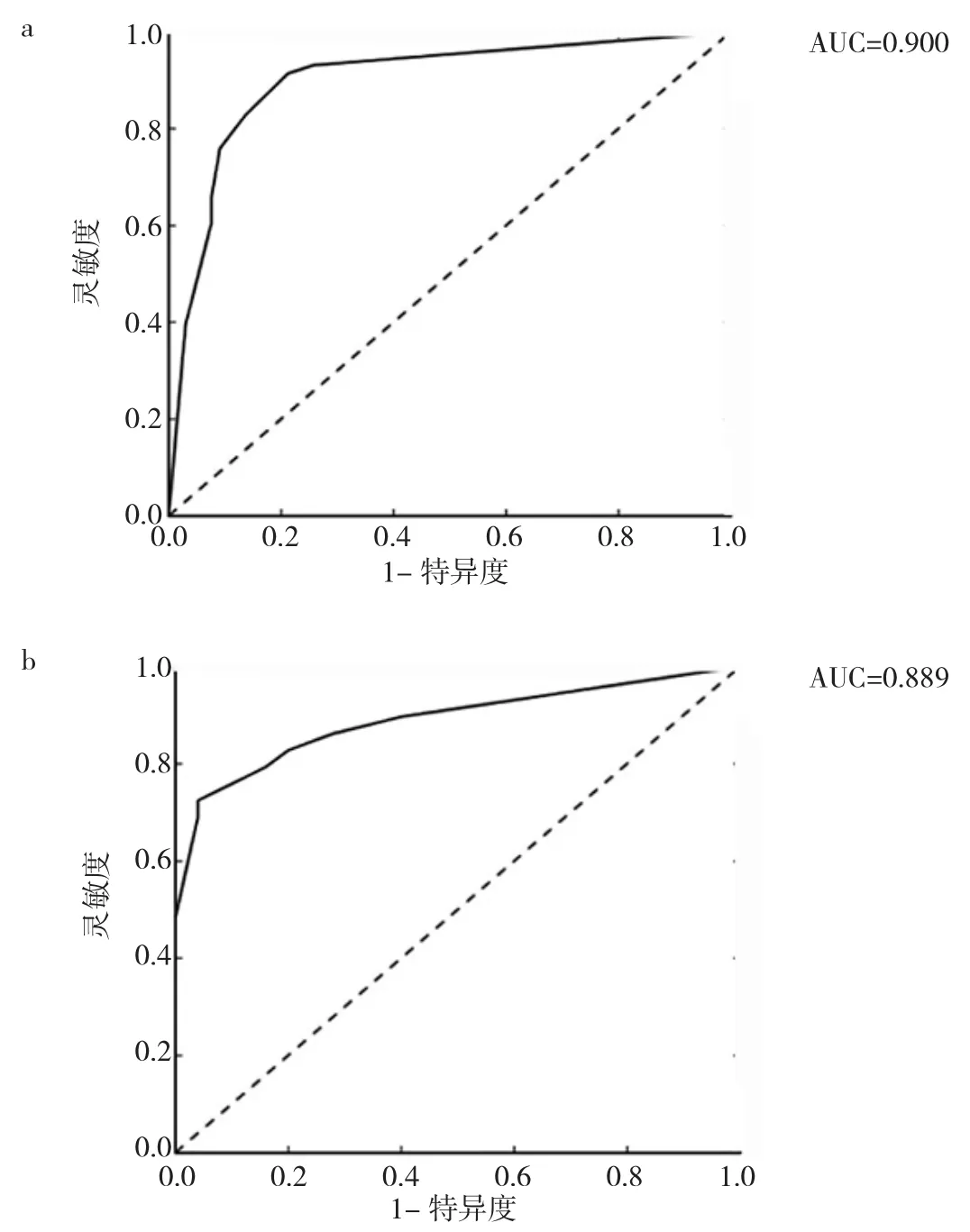
图7 logistic回归模型预测胸腺癌、高危组的ROC曲线(a:训练组;b:测试组)
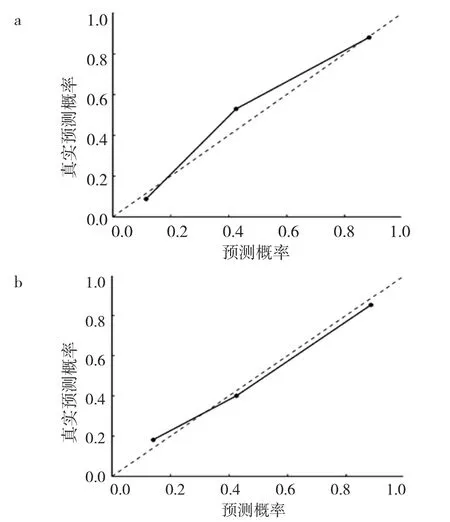
图8 logistic回归模型预测胸腺癌、高危组的校正曲线(a:训练组;b:测试组;虚线是理想模型所在的参考线,实线表示模型预测性能偏差的修正)

图9 logistic回归模型预测胸腺癌、高危组的决策曲线(a:训练组;b:测试组;D1代表没有患者为胸腺癌、高危组的假设决策曲线;D2代表模型的决策曲线,虚线代表所有患者均为胸腺癌)
3 讨论
胸腺上皮肿瘤的病理组织学分型、临床分期及完整手术切除是影响患者预后的独立因素[6]。影像学检查是TETs评估的重要方法[7-10],CT检查可以直观反映肿瘤的形态、轮廓,评估肿瘤内部特征、邻近组织侵犯情况及有无淋巴结转移等,是TETs术前诊断和预后评估的主要方法[11-12],但不同组织学亚型的影像学特征存在较多重叠[13-14]。流行病学显示大约15%~20%的胸腺瘤伴发重症肌无力[15],本组患者中重症肌无力43例(24.2%),且在高危组中比例较高,差异有统计学意义,与文献报道相符[16],可能与B型胸腺瘤更易伴发重症肌无力有关,A型胸腺瘤及胸腺癌很少伴发重症肌无力。年龄、性别在不同组织亚型中的差异均无统计学意义。
本研究显示,肿瘤大小在低危组、高危组和胸腺癌中逐步增大,3组间差异有统计学意义,与文献报道一致[14,17],提示肿瘤大小与恶性程度相关。Moon等[18]研究亦显示肿瘤大小与分期相关。张正平等[13]研究显示高危组直径明显小于低危组及胸腺癌组,认为可能与高危组更易出现重症肌无力、更易早期发现病变有关,但本组患者中亦发现高危组重症肌无力比例较高。本研究显示胸腺癌形态多不规则或分叶状,低危胸腺瘤多呈圆形或椭圆形,而高危胸腺瘤形态可多样化。边界不清,包膜不完整,内部坏死,邻近结构(心包、胸膜、大血管)受侵犯多见于胸腺癌及高危胸腺瘤,淋巴结肿大、胸腔积液、心包积液多见于胸腺癌,与文献报道一致[14,17,19]。肿块-肺界面(mass pulmonary interface,MPI)增厚呈尖角或锯齿状,肿块-心脏大血管界面(mass cardiovascular interface,MCI)呈灌铸式生长,是提示邻近结构受侵犯的可靠征象,但MPI、MCI呈紧贴关系时,判断是否受侵仍有较大挑战。
钙化在B型胸腺瘤中更易出现[20],本研究中B型胸腺瘤钙化比例亦较高,但3组间无统计学差异。强化程度及方式在3组间的差异不完全一致。Hu等[19]报道显示,强化程度及方式在鉴别胸腺上皮肿瘤组织亚型中有统计学差异。本组病例显示,胸腺癌更易呈不均匀强化,3组间有统计学差异,强化程度无统计学差异,但在低危组中,明显强化的比例高于胸腺癌,可能与A、AB型胸腺瘤血管结构较其它类型丰富有关。
本研究显示,基于增强CT特征建立高危胸腺瘤、胸腺癌的预测模型是可行的,形态、边界、心包侵犯是其独立预测因子,模型在训练集和测试集中均表现了良好的区分度和校准度。有研究显示利用放射组学特征建立胸腺瘤侵袭性及分型的预测模型[20-22],具有良好的准确性。Yun等[4]利用临床及病理分型对完全切除的肿瘤复发建立预测模型。本研究还有一定局限性,首先本研究是一个回顾性研究,存在选择偏移,其次样本量相对较少,不利于具体病理组织亚型的比较。最后本研究为单中心研究,可能并不适用于其他中心人群,需要在未来的工作中进一步验证这个模型。
综上所述,TETs组织学亚型与CT特征具有一定的相关性,基于CT特征建立的logistic回归模型,能够很好地预测高危胸腺瘤和胸腺癌,有助于术前TETs组织学亚型诊断、治疗决策和预后评估。

